|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Аневризмы грудной аортыК аневризмам грудной аорты относят случаи необратимого локального мешковидного или диффузного расширения аорты в 2 раза или более по сравнению с нормальным диаметром. Первое упоминание об артериальных аневризмах восходит к античным временам — II в. н.э. и связано с именами Galen и Antyllus. В средние века эти вопросы освещались в работах Ambroise Pare (1510—1590) и Andreas Vesalius (1514—1564). Так, А.Раrе заметил связь между сифилисом и заболеваниями аорты, что признавали далеко не все до тех пор, пока в 1895 г. Dohle не представил результаты микроскопических исследований при сифилитическом аортите. В 1757 г. William Hunter описал груд- ную аневризму с пульсацией, визуально определяемой через грудную клетку. История операций на грудной аорте берет начало в 1913 г., когда отечественный хирург Ю.Ю.Джанелидзе впервые в мире выполнил успешное вмешательство на восходящей аорте — ушивание ножевой колото-резаной раны грудной аорты у мужчины 20 лет. Операция состоялась 27 октября под эфир-но-морфийным наркозом, доступ на протяжении 12 см был осуществлен экстраплеврально по левому краю грудины с частичной резекцией II ребра и хряща III ребра. После вскрытия перикарда была выявлена рана по передней поверхности восходящей аорты на 1 см выше проекции фиброзного кольца аортального клапана длиной 8 мм. Рана была ушита тремя узловыми швами, больной выздо- ровел. Данное наблюдение было опубликовано в первой книге «Хирургического архива Вельяминова» за 1916 г. В 1944 г. J.Alexander и F.X.Byron первыми произвели резекцию аневризмы аорты при коарктации с ли-гированием проксимального и листального отделов аорты. В 1947 г. H.B.Shumacker первым в мире осуществил резекцию посткоарктаци-онной аневризмы с анастомозом конец в конец. В 1949 г. H.Swan в такой же ситуации произвел протезирование аорты гомотранспланта-том. В 1954 г. о первой успешной реконструкции при аневризме тора-коабдоминального отдела аорты сообщил S.Etheredge. 18 августа 1956 г. D.A.Cooley и M.E.DeBakey впервые выполнили протезирование восходящей аорты гомотрансплантатом в условиях искусственного кровообращения, а в 1957 г. они же первыми успешно осуществили гомопротезирование дуги аорты. В 1959 г. H.B.Shumacker первым произвел шунтирование от восходящей к брюшной аорте при разрыве нисходящего отдела. В 1962 г. M.N.Wheat впервые выполнил раздельное протезирование аортального клапана и восходящей аорты по поводу аневризмы с иссечением аорты вокруг устьев коронарных артерий, оставленных in situ. При этом линию среза протеза для наложения проксимального анастомоза выкраивали с учетом оставленных коронарных устьев. При синдроме Марфана первое раздельное протезирование аортального клапана и восходящей аорты было произведено L.К.Groves в 1963 г. В 1965 г. E.S.Crawford выполнил первую реконструкцию по поводу аневризмы торакоабдомина-льного отдела аорты с использованием техники имплантации ветвей аорты в протез на площадках. Первое полное замещение восходящей аорты клапансодержащим кондуитом с реплантацией в протез устий коронарных артерий было осуществлено H.Bentall, A.DeBono в 1968 г. В 1981 г. C.Cabrol модифицировал указанную операцию, предложив включать в кровоток низко расположенные устья коронарных артерий с помощью линейного протеза, соединенного с кондуитом. Через 2 года, в 1983 г. H.G.Borst при протезировании дуги аорты оставил дистальный конец протеза свободно лежащим в нисходящей грудной аорте для последующей реконструкции, что получило название техники «хобот слона» (elephant trunk). В 1990 г. E.S.Crawford сообщил о протезировании аорты на всем протяжении от аортального клапана до бифуркации с помощью нескольких последовательных вмешательств, а в 1993 г. L.G.Svensson выполнил такое протезирование во время одномоментной операции. В России первая успешная операция по поводу мешотчатой аневризмы дуги аорты была произведена А.Н.Бакулевым в 1952 г. [Бакулев А.Н., Комаров Б.Д., 1963]. Первую удачную операцию при посттравматической аневризме перешейка аорты провел в 1962 г. М.Н.Аничков в условиях искусственного кровообращения [Бураков-ский В.И., Бокерия Л.А., 1989]. При мешотчатой аневризме восходящей аорты первое успешное вмешательство в условиях искусственного кровообращения выполнил в 1962 г. А.В.Покровский. Им же первым было выполнено по поводу аневризмы дуги аорты полное протезирование дуги аорты и всех бра-хиоцефальных артерий в 1972 г. Первые успешные супракоронар-ную резекцию восходящей аорты с протезированием аортального клапана и операцию Бенталла—Де Бо-но при синдроме Марфана произвел в 1973 и 1979 гг. соответственно Г.И.Цукерман. По локализации аневризмы грудной аорты разделяются следующим образом (рис. 5.51):
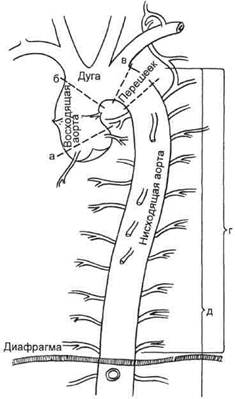
Рис. 5.51. Локализация аневризм грудной аорты. а — аневризмы синуса Вальсальвы; б — аневризмы восходящей аорты; в — аневризмы дуги аорты; г — аневризмы нисходящей грудной аорты; д — аневризмы торакоабдо-минального отдела аорты.
• аневризмы синусов Вальсальвы, т.е. включающие начальный сегмент аорты от фиброзного кольца аортального клапана до синотубу-лярной борозды — линии, на которую проецируются верхние точки комиссур полулунных клапанов восходящей аорты. Эти аневризмы, как правило, носят врожденный характер и рассматриваются в соответствующем разделе врожденных пороков сердца; • аневризмы восходящей аорты, т.е. от уровня синотубулярной борозды до устья брахиоцефального ствола (рис. 5.52); • по предложению D.Cooley, аневризмы восходящей аорты, сопровождающиеся расширением фиброзного кольца аортального клапана, синусов Вальсальвы и потерей синотубулярной борозды, были выделены в отдельную категорию под названием «аннулоаор-тальная эктазия» (рис. 5.53); • аневризмы дуги аорты, включающие сегмент грудной аорты от устья безымянной артерии до уровня отхождения левой подключичной артерии; • аневризмы нисходящей аорты, располагающиеся в сегменте грудной аорты между левой подключичной артерией и аортальным отверстием диафрагмы;
Рис. 5.52. Чреспищевод-ная ЭхоКГ. Супракоро-нарная аневризма восходящей аорты.
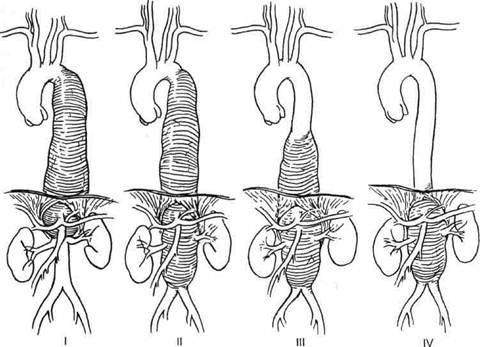
Рис. 5.53. Чреспищевод-ная ЭхоКГ. Аннулоаор-тальная эктазия. • аневризмы торакоабдоминаль-ного отдела аорты, начинающиеся в нисходящей аорте и распространяющиеся на ее брюшной отдел. Для характеристики последних используют классификацию Crawford (рис. 5.54): ▲ при I типе торакоабдоминаль-ных аневризм по Crawford поражение начинается в проксимальной половине нисходящей аорты и за-
Рис. 5.54. Классификация торакоабдоминальных аневризм по Crawford. Объяснение в тексте. канчивается выше уровня отхожде-ния почечных артерий; ▲при II типе аневризма распространяется также от проксимальной половины нисходящей грудной аорты до уровня ниже отхождения почечных артерий; ▲при III типе поражение начинается в дистальной половине нисходящей аорты и продолжается на различном протяжении в брюшной аорте; ▲при IV типе аневризма начинается на уровне аортального отверстия диафрагмы и включает брюшной отдел аорты. По этиологии аневризмы грудной аорты разделяются на две большие группы: врожденные и приобретенные. I. Врожденные заболевания. 1. Сердечно-сосудистой системы (дву- или одностворчатый аортальный клапан, стеноз аортального клапана, коаркта-ция аорты, извитость перешейка аорты). 2. Соединительной ткани (синдромы Марфана, Элер-са—Данло и др.). II. Приобретенные заболевания. 1. Невоспалительные, дегене • атеросклероз или дегенерация медии; • послеоперационные (места канюляции аорты, линия шва анастомозов протезов или заплат аорты). 2. Воспалительные: • инфекционные и неинфекционные аортиты; • микотические; • инфекция протеза аорты.
3. Посттравматические. 4. Ятрогенные (катетеризация аорты, баллонная контрпульсация и др.). 5. Идиопатические (медио-некроз Эрдгейма). 6. Гормонально-обусловленные (медионекроз беременных). Патогистологические изменения в аорте при аневризмах. Прежде всего необходимо отметить, что единого мнения и универсальной классификации таких изменений у патологов нет. Коллектив Methodist Hospital of Baylor College of Medicine из Хьюстона, США, располагающий наибольшим опытом хирургического лечения аневризм грудной аорты, придерживается следующей характеристики патогистологических изменений при указанном заболевании [Svensson L.G., Crawford E.S., 1992]: ▲дегенерация медии, проявляющаяся потерей и разрушением эластических волокон; ▲некроз медии как более развернутый процесс дегенерации, при котором начинается потеря гладко-мышечных клеток. Другие авторы называют эту стадию кистозной дегенерацией медии, когда при полной утрате эластических волокон и гладкомышечных клеток медией аорты происходит накопление базо-фильной аморфной субстанции в виде кист [Robbins S.L. et al., 1984]. Термин «кистозный медионекроз», предложенный Erdheim, является не вполне корректным, поскольку истинного клеточного некроза или сопутствующего воспаления в данной ситуации не наблюдается; ▲атеросклероз сочетается с любым типом поражения медиального слоя, что приводит к замещению эластических волокон и гладкомышечных клеток экстрацеллюляр-ным матриксом и липидами. L.G.Swensson и E.S.Crawford предпочитают термину «атеросклероти-ческие аневризмы» понятие «атеро-склеротическое дегенеративное заболевание медии» для описания аневризм у пожилых пациентов. Они обосновывают свое мнение тем, что в таких случаях не всегда удается выявить типичные атероск-леротические изменения, а при их наличии последние чаще встречаются в медии аорты в отличие от артерий меньшего калибра, где вовлекается интима. Инфильтрацию медии аорты атеромой, фиброзной или рубцовой тканью эти авторы рассматривают как результат дегенерации, а не как первичный процесс; ▲ воспалительные аневризмы при Патологическая физиология заболевания. Основой патофизиологических изменений при аневризмах грудной аорты служат три основных процесса: • расширение аорты и его гемо-динамические последствия; • поражение устьев ветвей аорты (брахиоцефальных, межреберных и висцеральных артерий) с развитием ишемии соответствующего органа; • прогрессирующее сдавление окружающих тканей и органов с увеличением размеров аневризмы. Расширение аорты и потеря ее стенками нормальной эластичности приводят к изменению характера потока крови и особенно его диа-столической составляющей. Наиболее важным последствием первого фактора служит появление артериальной гипертензии у таких больных из-за того, что юкстагломеруляр-ный аппарат почек очень чувствителен к извращению профиля пульсовой волны. Нарушение же кровотока в диастолу, особенно при развившейся гипертензии, способствует быстрому формированию недостаточности аортального клапана. Кроме того, при аневризмах восходящей аорты аортальная недостаточность является и следствием нарастающего растяжения фиброзного кольца клапана одновременно с увеличением аневризмы. Возникшая аортальная недостаточность вызывает нарушение коронарного кровотока, осуществляющегося в диастолу, если только сами устья венечных артерий уже не вовлечены в патологический процесс, как иногда при аневризмах восходящей аорты. К возможным патофизиологическим моментам течения аневризм аорты относятся достаточно редкие эпизоды дистальной эмболии при частичном тромбировании аневризматической чаши. Факторами риска развития аневризм грудной аорты считают артериальную гипертензию, возраст и курение [Bickerstaff L.K. et al., 1982]. Некоторые авторы относят к ним и кокаиновую зависимость [Gadaleta D. et al., 1989]. Частота возникновения аневризм грудной аорты составляет 5,9 случая на 100 000 населения в год. Эти данные были получены L.К.Bickerstaff и соавт. в ходе популяционного исследования в Рочестере (Миннесота), когда такие аневризмы были выявлены у 72 больных. В 51 % наблюдений аневризмы локализовались в восходящей аорте, в 11 % — в дуге аорты и в 38 % — в нисходящем отделе. Причинами образования аневризм явились: расслоение аорты — у 53 %, атеросклероз (дегенерация медии) — у 29 %, медио-некроз — у 6 % и сифилис — у 4 % пациентов. Средний возраст больных в момент установления диагноза составил для мужчин 65 и для женщин — 77 лет. Соотношение мужчин и женщин среди пациентов, которые оперируются по поводу указанных аневризм, составляет приблизительно 2:1 [Pressler V., McNamara J.J., 1980]. Той же группой Bickerstaff была прослежена судьба неоперирован-ных пациентов с аневризмами грудной аорты за 30-летний период. Разрыв аневризм среди указанных 72 больных произошел в 74 % наблюдений (95 % — при расслоении аорты, 51 % — при нерасслаиваю-щих аневризмах), причем при разрывах летальность достигала 94 %. Средний срок между установлением диагноза и наступлением разрыва аневризмы составил 2 года. Пятилетняя выживаемость среди этих пациентов составила 13 % (7 % — при расслоениях аорты, 19 % — среди больных без расслоения), тогда как ожидаемая выживаемость за тот же срок в популяции была равна 75 %. Аналогичные данные представили V.Pressler и соавт., отметившие среди неоперированных пациентов летальность до 78 %. Среди больных с атеросклеротическими аневризмами восходящей или нисходящей аорты 44 % погибли от разрыва, а 33 % — от других сердечно-сосудистых осложнений. По данным этих авторов, локализация аневризмы (восходящий или нисходящий отдел) не влияла на риск разрыва, если только эти аневризмы не сопровождались расслоением аорты. E.S.Crawford, R.W. De Natale (1986) среди 94 пациентов с торакоабдоминальными аневризмами, которые не были оперированы по различным причинам, отметили, что через 2 года в живых оставалось только 24 % больных. Клиническая картина при аневризмах грудной аорты весьма вариабельна и зависит от локализации и размеров аневризмы. Приблизительно в 75 % наблюдений заболевание протекает совершенно бессимптомно и выявляется случайно (чаще при рентгенографии или КТ грудной клетки, реже при физика-льном осмотре или ультразвуковом обследовании). В ряде случаев клиника достаточно скудна. Наиболее характерными симптомами при аневризмах восходящего отдела аорты являются загрудинные боли вследствие или самого поражения стенки аорты (сифилитический и неспецифический аортит), или сдавления окружающих органов, или стенокардитического ха- рактера при поражении коронарных артерий. Компрессия верхней полой вены сопровождается отеками верхних конечностей, головы и шеи. Для данной локализации аневризм типичны симптомы сердечной недостаточности (сердцебиение, одышка, головокружение, снижение физической выносливости) из-за сопутствующего поражения аортального клапана. При аневризмах дуги и нисходящего отдела грудной аорты болевой синдром может возникать как за грудиной, так и в межлопаточной области. При этом местоположении аневризм более характерна симптоматика, связанная с компрессией окружающих органов и тканей. Так, сдавление пищевода проявляется дисфагией, при компрессии возвратного нерва возникает дис-фония, а при сдавлении блуждающего нерва — брадикардия и слюнотечение. Компрессия трахеи и левого главного бронха может сопровождаться одышкой, стридором, развитием застойных явлений в легких. Поражение аневризматиче-ским процессом ветвей дуги аорты может сопровождаться клиникой хронической сосудисто-мозговой недостаточности, симптомами преходящих или острых нарушений мозгового кровообращения по по-лушарному либо вертебробазиляр-ному типу. Аневризмы торакоабдоминально-го отдела аорты часто сопровождаются болью в животе, особенно в эпигастральной области; для них характерна симптоматика, связанная с вовлечением в процесс ветвей брюшной аорты и развитием ишемии соответствующих органов. Это признаки хронической абдоминальной ишемии при поражении чревного ствола и верхней брыжеечной артерии, тяжелая вазоренальная ги-пертензия вследствие сужения почечных артерий, в некоторых случаях ишемия нижних конечностей. Очень редко при окклюзии межре- берных артерий развиваются ише-мические повреждения спинного мозга вплоть до парапарезов и параплегии. Наиболее грозным осложнением при аневризме грудной аорты является ее разрыв. Клиническая картина при разрывах характеризуется в первую очередь выраженным коллапсом часто на фоне предшествовавшего или сохраняющегося очень сильного болевого синдрома. Остальные симптомы связаны с локализацией разрыва. Для аневризм восходящей аорты это прежде всего массивный гемо-перикард. Кровотечение в клетчатку средостения возможно для аневризм как восходящего отдела, так и дуги аорты. Для локализации разрыва в нисходящем отделе или дуге аорты характерен обширный гемоторакс, реже массивное пищеводное или легочное кровотечение. Небольшая рецидивирующая рвота алой кровью может предшествовать обширному прорыву аневризмы в пищевод или трахеобронхиальное дерево. Очень редко разрыв аневризмы нисходящей грудной аорты происходит субплеврально (между париетальной плеврой и мышечно-ребер-ным каркасом грудной клетки). Для аневризм торакоабдоминаль-ного отдела характерен разрыв в свободную брюшную полость или забрюшинное пространство, реже в желудок или двенадцатиперстную кишку, когда отмечается рвота алой кровью и/или мелена. Наиболее редкая локализация разрыва аневризм восходящей аорты и торакоаб-доминального отдела — прорыв в верхнюю полую и нижнюю полую вены соответственно. Клиническая картина в этих ситуациях характеризуется остро развивающейся сердечной недостаточностью. Физикальная диагностика. Сбор анамнеза может указать на наличие врожденных заболеваний аорты у родственников (синдром Марфана), перенесенная травма грудной клетки типична для аневризм перешейка аорты. Важно выяснить факт заболевания в анамнезе сифилисом, перенесенный эпизод острого системного воспаления (неспецифический аортоартериит). Внешний осмотр пациента с аневризмой грудной аорты обычно малоинформативен, за исключением больных с синдромом Марфана. Следует обращать внимание на видимую невооруженным глазом пульсацию в надключичных областях и яремной вырезке, что в ряде случаев является признаком аневризмы грудной аорты. Редко при гигантских аневризмах (в основном сифилитических) происходят узура-ция и деструкция ребер и грудины, так что пульсация аневризмы видна прямо под кожей. У худых пациентов с торакоабдоминальными аневризмами больших размеров можно увидеть пульсацию передней брюшной стенки. Пальпация эффективна при определении асимметрии пульсации периферических артерий, что может указывать на вовлечение в аневризматический процесс ветвей дуги аорты или подвздошных артерий. Асимметрию пульсации следует определять с той же целью в надключичных областях и яремной вырезке. При аневризмах торакоабдо-минального отдела аорты пульсация в эпигастральной и мезогастра-льной областях помогает определить размер аневризмы, ее соотношение с органами брюшной полости и провести дифференциальную диагностику между торакоабдоми-нальной аневризмой и аневризмой инфраренального отдела брюшной аорты. Если поперечно расположенной к ходу аорты ладонью удается отграничить аневризму от реберной дуги, т.е. аккуратно и медленно завести ее между пульсирующим образованием и реберной дугой, то, как правило, аневризма не распространяется выше уровня от- хождения почечных артерий от брюшной аорты. Наиболее важным среди физика-льных методов является аускульта-ция. Наличие систолического шума над аортой определяется в 70 % случаев при аневризмах грудной аорты. При выслушивании шума над ветвями дуги и брюшного отдела аорты нельзя делать однозначный вывод о сужении этих сосудов, так как шум может проводиться с аневризмы аорты. При аускульта-ции аортального клапана можно сделать предварительный вывод о наличии аортальной недостаточности (при выслушивании диастоли-ческого или систолодиастолическо-го шума). Разрыв аневризм грудной аорты проявляется, кроме описанных выше признаков, резким ослаблением или исчезновением шумовой симптоматики, а при торакоабдо-минальных аневризмах контуры аневризмы при пальпации становятся нечеткими. При разрыве аневризм в верхнюю или нижнюю полые вены возникает грубый сис-толодиастолический шум, который может проводиться до правых камер сердца. Инструментальная диагностика. Очень важной манипуляцией является измерение АД на всех четырех конечностях (манжеточным методом или с помощью допплерогра-фии). В норме АД на ногах должно равняться АД на руках или превышать его не более чем на 10—20 мм рт.ст. Градиент АД более 10 мм рт.ст. между руками может свидетельствовать о поражении ветвей дуги аорты или стенозе аорты при аневризмах дуги и нисходящего отдела. Градиент АД между руками и ногами (со снижением АД на ногах) может говорить о стенозировании аорты при аневризмах нисходящего или торакоабдоминального отдела. Самым доступным и одновременно очень информативным методом инструментальной диагностики является стандартная рентгенография. До 50 % аневризм грудной аорты выявляют при рентгенологическом исследовании, выполнявшемся по другому поводу или профилактически [Бураковский В.И., Бокерия Л.А., 1989]. Уже рентгенография грудной клетки в перед-незадней проекции дает информацию о расширении и положении восходящей аорты, а также о состоянии перешейка аорты (образование в левом куполе плевральной полости). При многопроекционной (обе косые и боковая проекции) рентгенографии с контрастированием пищевода можно сделать детальный вывод о характере и объеме поражения всех отделов грудной аорты. Дополнительная информация о состоянии грудной аорты может быть получена на основании признаков сдавления трахеи и бронхов, пищевода. Обызвествление по контуру аорты в большинстве случаев свидетельствует об анев-ризматическом поражении аорты. При подозрении на аневризму грудной аорты на основании клинических данных или результатов стандартной рентгенографии грудной клетки наиболее точным и доступным методом неинвазивной диагностики является компьютерная томография с контрастным усилением. При исследовании необходимо сканировать как грудной, так и брюшной отделы аорты, поскольку 25 % больных с аневризмами грудного и 10 % с аневризмами брюшного отдела аорты имеют более чем одну аневризму по локализации. Прежде всего КТ позволяет быстро и точно оценить наружный размер и протяженность аневризмы, что особенно важно при разрыве аневризмы или расслоении аорты. Очень важной при КТ является информация об экстравазации крови и состоянии окружающих аорту тканей. Кроме того, КТ предоставляет следующие сведения: размеры стенок аорты и их изменения, со- держимое просвета аорты (тромб, отслоенная интима), проходимость и вовлечение ветвей аорты, вовлечение костных структур (грудина, позвоночник), расположение, степень вовлечения и размер прилежащих магистральных сосудов, наличие аортовенозных фистул, толщина стенок желудочков сердца, каль-циноз коронарных артерий и их проходимость, равно как и проходимость аортокоронарных шунтов, наличие жидкости в" полости перикарда. КТ имеет исключительное значение при динамическом мони-торировании размеров грудной аорты. Новая модификация КТ — трехмерная спиральная КТ-ангиогра-фия — позволяет детально воспроизвести структуру внутреннего просвета аорты и ее ветвей, но окончательно ее диагностическая ценность не установлена. Применение КТ с контрастным усилением может оказаться проблематичным у больных с почечной недостаточностью, особенно при необходимости проведения еще и ангиографии. В таких ситуациях в первую очередь выполняют ангиографию и сразу же после нее, пока контраст продолжает циркулировать в крови, проводят КТ. При КТ невозможно оценить функцию аортального клапана, и информация о состоянии устьев ветвей аорты является более скудной, чем при проведении магнитно-резонансной томографии (МРТ) или ангиографии. В случаях полного тромбоза ложного просвета при расслоении при КТ невозможно увидеть отслоенную мембрану, если она только не кальцинирована, что создает впечатление об обычной аневризме аорты с пристеночным тромбозом. После получения необходимой диагностической информации по данным КТ следующим шагом в планировании операции является проведение ангиографии. Для полной оценки состояния грудной аор- ты исследование проводят в 3 проекциях — прямой, левой косой и боковой. У больных, которым предполагается выполнение повторной операции на грудной аорте, очень важна оценка ангиограмм в боковой проекции, так как становится возможным определить глубину промежутка между восходящей аортой и задней поверхностью грудины. В указанных ситуациях необходимо убедиться, что тромб по передней поверхности аорты не увеличивает ложно это расстояние. Из тех же соображений при контрастном исследовании грудной аорты следует использовать не методику дигитальной субтракционной ангиографии, а традиционную широкоформатную съемку, поскольку при расслоениях с полным тромбозом ложного просвета или большом пристеночном тромбе в аневризме наружные контуры аорты могут быть не видны за счет вычитания, а будет определяться только контра-стированный просвет. Для определения состояния ветвей аорты, особенно ветвей дуги, показана диги-тальная субтракционная ангиография. Ангиография позволяет выявить аортальную регургитацию, а при введении контрастного вещества в полость левого желудочка оценить показатели сократительной способности миокарда и определить наличие или отсутствие митральной регургитации. При показаниях после селективной катетеризации одновременно выполняют ко-ронарографию в тех же трех проекциях. В целом до настоящего времени аортография остается непревзойденным методом пространственной визуализации аорты на всем протяжении, четко определяющим состояние ее просвета, нарушение проходимости ее ветвей, расположение проксимальных и дистальных фене-страций, направление хода истинного просвета вдоль аорты при расслоении, локализацию разрывов. К недостаткам метода следует отнести осложнения, связанные с применением контрастного вещества (почечная недостаточность и различные виды аллергических реакций) и множество вариантов осложнений, связанных с пункцией сосудов и внутрипросветными манипуляциями с катетерами, проводниками, интрадьюсерами и т.д. Наиболее значительным преимуществом магнитно-резонансной томографии является возможность определения присутствия крови в жидкостных скоплениях, а если это кровь, то является ли ее накопление острым или хроническим, а также различать тромб, гематому и медленный кровоток. Такая информация имеет особую ценность при расслоении или инфекции протеза аорты с образованием перипротез-ных жидкостных скоплений. МРТ предоставляет важную информацию о состоянии сосудистой стенки и окружающих тканей, позволяя четко определять воспалительные аневризмы. В диагностике расслоений аорты этот метод является одним из самых точных, поскольку позволяет отличать даже самую тонкую отслоенную мембрану от крови. Вследствие того что МР-то-мографы не содержат движущихся частей, может быть получено изображение любого среза тела, в том числе построение трехмерных реконструкций. С помощью МРТ возможно получение информации о функции сердца, клапанов, проходимости коронарных артерий, кровотока в аорте и ее ветвях, пространственном соотношении крупных сосудов, состоянии просвета аорты и аортальной стенки. Принципиально МРТ предоставляет те же сведения, что и КТ, за исключением перечисленных выше преимуществ, и не требует применения контрастного вещества и облучения. Тем не менее этот метод имеет ряд существенных ограничений. Так, изучение движущихся структур требует синхронизации с ЭКГ больного, что создает проблемы при аритмиях. Если в тело пациента инкорпорирован какой-либо металл (электрокардиостимуляторы, хирургические клипсы и т.д.), за исключением титана, то проведение магнитно-резонансной томографии становится невозможным. В томографе невозможно также разместить больного, нуждающегося в постоянной инфузионной или респираторной поддержке. Исследование требует более длительного времени, чем КТ, что ограничивает его применение у нестабильных больных. На сегодняшний день МРТ является менее доступным и более дорогим методом исследования, чем КТ, и реально служит одним из диагностических стандартов только при плановых ситуациях. Трансторакальная эхокардиогра-фия у большинства пациентов позволяет визуализировать корень аорты и проксимальную часть восходящей аорты, выявить расширение этого сегмента аорты, утолщение стенки, наличие отслоенной интимы, сдавление левого предсердия. Аневризмы восходящей аорты могут быть впервые случайно выявлены при эхокардиографическом исследовании по другому поводу. Эхокардиография также позволяет получить информацию о наличии и выраженности аортальной недостаточности, выпота в полости перикарда, систолической и диастоличе-ской дисфункции левого желудочка сердца. Визуализация дуги аорты и нисходящего отдела грудной аорты является обычно более проблематичной и может потребовать длительного кропотливого исследования из многочисленных доступов (су-прастернального, левых и правых высоких парастернальных, над- и подключичных). Даже при оптимальной визуализации трансторакальное исследование, как правило, ограничивается установлением факта расслоения
Рис. 5.55. Чреспищевод-ная ЭхоКГ. Поток аортальной регургитации из ложного просвета через фенестрацию в выводной тракт левого желудочка. аорты и/или наличия аневризмы грудной аорты. Низкая разрешающая способность, связанная с удаленностью зоны интереса от датчика, низкой частотой (3,5 или 2,5 МГц) и множеством препятствий на пути ультразвукового луча (узкие межреберные промежутки, подкожная жировая клетчатка, легкие и др.), не позволяет выявить тонкие детали поражения грудной аорты. У ряда больных в связи с особенностями конституции трансторакальная эхокардиография вообще неинформативна. Чреспищеводная ЭхоКГ позволяет установить точную локализацию и размеры аневризмы в восходящем и нисходящем отделах грудной аорты, наличие тромбов в просвете, оценить функцию аортального клапана (рис. 5.55) и выраженность аортальной регургитации, а главное — достоверно дифференцировать аневризму аорты от расслоения (и интрамуральной гематомы). Высокое разрешение чреспищевод-ной ЭхоКГ дает возможность выявлять интрамуральную гематому и интрамуральное кровоизлияние как ранние проявления расслоения аорты. При обследовании пациентов с подозрением на расслоение аорты с помощью чреспищеводнои ЭхоКГ является невозможность оптимальной визуализации дуги аорты и дистальной части восходящей аорты. Даже использование мульти-
Рис. 5.56. Чреспищевод-ная ЭхоКГ. Посттравматическая ложная аневризма перешейка аорты. плановых чреспищеводных датчиков, обеспечивающих получение продольных срезов восходящей аорты, не позволяет полностью преодолеть «слепое пятно», вызванное интерпозицией трахеи и левого главного бронха между пищеводом и дугой аорты. N.G.Pandian и соавт. в 1990 г. впервые использовали внутрисосу-дистое ультразвуковое исследование у 14 больных с доказанным расслоением и правильно выявили место фенестрации, объем расслоения, вовлечение абдоминальной аорты и ее ветвей и тромбов в ложном просвете. Высокочастотные внутрисо-судистые ультразвуковые датчики позволяют обнаружить минимальные поражения сосудистой стенки, что важно для выявления тонких дефектов, которые не замечают при использовании других технологий. Пока этот метод, используемый в основном в экспериментальных клинических исследованиях, имеет такой же риск осложнений, как при любой артериальной катетеризации, дает очень плохие изображения дуги аорты, не выявляет аортальную недостаточность или пери-кардиальный выпот и, следовательно, не имеет самостоятельной роли в диагностике аневризм грудной аорты. Тем не менее количество со- общений о применении этого метода у больных с расслоением аорты неуклонно возрастает. В целом из применяемых на сегодняшний день перечисленных выше методик ни одна не может претендовать на полную достаточность в диагностике аневризм грудной аорты. Вопрос об объеме инструментальных исследований должен решаться в каждом случае индивидуально в той мере, пока не будет создано полное впечатление о характере поражения аорты и выработана тактика лечения. Кроме того, в плане доопераци-онного обследования у пациентов с аневризмами грудной аорты крайне важной является оценка коронарного (ЭКГ, холтеровское монито-рирование, нагрузочные пробы, ко-ронарография) и миокардиального (эхография и сцинтиграфия миокарда со стресс-тестами) статусов, состояния экстракраниальных отделов сосудов головного мозга (цветное дуплексное сканирование, ангиография, томография мозга), функций внешнего дыхания и сек-реторно-выделительной способности почек. Именно осложнения со стороны этих органов и систем (ле-вожелудочковая недостаточность, инсульты, дыхательная или почечная недостаточность) являются основными причинами летальности АИК, показано исследование проходимости артерий подвздош-но-бедренного сегмента. Дифференциальную диагностику при аневризмах грудной аорты в первую очередь проводят с опухолями средостения и легких. Как правило, на основании данных анамнеза и осмотра не представляется возможным поставить правильный диагноз. Указанную закономерность подтверждает тот факт, что до 1/3больных с аневризмами аорты попадают в специализированные стационары после ранее выполненной торакотомии по поводу ошибочно предполагавшейся опухоли легких или кисты средостения. Только при детальном анализе результатов ультразвукового исследования, КТ или МРТ и ангиографии можно поставить правильный диагноз. Показанием к операции в плановом порядке при аневризме грудной аорты является прежде всего ее симптомное течение, к экстренному вмешательству — ее разрыв. При асимптомном течении таких аневризм хирургическое лечение считается показанным при расширении аорты, превышающем нормальный диаметр вдвое (т.е. фактически при наличии диагноза аневризмы грудной аорты), или же, по данным некоторых авторов, при расширении аорты до 5—6 см. Выбор указанных значении определяется следующими обстоятельствами. Так, при расширении аорты менее 5 см летальность при плановых реконструкциях не превышает 2 %, а средний диаметр разорвавшихся неопериро-ванных аневризм грудной аорты, по данным ретроспективных исследований, составляет 6—10 см. Тем не менее, по данным Methodist Hospital, у 12 % больных с разрывами грудной аорты, в том числе и при расслоении, размер аорты составлял менее 5 см. Кроме того, операция считается показанной при скорости увеличения диаметра аневризмы (по данным рентгенографии, КТ или МРТ, эхографии) более 1 см в год, поскольку такой рост является предвестником разрыва. Если вести речь о возрасте как об относительном противопоказании к хирургическому вмешательству, а такое мнение поддерживается некоторыми специалистами, то его сложно признать обоснованным. Так, по данным Реrkо и соавт., среди пациентов старше 70 лет с не-оперированными грудными аневризмами в течение 1,5 года после установления диагноза погибло от разрыва аорты 50 % больных, тогда как среди выживших после реконструкции ожидаемая продолжительность жизни не отличалась от таковой в общей популяции. Противопоказанием к плановой операции по поводу аневризм грудного отдела аорты следует считать наличие у больного печеночно-по-чечной недостаточности, застойной сердечной недостаточности, а также недавно перенесенный (в сроки до 2—3 мес) инсульт или инфаркт. Дата добавления: 2015-02-06 | Просмотры: 1735 | Нарушение авторских прав |