|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Врожденные деформации дуги аорты
Врожденная деформация дуги аорты — это врожденный порок аорты, который характеризуется удлинением, извитостью и перегибами дуги аорты при патологическом строении ее стенки. Врожденная извитость дуги аорты в литературе имеет самые различные названия. За рубежом она известна как шейная дуга аорты; субклиническая коарктация; псевдокоарктация, атипичная коарктация, кинкинг, баклинг, мегааорта, лупинг, умеренная коарктация, двойной изгиб дуги аорты (рис. 5.35). Н.Rosier и P.D.White в 1931 г. впервые описали необычно извилистую и удлиненную нисходящую аортальную дугу на материале двух секций. T.Beavan и соавт. в 1947 г. привели случай резко удлиненной аномальной дуги аорты, выходящей на шею справа. Эти авторы ссылаются на D.Reid, который в 1914 г. наблюдал аналогичный вариант у недоношенного плода. W.Reich (1949) в работе о болезнях аорты кратко описал одно наблюдение, очень сходное с аномально изогнутой удлиненной дугой аорты. C.Soulders и соавт. в 1951 г. подробно представили анатомическую структуру аномально изогнутой удлиненной дуги аорты и впервые попытались изложить клинические проявления этой редкой патологии (3 наблюдения). Следует отметить, что в одном из этих наблюдений правильный диагноз был поставлен во время торакотомии у больного, оперированного по поводу болезни Хачкина. Во время операции была выявлена истинная природа «сосудистых нарушений». Названные авторы впервые попытались идентифицировать эту тяжелую врожденную патологию дуги аорты с коарк-тацией, назвав ее «субклинической формой коарктации». C.Dotter и соавт. (1951) и G.Robb (1951) поставили 3 подобным больным диагноз «псевдокоарктация» и «атипичная коарктация аорты». Di L.Guglielmo и M.Guttadauro (1955) к имеющимся добавили еще 2 случая, уже диагностированных ангиографически, и ввели оригинальный термин «кинкинг» аорты, используемый в целом ряде последующих сообщений. Хотя клинические проявления заболевания еще не были ясны, именно эти работы способствовали дальнейшему целенаправленному выявлению подобных больных и накоплению фактических данных об этиопатогенезе, клинической картине, диагностике и попытках лечения больных с врожденной патологией дуги аорты. В 1958 г. G.Sevens выявил 4 больных и предложил новое название этого порока — «баклинг» аортальной дуги.
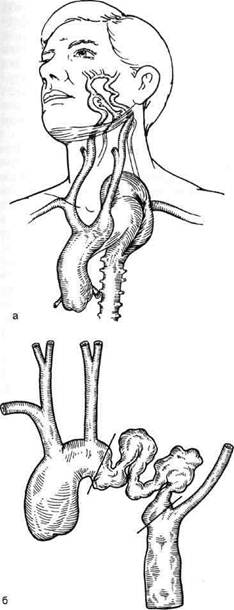
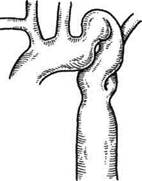
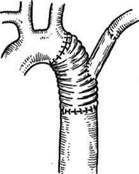
A.Braver и соавт. (1956, 1957) в Клинике Мейо выявили еще 11 случаев врожденной деформации дуги аорты. I.Steinberg и соавт. (1956, 1962, 1969) продолжили сбор и указали на особенности проявления врожденно удлиненной и изогнутой аорты, описав всего таким образом 18 собственных наблюдений. В конце 60-х — начале 70-х годов в литературе появляется множество работ с описанием единичных случаев с этим пороком. Всего к 1983 г. в мире опубликованы данные 198 наблюдений с этой аномалией дуги аорты, из них 39 больных проходили лечение в Институте сердечно-сосудистой хирургии им.А.Н.Бакулева АМН СССР [Покровский А.В., 1979; Спиридонов А. А., 1995]. Следует отметить, что в нашей стране данную патологию описали А.И.Клапцова (1956), В.С.Смоленский (1964), А.П.Колесов (1965), Рис. 5.35. Кинкинг и аневризма дуги аорты между левой общей сонной и левой подключичной артериями [Сао Р., 1980]. а — больной с кинкингом; б — уровни иссечения аневризмы; в — результат операции.
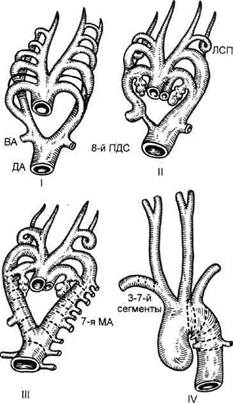
Ф.Л.Великих (1975), Н.Н.Земсков (1979), Я.В.Волоколаков и С.Н.Тхор (1979) и др. Терминология, эмбриология, частота. В 1973 г. А.В.Покровский предложил для обозначения изучаемой патологии термин «врожденная извитость дуги аорты». Вопрос терминологии в данном случае не является праздным. По мнению А.А.Спиридонова, все вышеперечисленные термины по своей сути являются названиями одного и того же порока развития аорты. Каждая из форм отличается от другой анатомическими особенностями, локализацией процесса и т.д. Объединив все указанные формы под термином «врожденные деформации дуги аорты», автор предлагает выделять следующие виды деформации дуги аорты: удлинение (elongation), извитость (tortuosty), кольцеобразование (coiling), петлеобразование (looping) и перегиб дуги аорты (kinking, buckling). При этом только при кинкинге (бак-линге) аорты, т.е. ее перегибе, наступают стойкие нарушения гемодинамики. Деформация дуги аорты эмбриологически представляет собой аномалию дуги и начального отдела нисходящей грудной аорты. Необходимо подчеркнуть, что все виды деформации, за исключением кин-кинга (баклинга), или перегиба, ге-модинамически физиологичны. Турбулентный характер кровотока в совокупности с врожденными и приобретенными нарушениями в сосудистой стенке часто приводит к формированию аневризм. Кроме того, выраженное удлинение аорты, не вызывая нарушений гемодинамики, может способствовать компрессии близлежащих органов — трахеи, пищевода, нервов. По данным литературы, частота данного порока составляет 0,4— 0,6 % всех сердечно-сосудистых заболеваний. В связи с тем что большинство авторов, описав эту пато- логию, наблюдали ее в единичных случаях (от 1 до 3 больных) и не смогли сделать вывод о частоте порока, ее клиническом течении и прогнозе, А.В.Покровский, А.А.Спиридонов и соавт. (1973, 1974, 1979), основываясь на 18 собственных наблюдениях, упорядочили терминологию, разработали классификацию и тактику хирургического лечения врожденной извитости дуги аорты. К 2000 г. отделение хирургии магистральных сосудов НЦССХ им.А.Н.Бакулева РАМН обладало самым большим клиническим материалом по хирургическому лечению аневризм дис-тального отдела дуги и перешейка аорты при врожденной деформации дуги аорты (55 больных). Проанализировав данные литературы по частоте аневризм аорты при врожденной ее деформации, мы зафиксировали единичные наблюдения хирургического лечения данной патологии. L.K.Smith, H.Gohra, J.L.Grigsby, E.Kusaba, Y.Sasaki, S.Suehiro рассматривали лишь особенности клиники и диагностики врожденной деформации дуги аорты, осложненной формированием аневризм. Анализ приведенных выше материалов позволил выявить частоту формирования аневризм при врожденной деформации дуги аорты у 20 % пациентов и считать данный порок предрасполагающим фактором для формирования аневризм дистального отдела дуги и перешейка аорты. Этиопатогенез данного порока не совсем ясен. Одни авторы считают, что данный порок имеет много общего с истинной коарктацией аорты; другие, основываясь на результатах патологических и гистологических исследований, показали, что псевдокоарктация обусловлена натяжением облитерированного артериального протока. Однако согласно экспериментальным исследованиям, хирургическое высвобожде- ние облитерированного артериального протока не повлияло на деформацию. A.Barry считал причиной данного врожденного порока аорты следующие этапы эмбриогенеза: развитие аорты с 5-й по 7-ю неделю эмбриональной жизни; постепенное кауда-льное смещение сердца с уровня шеи (где оно закладывается) к месту его обычного расположения в грудной полости — после 40-го дня внутриутробной жизни. Во время этой миграции сердца сонные артерии обычно удлиняются вместе с невральной трубкой и глоткой. Если этого не происходит, то компенсаторно удлиняется левая IV дуга, из которой образуется левосторонняя дуга аорты. Однако эта гипотеза, которой придерживаются отдельные исследователи, не полностью объясняет различные варианты удлинения грудной аорты в отношении как форм аномалии, так и локализации основного патологически длинного участка дуги и грудной аорты. С нашей точки зрения, эмбриогенез удлиненных и изогнутых сегментов дуги и нисходящей грудной аорты требует некоторых уточнений (рис. 5.36). В норме вентральная аорта плода превращается в восходящую аорту, правая IV жаберная дуга — в брахи-оцефальный ствол, а левая IV жаберная дуга вместе с 1—7 сегментами левой дорсальной аорты резко укорачивается, вследствие чего дис-тальный отдел дуги аорты (тотчас после отхождения левой общей сонной артерии) становится обычной длины, а левая подключичная артерия (происходящая из седьмой межсегментарной артерии) приближается к устью левой общей сонной артерии. Если же по каким-либо причинам укорочения IV жаберной дуги и 1—7 сегментов дорсальной аорты не происходит, то возникает удлиненная извитая дуга аорты. Определенную роль в развитии перегиба дистального отдела удли-
Рис. 5.36. Этапы (I—IV) эмбриогенеза дуги и нисходящей грудной аорты. ВА — вентральная аорта; ЛСП — левый сонный проток; ДА — дорсальная аорта; ПДС — правый дорсальный сегмент; МА — межсегментарная артерия. ненной аорты играет несвоевременная редукция левого каротидного протока, который не позволяет сегменту левой IV жаберной дуги следовать за сердцем при его каудаль-ной миграции в грудную полость. При этом развивается так называемая псевдокоарктация, или кин-кинг, дуги аорты. Не исключено, что на морфологические изменения дистального отдела дуги аорты влияет и обычно рано редуцирующаяся левая V жаберная дуга. При описанных выше нарушениях эмбриогенеза аорты удлинение и перегиб ее дуги обыч- но торакальной локализации. При шейной локализации удлиненной дуги аорты, выходящей в надключичную область, возможен другой вариант образования аномалии — развитие дуги аорты не из IV, а из III левой жаберной дуги. Удлинение дуги аорты проксима-льнее устья левой общей сонной артерии происходит за счет замедленного процесса укорочения левой вентральной аорты в сегменте между IV и V жаберными дугами. Перегибы в данном сегменте обусловлены несвоевременной редукцией V левой жаберной дуги. Классификация, анатомия. Следует различать следующие типы деформации дуги аорты. I. По топографоанатомическому типу. • правосторонняя; • левосторонняя. II. По виду деформации: • удлинение; • извитость; • петле- и кольцеобразование; • перегиб. III. По локализации измененного сег • между брахиоцефальным стволом и левой общей сонной артерией; • между левой общей сонной и левой подключичной артериями, с захватом устья последней в процесс; • в начальном сегменте нисходящей грудной аорты. IV. По расположению: • шейное; • внутригрудное. V. По комбинации данной аномалии • тетрада Фалло, ДМЖП, подкла- VI. По клиническому течению: • асимптомное течение;
• коарктационный синдром; • синдром, характерный для аневризм грудной аорты; • компрессионный синдром. Существует два мнения относительно состояния самой стенки дуги аорты при данной аномалии. Одни авторы придерживаются мнения об абсолютной интактности стенки аорты в данном сегменте и вторичном происхождении аневризм. Другие считают, что, помимо простого удлинения сегмента аорты, изначально имеются врожденная слабость эластики аорты и даже кистозный медионекроз. Однозначного ответа на этот вопрос нет. Возможны оба варианта исходного состояния стенки аорты. При врожденном поражении стенки аорты либо диспластическим процессом, либо кистозным медионекрозом вторичные аневризматические изменения аорты возникают в детском возрасте. При интактности стенки аорты их вторичная дегенерация происходит значительно позднее, под влиянием турбулентного потока крови и нередко вследствие артериальной сопутствующей гипертензии. Макроскопически при перегибе аорты и развитии аневризматиче-ских расширений в просвете аорты видны участки изгиба, шпор, аневризматические углубления, дочерние аневризмы. Стенки аорты в участках аневризм резко истончены, иногда до 1 мм. Интима аорты в этих местах белесоватого цвета, бугристая, «балчатого» строения. Под эндотелием обнаруживают очаговое отложение липидов в виде мелких выбу-хающих желтоватых пятен. У взрослых больных в ряде случаев наблюдают отдельные атеросклеротиче-ские бляшки, которые могут быть петрифицированными. В области шейки аневризм может определяться невысокий «гребень», представленный плотной белесоватой тканью. При диспластическом процессе в стенке аорты четко прослеживается постепенный переход неизмененной стенки аорты в аневризматиче-ское расширение. В области аневризмы истончение медии вследствие уменьшения количества гладких мышечных волокон, которые имеют неправильную ориентацию и расположение. В мышечной оболочке разрастание соединительной ткани. Склероз мышечного слоя может достигать полного замещения мышечной ткани пучками кол-лагеновых волокон. Одновременно фиксируют распад эластических волокон. Гребень (шпора) представляет собой утолщенную и гипер-плазированную медию с эластозом и субинтимальным фиброзом. В ад-вентиции разрастание соединительной ткани в виде периваскулярного склероза, изредка с округлоклеточ-ными фокусами. Морфологическая картина в области перегибов особенно интересна. При этом во всех слоях стенки аорты отмечают деструктивные изменения, особенно сильные в эластическом каркасе, во внутренней эластической мембране, которая резко утолщена, выпрямлена, нередко с резкими изгибами и разрывами. Образуются глубокие складки, ограниченные толстыми фрагментами эластической мембраны. В глубине складок выявляют пролиферацию интимы, которая как бы скрепляет складку, приводя к деформации стенки аорты. Мышечный слой склерозирован, что снижает эластичность стенки. Ад-вентиция резко утолщена, представлена толстыми коллагеновы-ми волокнами. В результате этого стенка аорты образует угол с вершиной, направленной в просвет, что способствует стенозу аорты. Противоположная стенка аорты атрофична, истончена. Подобная картина свидетельствует о дегенеративных изменениях в стенке аорты, возникших вследствие дли- тельно существующей артериальной гипертензии. Пролиферации интимального слоя и признаков воспаления не зафиксировано, что подтверждает отсутствие каких-либо морфологических признаков неспецифического аортита. Гемодинамика. Удлинение дуги аорты в ее дистальных отделах само по себе не приводит к каким-либо патофизиологическим проявлениям, но, поскольку фиксация нисходящей аорты в начальном ее сегменте хорошо выражена, с возрастом в норме происходит смещение дуги в каудальном направлении, развивается перегиб дистального сегмента дуги аорты. При перегибе дуги в аорте возникает турбулентный ток крови, так как ток крови, идущий по дуге малого радиуса, пересекает ток крови, идущий по дуге большого радиуса. Скорость движения крови по дуге большого радиуса возрастает, переходя границы критического числа Рейнольдса. Имеющиеся врожденные дефекты стенки аорты (истончение, изменения эластики медии и интимы), а также вторичные изменения на фоне турбулентного потока крови приводят к развитию аневризм, дегенеративным изменениям стенки аорты, атеросклерозу. Интима образует складки-шпоры, вызывая деформацию стенки аорты. Такой органический перегиб аорты способствует развитию коарктационного синдрома, имеющего 2 режима давления. Сужение просвета аорты может достигать 50 %. Это не приводит к ишемии дистальнее расположенных органов, развитию выраженного коллатерального компенсаторного кровообращения. Региональная престенотическая артериальная гипертензия не носит тяжелого характера. Развитие аневризм в области дуги и начального сегмента нисходящей аорты, особенно при право-лежащей и позадипищеводно рас- положенной аорте, обусловливает сдавление пищевода и трахеи. Таким образом, сама по себе деформация дуги аорты чаще всего протекает без выраженных патофизиологических нарушений и не сопровождается какими-либо клиническими симптомами. Осложненное течение порока — формирование перегиба — приводит к появлению клинической симптоматики и патофизиологических изменений, характерных для умеренного коаркта-ционного синдрома, а развитие аневризм дуги аорты — к потере аортой роли компрессионной камеры и появлению симптомов, характерных для сдавления близлежащих органов средостения. Клиническая картина. Аномалии дуги аорты и ее ветвей могут сопровождаться тремя основными клиническими синдромами: трахеоэзо-фагеальной компрессией, ишемией головного мозга и коарктационным синдромом. В своих клинических проявлениях указанные аномалии проходят ряд стадий: компенсации, субкомпенсации и декомпенсации. Для стадии компенсации характерны абсолютно асимптомный характер или форма стертых клинических проявлений; для стадии субкомпенсации — преходящая клиническая симптоматика; для стадии декомпенсации — ряд необратимых органических изменений: стриктуры трахеи и пищевода, развитие трахеоэзофагеальных свищей, ателектаз легкого, ишемический инсульт, аневризмы грудной аорты. У детей клинические проявления нередко возникают сразу после рождения и немедленно вступают в стадию суб- или декомпенсации. У взрослых больных они развиваются обычно постепенно, проходя все стадии заболевания, но могут в ряде случаев протекать абсолютно асимптомно и быть случайной находкой после смерти от совершенно других причин при внимательно и квалифицированно проведенной аутопсии. Неосложненные перегибом удлинение, извитость, петлеобразование дуги аорты интраторакальной локализации обычно протекают асимптомно и являются случайной находкой при рентгенологическом исследовании, которое дает возможность выявить дополнительную округлую тень в плевральном куполе. Тень обычно принимают за опухоль средостения, легкого, коарктацию аорты или аневризму грудной аорты. При этом виде деформации дуги ге-модинамических нарушений не отмечается. При гемодинамическом неослож-ненном течении аномалии и шейной ее локализации в зависимости от расположения дуги (право- или левосторонняя) возможны жалобы на наличие пульсирующего опухолевидного образования на шее справа или слева. В подобных случаях диагностика имеет целенаправленный характер. В ряде случаев клиническая картина аномалии может быть обусловлена сочетанными врожденными пороками сердца и тогда врожденная асимптомная деформация дуги аорты является дополнительной находкой при обследовании основного порока. При шейной локализации аномалии и в сочетании с врожденным пороком сердца деформации дуги аорты (ге-модинамически незначимые) могут выявляться в детском возрасте. Хотя большинство аномалий дуги аорты подробно описаны в специальной литературе, к сожалению, они не известны широкому кругу практикующих врачей, что весьма часто служит причиной диагностических ошибок. Об этом свидетельствует тот факт, что только у 20 % всех наблюдавшихся нами больных был поставлен диагноз «аномалия грудной аорты». В остальных случаях диагноз в направлении был следующим: опухоль средостения (20 %), коарктация аорты (22,5 %), опухоль легкого (10 %), различные пороки сердца (15 %), зоб (2,5 %). Ошибочно оперированы с указанными диагнозами 35 % больных. При развитии перегиба дуги аорты с синдромом коарктации клиническая картина становится типичной для развития регионарной ги-пертензии верхней половины тела: гипертоническая энцефалопатия (головная боль, головокружение, тошнота, рвота), перегрузка левых отделов сердца (боль в области сердца, сердцебиение, одышка, перебои сердца, чувство «жара за грудиной»); возможны жалобы общего характера: общая слабость, пониженная работоспособность, быстрая утомляемость как физическая, так и умственная. Характерных для коарктации жалоб, связанных с ги-потензией нижнего отдела тела и нижних конечностей, обычно не бывает. Для шейной локализации порока и развития аневризм дистального отдела дуги и нисходящей аорты характерны жалобы, связанные с компрессией близлежащих органов: осиплость голоса (сдавление возвратного нерва), кашель, одышка (сдавление трахеи и корня левого легкого), ноющая боль за грудиной и в межлопаточной области, в левой руке, синдром Горнера (компрессия шейного симпатического узла), застойные явления в левом легком и частые пневмонии слева (сдавление корня левого легкого), межреберные (радикулярные) боли, дисфагия (компрессия пищевода), хилоторакс (сдавление грудного лимфатического протока). При осмотре больных возможна усиленная пульсация в надключичных ямках или в проекции общих сонных артерий. В надключичной области или в межлопаточной области выслушивается систолический шум различной интенсивности. Эпицентр может быть и в области второго межреберья слева. Нередко в левой надключичной области при
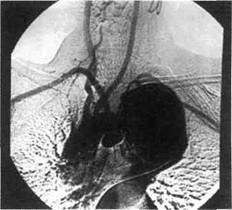
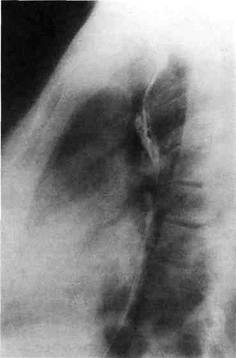
Рис. 5.37. Аортограмма больного с кинкингом и аневризмой дуги аорты. пальпации можно определить характерное систолическое дрожание. Обязательно измерение АД на всех четырех конечностях. При этом для деформации дуги аорты с коаркта-ционным синдромом характерны повышенное АД на правой руке, сниженное АД на левой руке и на нижних конечностях. Градиент АД обычно составляет 20—30 мм рт.ст. между руками и 40—50 мм рт.ст. между правой рукой и ногами. При рентгенологическом исследовании выявляют ряд типичных признаков, присущих врожденной извитости дуги аорты (рис. 5.37). Со стороны малого круга кровообращения изменений нет. Узурация ребер отсутствует. Сердце не увеличено в поперечнике, талия его сохранена, верхушка закруглена. Возможно небольшое увеличение левого желудочка, которое обнаруживают в левой передней косой проекции. Это можно объяснить увеличением сопротивления кровотоку по удлиненной и извитой аорте, которое приводит к повышению нагрузки на левый желудочек и гипертрофии его стенки. Остальные полости сердца не увеличены. В прямой проекции при высоком расположении правосторонней
Рис. 5.38. Эзофагограмма больного с кинкингом дуги аорты. На контрастированием пищеводе видны два вдавле-ния на одном уровне. дуги аорты, которая перекидывается через правый главный бронх, регистрируют следующую симптоматику: • сосудистый пучок расширен вправо и вверх, нередко надключич-но определяется добавочная тень; • «аортальный клюв» на своем обычном месте отсутствует; • контрастированный пищевод на уровне дуги аорты оттеснен влево. При левосторонней дуге аорты в переднезадней проекции расширение тени верхнего средостения за счет высокого стояния дуги аорты, которая часто бывает расширенной. Измененная аорта выбухает влево и вверх и располагается нередко выше ключицы в левом плевральном куполе. В некоторых случаях возможен только выраженный «аортальный клюв». Иногда удается выявить обызвествление аневриз-матически измененного участка аорты. Большое значение в диагностике Для установления окончательного диагноза всем больным показано ангиографическое исследование по методике Сельдингера с введением катетера через бедренную артерию или при резком изгибе дуги — через правую подмышечную артерию. Обязательны измерения давления в аорте проксимальнее и дистальнее измененного участка. Аортографию следует проводить в двух проекциях для лучшей визуализации разнообразных изгибов и перегибов, а также для выявления поражения подключичной и левой общей сонной артерий. Основными ангиографическими признаками деформации аорты служат: ▲ удлинение и смещение влево и вверх дуги аорты с образованием перегиба в этой области или после отхождения левой подключичной артерии (рис. 5.39);
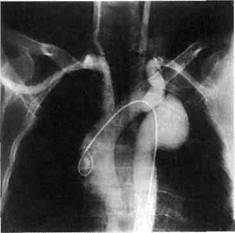
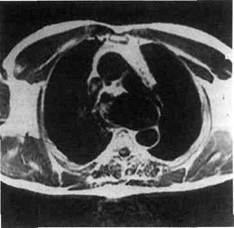
Рис. 5.39. Ангиограмма больной с кин-кингом и аневризмой дуги аорты, от-хождением левой подключичной артерии от верхнего полюса аневризмы и артерией Luzoria от нижнего полюса аневризмы. Рис. 5.40. Поперечный срез на компьютерной томограмме аневризмы диста-льного отдела дуги аорты, демонстрирующий дугу аорты и нисходящую грудную аорту, а также деформацию и аневризму аорты в области дистального отдела дуги аорты.
▲наличие приблизительно у 50 % больных аневризм аорты, расположенной обычно дистальнее перегиба (чаще аневризмы бывают веретенообразной формы и больших размеров — до 14 см в диаметре); ▲удлинение, извитость, сужение ветвей дуги аорты с формированием аневризматических расширений в их начале; ▲отсутствие характерных для ко-арктации аорты развитых коллате-ралей, несмотря на наличие коарк-тационного синдрома; ▲гемодинамический перегиб дуги аорты, для которого характерно наличие градиента АД в месте перегиба от 15 до 60 мм рт.ст. Появились новые неинвазивные и малоинвазивные исследования (чреспищеводная ЭхоКГ, компьютерная томоангиография, магнитно-резонансная томография), чувствительность и специфичность которых в диагностике аневризм грудной аорты приближаются к 100 % (рис. 5.40). При исследовании методом чрес-пищеводной ЭхоКГ у всех больных с врожденной деформацией дуги аорты (18 больных) нами были получены ложноположительные результаты — участок патологической извитости, лоцированный по короткой оси, на эхограммах имитировал картину аневризматически расширенной аорты с участком значительного пристеночного тромбоза. Такая картина была получена в результате того, что в зону сканирования попадали извитые и лежащие в различных геометрических плоскостях деформированные сегменты аорты. Именно места деформаций и извитости при локализации по короткой оси биплановым чреспищеводным датчиком создавали картину тром-бированной аневризмы аорты. В связи с этим диагностическая ценность метода чреспищеводной ЭхоКГ в выявлении «врожденных» аневризм дуги и перешейка аорты не превосходит показатели традиционной трансторакальной методики. В диагностике врожденной извитости дуги спиральная компьютерная и магнитно-резонансная томография по сравнению с обычной компьютерной томографией наиболее значимы. Следует указать на следующие основные достоинства спиральной компьютерной томографии, а именно: • объемную визуализацию всей исследуемой анатомической области (дуги и перешейка аорты); • взаимоотношение пораженной аорты с окружающими органами и образованиями; • более четкую визуализацию сосудов и возможность выполнять трехмерные реконструкции; • возможность ретроспективной реконструкции срезов с варьирующим шагом (интервалом) после окончания исследования; • улучшение качества многоплоскостных реконструкций; • неинвазивность (бесконтрастные методики) и малую инвазив-ность (методики с трансвенозным введением контрастного вещества); • уменьшение лучевой нагрузки; • уменьшение времени обследования пациента. Спиральная компьютерная томо-ангиография позволяет уверенно оценивать размер аневризмы нисходящего отдела грудной аорты, состояние ее стенок (обызвествление, утолщение) и выявлять тромбоз полости аневризмы, определить его топографию относительно устьев брахиоцефальных артерий. Основными диагностическими критериями врожденной извитости являются визуализация извитого участка аорты, определение диаметра и состояния стенок всех отделов грудной аорты. Малоинформативны аксиальные срезы, которые определяют лишь диаметр аорты в неизмененных участках. Наибольшую диагностическую информацию о ходе патологически извитой аорты дает анализ мультипланарных реконструкций и режимы MIP (проекция максимальной интенсивности) и SSD (реконструкция с затененной наружной поверхностью) построений. Спиральная компьютерная томография изображения извитого сегмента аорты, полученная с помощью перечисленных программ обработки, помогает точно указать форму и тип деформации. Недостатками указанных методик является невозможность прямого измерения показателей центральной гемодинамики (АД, патологический градиент давления), а также выполнения катетерных пластических вмешательств по показаниям (транслюминальной баллонной ангиопластики). Показания к операции, оперативное лечение. При неосложненных формах деформации дуги аорты с нормальной гемодинамикой и ма-лосимптомным течением операция не показана, однако больные должны постоянно находиться под строгим диспансерным наблюдением с периодическим рентгенологическим контролем и поддерживающей симптоматической консервативной терапией (обычно гипотензивной). Такая тактика позволяет своевременно выявлять развивающиеся различные характерные для данной аномалии дуги аорты осложнения и выработать показания для своевременного хирургического вмешательства. К ним относятся: • компрессионный синдром; • коарктационный синдром с градиентом АД более 20 мм рт.ст.; • аневризматическое расширение дуги и нисходящей аорты; • аневризмы, кинкинги (при соответствующей клинике) ветвей дуги аорты; • сочетание с другими врожденными пороками сердца, которые оперируют первым этапом. В СССР первую операцию в 1960 г. провел в ИССХ академик В.И.Бураковский. Приводим краткое описание данного клинического наблюдения. Девочка X., 7 лет, поступила в институт с жалобами на пульсирующее опухолевидное образование на шее справа, одышку при физической нагрузке, осиплость голоса. За год до поступления ей по месту жительства проведена эксплоративная операция по поводу аневризмы правой сонной артерии. На операции обнаружена аномально расположенная на шее дуга аорты. При осмотре в области шеи справа установлено пульсирующее опухолевидное эластическое образование, над которым определяется систолический шум. При аортографии выявлена аномально удлиненная дуга аорты с выходом на шею на 6 см выше ключицы с поворотом вниз в виде петли. Операцию проводили в условиях гипотермии. Диаметр восходящего и нисходящего колен дуги равен 13—14 мм. Выполнена резекция шейного отдела дуги аорты с анастомозом конец в конец. Мы подробно останавливаемся на данном случае потому, что в литературе описана ошибочная в подобном случае операция, приведшая к летальному исходу. T.Beavan (1947) оперировал больного по поводу предполагаемой аневризмы правой общей сонной артерии. На операции лигирована «аневризма». Через 15 мин больной умер от острой левожелудочковой недостаточности. На вскрытии выявлена врожденная извитость правосторонней дуги аорты с выходом ее на шею. На операции была перевязана дуга аорты. При аневризмах аорты и ее перегибах операцию выполняют либо в условиях общей гипотермии, либо с использованием ИК по схеме шунтирования «левое предсердие — бедренная артерия» с целью профилактики спинальной и почечной недостаточности, так как коллатеральное кровообращение при данной аномалии развито недостаточно, а продолжительность пережатия дуги аорты заранее определить невозможно. Особое значение чреспищевод-ная ЭхоКГ имеет во время реконструктивной операции, выполняя функцию динамического контроля и раннего выявления дисфункции миокарда, что позволяет незамедлительно начать соответствующую медикаментозную коррекцию. Оперативный доступ при деформациях дуги зависит от ее расположения (право- или леволежащая). Чаще проводят широкую боковую торакотомию по четвертому межре-берью. Следует отметить, что большую опасность представляют выделение и мобилизация патологически измененной стенки дуги аорты и ее ветвей. Для облегчения этого этапа операции следует выполнить 2 продольных разреза медиастина-льной плевры кпереди и кзади от диафрагмального и блуждающего нервов. Условием адекватности операции является иссечение патологически измененного участка в пределах видимых нормальных участков аорты. Редко возможен прямой анастомоз между концами аорты. В зрелом возрасте более показана резекция аорты с протезированием (рис. 5.41). При шейном расположении извитой дуги аорты более целесообразным доступом служит срединная стернотомия с продолжением разреза на шею вправо или влево в зависимости от расположения дуги аорты. В этом случае с учетом вероятной коррекции ветвей дуги аорты операцию выполняют в условиях ИК. Целесообразно внутримешко-вое протезирование аорты для предохранения от пересечения и трав-матизации блуждающего и возвратного нервов. Приводим собственное наблюдение. Мальчик М., 7 лет, поступил в отделение хирургии сосудов с жалобами на головную боль, боль в области сердца при физической нагрузке, постоян-
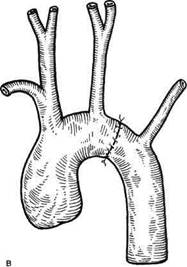
Рис. 5.41. Патологические изменения (а) и операция (б) при кинкинге дуги аорты между левой общей сонной и левой подключичной артериями с захватом устья последней. ный субфебрилитет, частые бронхиты. С 2 лет его наблюдают педиатры, выявившие у мальчика систолический шум в области сердца, отсутствие пульса на левой руке и ногах. С диагнозом «коар-ктация аорты» обследован ангиографи-чески, в результате чего обнаружена патологическая извитость дуги аорты. При обследовании в отделении: границы сердца умеренно увеличены влево, определяется систолический шум во втором межреберье слева, с максимумом в межлопаточной области на уровне тела ТпЗ-4. АД на правой руке 145/90 мм рт.ст., слева на руке и на ногах не определяется. По данным рентгенологического исследования дуга аорты леволежащая, расположена выше обычного на уровне ключицы. По левому краю сосудистого пучка многокон-турность, которая обусловлена извитой аортой и аневризматическим ее расширением. Ангиографически выявлены извитость и перегиб дуги аорты в сегменте между левой общей сонной и левой подключичной артериями. Ход данного сегмента аорты причудлив, отмечают множественные аневризматиче-ские участки дуги аорты, позднее контрастирование левой подключичной артерии. Диагноз: врожденная деформация дуги аорты с развитием коарктаци-онного синдрома и аневризм. Больному 5.06.1984 г. в условиях умеренной гипотермии (31,4 °С) проведена левосторонняя торакото-мия по четвертому межреберью (проф. А.А.Спиридонов). После рассечения париетальной плевры выделена дуга аорты диаметром 14 мм, левая общая сонная артерия — 7 мм, левая подключичная артерия диаметром 6 мм, нисходящая грудная аорта — 14 мм. Между левой общей сонной и левой подключичной артериями располагался участок извитой удлиненной дуги аорты размером 5 х 4 х 3,5 см с наличием двух участков перегиба, 2 больших и 5 дочерних аневризм. Ретроградное АД в левой общей сонной артерии составило при ее пережатии 80 мм рт.ст. при системном АД, равном 125 мм рт.ст. Дуга аорты пережата проксимальнее левой общей сонной и дистальнее левой подключичной артерий, резецирован пораженный участок и наложен косой анастомоз между резецированными участками аорты по типу конец в конец непрерывным «матрацным швом». Послеоперационный период гладкий. Через год после операции больной обследован в ИССХ им.А.Н.Бакулева. Градиента АД между руками и ногами, по данным УЗДГ, у больного нет. Жалоб не предъявляет. Результаты хирургического лечения больных с врожденной извитостью дуги аорты следует считать устойчиво хорошими. По данным А.В.Покровского (1979), госпитальная летальность составляет 15 %. По данным А.А.Спиридонова и соавт. (1999), госпитальная летальность хирургического лечения 54 пациентов составила 7,4 %; отдаленные результаты свидетельствуют о стабильности коррекции порока на протяжении 18 лет. Однако зафиксированы случаи рекоарктации и повторного развития аневризмы аорты, что говорит о необходимости радикального подхода при резекции измененного сегмента аорты. Прогноз врожденной извитости дуги аорты зависит от сроков выявления патологии, степени прогрес-сирования заболевания, установления правильных показаний к оперативному лечению, а также от техники оперативного вмешательства. Литература Иваницкий А.В., Спиридонов А.А., Хамзаба-ев Ж.Х. и др. Аномалии дуги аорты и ее ветвей (клиника, диагностика, хирургическое лечение). — Алматы: Гылым, 1995. Кривченя Д.Ю. Хирургическое лечение компрессионных стенозов дыхательных путей и пищевода при аномалиях развития дуги аорты у детей//Грудная хир. — 1985. - № 6. - С. 31-35. Покровский А. В. Заболевания аорты и ее ветвей. — М.: Медицина, 1979. — 326 с. Покровский А.В. Клиническая ангиология. — М.: Медицина, 1979. — 368 с. Покровский А.В., Зингерман Л.С, Стани-шевский Ю.А. и др. Врожденная извитость дуги аорты//Грудная хир. — 1974. — № 5. - С. 25-30. Сердечно-сосудистая хирургия//Под ред В.И.Бураковского, Л.А.Бокерия. — М.: Медицина, 1996. — С. 311-316. Спиридонов А.А., Тутов Е.Г., Аракелян B.C. Аневризмы грудной аорты при коаркта-ционном синдроме//Ангиол. и сосуд, хир. - 1999. - № 1. - С. 96-107. Barry A. The aortic arch derivatives in the Human Adult//Anat. Rec. — 1951. — Vol.111. - P.221. Heaven T.E.D., Fatti L. Ligature of aortic arch in the neck//Brit. J. Surg. — 1947. — Vol.34, N 136. - P.414-416. Binet J.P., Langlois J. Aortic arch anomalies in children and infants//J. Thorac. Cardio-vasc. Surg. - 1977. - Vol.73. -P.248-252. Bogren H.G., Porter B.A. Three aortic arch anomalies: A review of the literature and proposal of a new classification//.!. Cardio- vasc. Intervent. Radiol.— 1980.— Vol.30.— P.19-23. Bruwer A.J. Kinking of aortic arch simulating mediastinal tumor//Brit. J. Radiol.— 1957.— Vol.30, N 355. - P.387-390. Cao P., Angelini P., Coloma L. et al. Cervical aortic arch with mediocystic necrosis//Car-diovasc. Dis. — 1980. - Vol.7. — P.188-193. Congdon E.D. Transformation of the aortic arch system during the development of the human embryo//Contrib. Embryol Carnegie Inst, of Washington. - 1922. - Vol.14. -P.47-100. Cooky D.A., Mullins C.E., Gooch J.B. Aneurysm of right-sides cervical arch; surgical removal and graft replacement//.!. Thorac. Cardiovasc. Surg. — 1976. — Vol.72. -P.106-108. Di Guglielmo L, Guttadauro M. Kinking of aorta: Report of two cases//Acta radiol. — 1955. -Vol.44. - P.121-128. Dotter СТ., Steinberg J. Angiocardiography/ Ed. P.B. Hoeber, Inc. New York, 1951. -P.181-184. Edwards J.E. An atlas of acquired diseases of the heart and great vessels. — Philadelphia, London: Saunders Co, 1961. — Vol.1. — 484 p. Edwards J.E. Anomalies of the derivatives of the aortic arch system//Med. Clin. North Amer. - 1948. - Vol.32. - P.925-949. Edwards J.R., Lev M. The Heart. — Baltimore: Williams Wilkina, 1974. - 450 p. Eklof O., Ekstrom G, Eriksson B.O. et al. Arterial anomalies causing compression of the trachea and/or the oesophagus//Acta Pedi-atr. Scand. - 1971. - Vol.60. - P.81-89. Fersac В., Yilmas M., Kaplan S., Вике Е. Case report: Cervical aortic arch with aneurysm formation//Eur. J. cardio-thorac. Surg. - 1998. - Vol.14. - P.437-439. Gohra H. Surgical treatment for ruptured aneurysm of distal arch or aortic arch: Report of three cases//Kyobu Geka. — 1996. — Vol.49, N 3. - P.206-208. Grigsby J.L. Pseudocoarctation of the aorta complicated by saccular aneurysm: Treatment by aortic arch replacement//Amer. Heart J. - 1996. - Vol.131. - P.200-202. Gross R.E. Neuhauser E. Compression of the trachea or esophagus by vascular anomalies: Surgical therapy in 40 cases//Pediatrics. — 1961. -Vol.7. - P.69-83. Holland P., Fitzpatric J.D. Case report; magnetic resonance imaging of a right sided cervical aortic arch with a congenital aneu-rysm//Clin. Radiol. - 1991. - Vol. 43. -P. 352-355. Hsu I., Kistin A.D. Buckling of the great vessels//Arch. Intern. Med.— 1956.— Vol.98.— P. 712. Kumar S., Mandalam K.R., Unni M. et al. Left cervical arch and associated abnormali-ties//Cardiovasc. Intervet. Radiol.— 1989.— Vol.12. -P.88-91. Kusaba E. Aortic aneurysm complicated with coarc-tation of the aorta and Turner syndro-me//Kyobu Geka.- 1995.- Vol.48, N 13.-P. 1115-1117. Leonard H.R., Naggar C.Z., Etlis F.H. Disp-hagia due to aortic arch anomaly: diagnostic and therapeutic consideration//Arch. Surg.— 1980. - Vol.115. - P.1229—1232. Morris R., Ruttley M. Left cervical aortic arch associated with aortic aneurysm//Brit. Heart J. - 1978. - Vol.40. - P. 87-90. Pearson G.D., Kan J.S., Neill С A. et al. Cervical aortic arch with aneurysm formation// Amer. J. Cardiol. - 1997. - Vol.79. -P. 112-114. Pitzus E., Camoglio E. La sindrome della orta cervicale. A proposito di un caso clinico//G. Ital. Cardiol.- 1974.- Vol.4.- P. 217-218. Quatflebaum I.K., Upson E.T., Neville R.L. Stroke associated with elongation and kinking of the internal carotid artery//Ann. Surg. - 1959. - Vol.15. - P. 824. Robb G.P. Atlas of angiocardiography. — Washington, DC: American Registry of Pathology, 1951. - P. 84-87. Rosier H., White P.D. Anomalies of aortic arch//Amer. Heart J.- 1931.- Vol.6, N 4.-P. 768-777. Sasaki Y., Suehiro S., Shibata T. et al. Case of pseudocoarctation associated with aneurysm of the descending aorta//Nippon Kyo-bu Geka. - 1955. - Vol.43, N 6. -P.898-902. Schrechter D.C. Dolichocarotid syndrome. Cerebral ischemia related to cervical carotid artery redundancy with kinking. Parts I and II//N.Y. State J. Med. - 1979. - Vol.79. -P.1391, 1542. Smith L.K., Thornton D.D., Kamplain T.L. Pseudocoarctation of the aorta//Computed Body Tomography/Eds. Lee, Sagel & Stanley: Raven Press, 1989. - P.223. Souders C.R., Pearson СМ., Adams H.D. Aortic deformity simulation mediastinal tumor: Subclinical form of coarctation//Dis. Chest. - 1951. - Vol.20. - P.35-45. Steinberg I., Engle M.A., Holswade G.R., Hagstrom J.W.C. Pseudocoarctation of the aorta associated with congenital heart disease: Report of ten cases//Amer. J. Roentgenol., Radium Therapy and Nucl. Med. — 1969. - Vol.106, N 1. - P.l-20. Van Nooten G., Deuvaaert F., De Paepe J., Prime G Left-sided cervical aortic arch// Acta Chir. Belg. - 1986. - Vol.86. -P.248-250. Vannix R.S., Joergenson F., Carter R. Kinking of the internal carotid artery. Clinical significance and surgical management//N. Amer. J. Surg. - 1977. - Vol.82. - P.134. Yu Y., Li G, Zhu L. Congenital kinking of the aorta: Report of 5 cases//Chung Hua Wai Ко Tsa Chin.- 1995.- Vol.33, N l.~ P. 46-47. Beavan T.E.D., Fatti L. Ligature of aortic arch in the neck//Brit. J. Surg. — 1947. — Vol. 34. - P. 414-416. Дата добавления: 2015-02-06 | Просмотры: 2444 | Нарушение авторских прав |