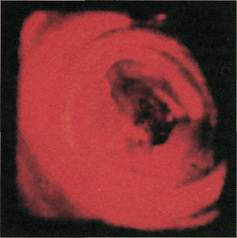
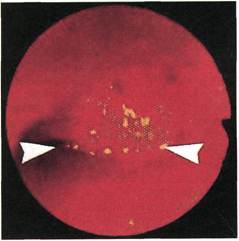
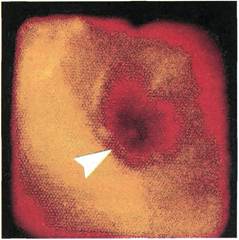
Интраоперационная ангиофиброскопия
Поступательное развитие ангиоло-
гии делает возможным оказание
эффективной хирургической помо-
щи больным, страдающим окклю-
зирующими заболеваниями аорты и
магистральных артерий. Реконст-
руктивные вмешательства, выпол-
няемые на сосудах различных ана-
томических регионов, позволяют у
80—90 % больных добиться поло-
жительных результатов, однако, по
данным литературы, у 7,7—18,7 %
больных в раннем послеоперацион-
ном периоде развиваются тромбо-
эмболические осложнения в зоне
реконструкции.
Благоприятный исход любой ре-
конструктивной операции на сосу-
дах в значительной степени опреде-
ляется тем, насколько технически
качественно выполнено оператив-
ное вмешательство [Гамбарин Б.Л.,
Аганов Т.И., 1982; Покров-
ский А.В., Ашуров Б.М., 1983; Ва-
хидов В.В., Гамбарин Б.Л., 1985;
Lee G. et al., 1986; Beck A. et al.,
1989]. Этот факт имеет огромное
клиническое значение в достовер-
ной оценке эффективности и каче-
ства каждого из этапов реконструк-
тивного вмешательства на сосудах.
Завершив реконструктивный этап
операции и восстановив кровоток в
зоне реконструкции, хирург оцени-
вает эффективность и качество
предпринятого вмешательства с по-
мощью электромагнитной флоумет-
рии, электроманометрии и цнтра-
операционной ангиографии.
Использование электромагнит-
ной флоуметрии и электроманомет-
рии позволяет исследовать сопро-
тивление по реконструированному
участку сосудистого русла. Наличие
погрешностей хирургической тех-
ники в виде сужения анастомозов,
неполной дезоблитерации окклюзи-
рованных артерий, оставления не-
разрушенных створок клапанов в
вене in situ сопровождается высоки-
ми значениями сопротивления в
зоне реконструкции. Полученные
данные служат показанием к вы-
полнению интраоперационной ан-
гиографии, позволяющей выявить
не только причину высокого сопро-
тивления, но и локализацию по-
грешностей хирургической техни-
ки, однако электромагнитная флоу-
метрия, электроманометрия и рент-
геноконтрастная ангиография явля-
ются интраоперационными метода-
ми контроля, осуществление кото-
рых возможно лишь после оконча-
ния реконструктивного этапа опе-
рации и восстановления кровотока
в зоне реконструкции, тогда как
информация о наличии погрешно-
стей хирургической техники имеет
принципиально важное значение до
восстановления кровотока. Выявле-
ние погрешностей хирургической
техники после восстановления кро-
вотока требует от хирурга принятия
дополнительных вмешательств, на-
правленных на их устранение, ко-
торые усложняют операцию и уве-
личивают ее продолжительность,
что нередко несет в себе опасность
развития новых осложнений в зоне
реконструкции.
Потребность ангиохирургов иметь
в своем распоряжении метод, позво-
ляющий визуально оценить состоя-
ние внутренней поверхности опери-
руемых сосудов и определить адек-
ватность и качество выполненных
реконструктивных вмешательств до
восстановления кровотока, привела
к созданию метода ангиофиброско-
пии.
L.Phea и I.C.Walker в 1913 г. со-
здали первый кардиоскоп с линзо-
вой системой, что позволило
успешно осуществить эндоскопию
полостей сердца в эксперименте на
собаках. В последующие годы раз-
витие метода эндоскопического ис-
следования полостей сердца и ма-
гистральных сосудов было нераз-
рывно связано с этапами совершен-
ствования эндоскопической тех-
ники.
Первый этап развития кардио- и
ангиоскопии связан с использова-
нием жестких конструкций эндо-
скопов с линзовой системой.
D.S.Allen и E.A.Graham в 1922 г. со-
здали эндоскоп, в основе которо-
го была использована конструк-
ция кардиоскопа, предложенного
L.Phea и I.C.Walker в 1913 г. Усо-
вершенствованная модель эндоско-
па представляла собой полую ме-
таллическую трубку из нержавею-
щей стали, окуляр и объектив кото-
рой снабжены набором линз. Ис-
точником света служила лампочка,
вмонтированная над плоской лин-
зой окуляра. Поверхность линзы
объектива, обращенная к исследуе-
мому объекту, имела выпуклую
форму. Плотное прижатие ее к
осматриваемым структурам обес-
печивало оттеснение крови, что
позволяло получать удовлетво-
рительную эндоскопическую кар-
тину.
Предложенную модель эндоскопа
авторы снабдили режущим инстру-
ментом, с помощью которого сна-
чала в эксперименте на собаках, а
затем и у 5 пациентов успешно вы-
полнили митральную комиссурото-
мию.
Второй этап характеризуется со-
зданием эндоскопов с корпусом из
пластических масс (полиметилме-
такрилата, люцида), обладающих
хорошими светопроводящими свой-
ствами. Источник света помещал-
ся в стороне от корпуса под углом
90° в том же материале [Butter-
worth R.F., 1951; Bolton H.E. et al.,
1954].
Третьим этапом в совершенство-
вании ангио- и кардиоскопов яви-
лось создание эндоскопов жесткой
конструкции, снабженных канала-
ми, через которые под давлением
вводили стерильный изотониче-
ский раствор натрия хлорида в це-
лях оттеснения крови от осматрива-
емого объекта [Bloomberg A.E.,
Hurwitt E.S., 1957; Iikawa Т. et al.,
1957; Sakakibara S. et al., 1958].
Четвертый этап характеризуется
созданием жестких ангио- и карди-
оскопов, снабженных на конце бал-
лончиками из прозрачных материа-
лов, таких как резина, пластик,
стекло. Прижатие к исследуемому
объекту прозрачной насадки эндо-
скопа обеспечивало оттеснение
крови, что делало видимым осмат-
риваемые структуры [Марущен-
ко Г.Н., 1983].
Новым (пятым) этапом в ангио-
хирургии явилось использование
предложенных N.S.Kapani в 1961 —
1967 гг. эндоскопов с фиброволо-
конной оптикой, позволивших зна-
чительно расширить возможности
изучения сердца и сосудов. В 1986 г.
S.M. Greenstone и соавт. впервые
использовали фиброэндоскоп для
визуального исследования аорты и
магистральных артерий на трупе
человека [Greenstone S.M. et al.,
1966]. Авторы высказали предполо-
жение о возможности клинического
применения ангиофиброскопии.
Впервые в клинике эндоскопию со-
судов осуществили J.F.Vollmar и
K.Junghanns в 1969 г. [Vollmar J. et
al., 1969]. Исследователи сообщили
о прямом введении эндоскопа в
бедренную артерию в целях контро-
ля за качеством выполнения из нее
полузакрытой эндартерэктомии. В
нашей стране впервые ангиофибро-
скопия успешно была выполнена в
Институте хирургии им. А.В.Виш-
невского в 1979 г. М.Е.Саргиным у
11 больных с тромбооблитерирую-
щими заболеваниями аорты и маги-
стральных артерий нижних конеч-
ностей [Кузин М.И., Саргин М.Е.,
1980]. В сравнении с жесткими мо-
делями фиброэндоскопы обладают
рядом существенных достоинств, к
которым относятся большой диапа-
зон диаметров, начиная с 1 мм,
гибкость и высокая маневренность
дистальной части эндоскопа, боль-
шая длина рабочей части, яркий
холодный свет, передаваемый по
световоду от внешнего осветителя,
высокое качество получаемого
изображения, хорошая цветопере-
дача, возможность выполнения вы-
сококачественной фото- и кино-
съемки [Кулик Я.П. и др., 1982;
Greenstone S.M. et al., 1966; Cris-
pin H.A., Baarle A.F., 1973; Litvac F.
et al., 1985; Miller A. et al., 1989;
Sargin M., 1990].
В основе интраоперационной ан-
гиофиброскопии лежит использова-
ние тонких и ультратонких фибро-
эндоскопов, технические особенно-
сти которых позволяют визуально
исследовать просвет сосудов и со-
судистых трансплантатов, располо-
женных на большой глубине опера-
ционной раны на этапе реконст-
руктивного вмешательства, предше-
ствующего восстановлению крово-
тока.
Для ангиоскопического контроля
за качеством выполнения реконст-
руктивных операций на сосудах
аортоподвздошного сегмента наи-
более приемлемы фиброэндоскопы
диаметром 3,5—4,0 мм, для бедрен-
но-подколенного сегмента — диа-
метром 2,0—3,0 мм.
Получение четкого изображения
внутрисосудистых структур преду-
сматривает оттеснение от них кро-
ви, что может быть достигнуто бло-
кированием кровотока:
• с помощью сосудистых зажи-
мов;
• с помощью окклюзионного ка-
тетера типа Фогарти;
• путем наполнения прозрачной
жидкостью баллона, закрепленного
на конце фиброэндоскопа;
• оттеснением его потоком вво-
димого через канал фиброэндоско-
па прозрачного изотонического
раствора натрия хлорида.
Выбор того или иного способа
блокирования кровотока определя-
ется двумя факторами: диаметром
исследуемых сосудов или сосуди-
стых трансплантатов и характером
реконструктивного вмешательства.
Ангиофиброскопию, в ходе кото-
рой блокирование кровотока осу-
ществляется с помощью сосудистых
зажимов, предпочтительно приме-
нять при осмотре артерий под-
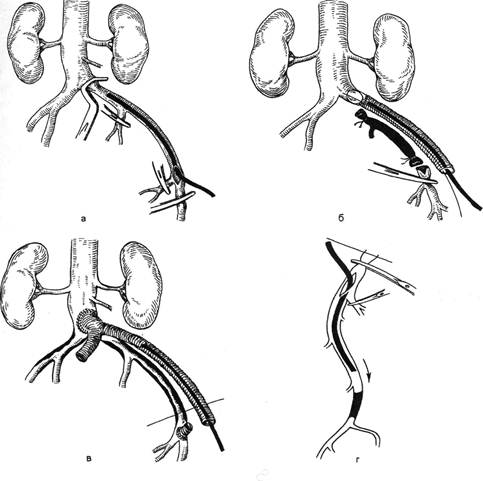
Рис. 2.141. Методы блокирования кровотока.
а — с помощью сосудистых зажимов; б — с помощью катетера типа Фогарти; в — с помо-
щью эластичного баллона, закрепленного на конце рабочей части эндоскопа; г — путем пер-
фузии сосуда прозрачным изотоническим раствором натрия хлорида, вводимым через канал
фиброэндоскопа.
вздошно-бедренного сегмента (рис.
2.141, а). Подобная тактика обу-
словлена возможностью выделения
на большом протяжении подвздош-
ных и бедренных артерий как при
забрюшинном, так и при лапаро-
томном доступе. Данная методика
ангиофиброскопии наиболее при-
емлема в случаях осуществления
контроля за качеством выполнения
полузакрытой эндартерэктомии,
качеством наложения анастомозов
и сосудистых швов при боковой
пластике артерий с использованием
различных сосудистых экспланта-
тов.
Методика использования катете-
ра типа Фогарти для блокирования
центрального кровотока препятст-
вует ретроградному кровотоку из
коллатералей, что делает неприем-
лемой применение этой методики
при исследовании магистральных
артерий (рис. 2.141, б). Ангиофиб-
роскопия с использованием дан-
ной методики блокирования кро-
вотока предпочтительна при осу-
ществлении контроля за качест-
вом выполнения тромбэктомии из
синтетических сосудистых проте-
зов. При этом диаметр используе-
мого эндоскопа не должен превы-
шать % диаметра исследуемого про-
теза.
Использование фиброэндоскопа
с эластичным баллоном, закреплен-
ным на конце рабочей части, по-
зволяет блокировать кровоток его
наполнением прозрачной жидко-
стью, вводимой через канал фибро-
эндоскопа (рис. 2.141, в). Примене-
ние фиброэндоскопа с эластичным
баллоном обеспечивает возмож-
ность временной окклюзии крово-
тока в брюшном отделе аорты и
подвздошных артериях диаметром
более 15 мм. При этом создаются
хорошие условия для осмотра ана-
стомозов протезов с артериями и
оценки состояния устьев висцера-
льных ветвей брюшной аорты, по-
чечных и поясничных артерий. В
ходе исследования магистральных
артерий хорошо визуализируются
такие детали внутрисосудистой па-
тологии, как стенозы, окклюзии,
отдельные бляшки, участки отслое-
ния интимы, интимальные разрывы
в местах наложения сосудистых за-
жимов на измененные участки ар-
терий. Эндоскопическая оценка со-
стояния атеросклеротических бля-
шек позволяет выявить их изъязв-
ления, наличие атероматоза и сте-
пень стенозирования ими просвета
артерий.
Блокирование кровотока путем
оттеснения крови потоком вводи-
мого через ирригационный канал
изотонического раствора натрия
хлорида обеспечивает создание
прозрачной среды между оптиче-
ской системой фиброэндоскопа и
стенкой сосуда (рис. 2.141, г). Ан-
гиофиброскопия по этой методике
приемлема для осуществления кон-
троля за качеством выполнения по-
лузакрытых видов эндартерэктомии
из поверхностной бедренной арте-
рии, подколенной артерии и арте-
рий голени. Особую значимость ме-
тод приобретает в случаях оценки
полноты разрушения клапанов и
выявления локализации устьев при-
токов при аутовенозном шунтиро-
вании по методике in situ.
Показаниями к интраоперацион-
ной ангиофиброскопии следует
считать необходимость контроля:
• за качеством выполнения полу-
закрытых видов эндартерэктомии
из окклюзированных артерий;
• за полнотой выполнения тромб-
эктомии из синтетических сосуди-
стых протезов;
• за состоянием сосудистых ана-
стомозов в ходе повторных рекон-
структивных операций;
• за полнотой разрушения клапа-
нов при использовании вены in situ.
Ангиоскопическая диагностика
внутрисосудистых изменений бази-
руется на основных эндоскопиче-
ских признаках, к которым отно-
сятся:
▲форма просвета сосуда;
▲контуры просвета сосуда;
▲цвет внутренней поверхности
сосуда;
▲характеристика пристеночных
наложений;
▲наличие ретроградного крово-
тока;
▲состояние линии сосудистого
шва.
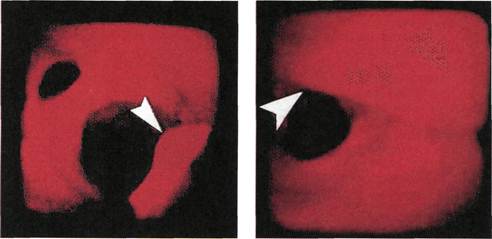
Эндоскопическая картина раз-
личных отделов неизмененной аор-
ты и ее ветвей идентична. Просвет
неизмененного сосуда имеет округ-
лую или овальную форму, что зави-
сит от взаимоотношения с окружа-
ющими анатомическими образова-
ниями. Ровные контуры присущи
неизмененным стенкам артерий,
имеющим белесоватый или бледно-
желтый цвет. В просвет магистраль-
ных артерий открываются устья
коллатеральных ветвей, берущих
начало преимущественно на перед-
ней и боковых полуокружностях
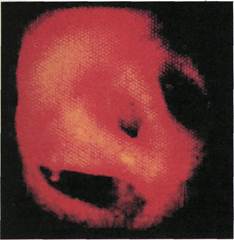
Рис. 2.142. Ангиофиброскопия (пато-
логоанатомический материал). Дуга
аорты. Слева направо: устье брахиоце-
фального ствола, левой общей сонной
артерии, левой подключичной артерии.
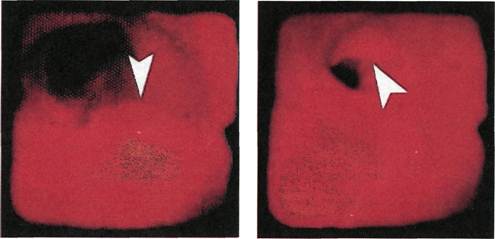
сосуда (рис. 2.142—2.145). В отли-
чие от неизмененной артерии про-
свет артерии, пораженной атероск-
лерозом, имеет неправильную фор-
му, что свидетельствует о его стено-
зировании. Неровность контуров
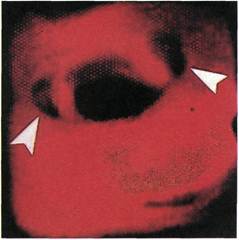
Рис. 2.144. Ангиофиброскопия (пато-
логоанатомический материал). Устье
чревного ствола.
обусловлена выстоянием в просвет
различных по форме и протяженно-
сти атеросклеротических бляшек,
преимущественной локализацией
которых являются места бифурка-
ции артерий и их задняя стенка.
Неровность контуров самих бляшек
и их изъязвление свидетельствуют о
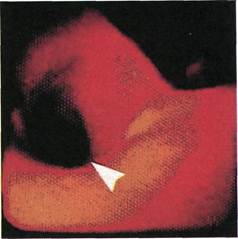
Рис. 2.143. Ангиофиброскопия (пато-
логоанатомический материал). Область
бифуркации брахиоцефального ствола.
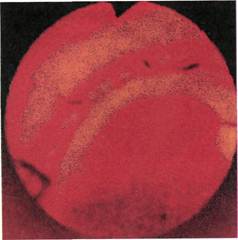
Рис. 2.145. Ангиофиброскопия (пато-
логоанатомический материал). Атеро-
склеротическая бляшка в просвете об-
щей подвздошной артерии.
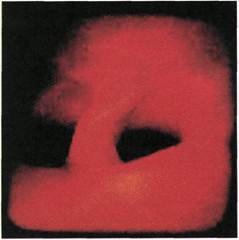
Рис. 2.146. Ангиофиброскопия (пато-
логоанатомический материал). Атеро-
склеротическая бляшка в просвете об-
щей подвздошной артерии.
Рис. 2.148. Ангиофиброскопия (пато-
логоанатомический материал). Атеро-
склеротическая бляшка в просвете об-
щей бедренной артерии.
наличии распада участков атерока-
льциноза. В местах окклюзии про-
свет стенозированных артерий име-
ет вид конуса, заканчивающегося
слепо (рис. 2.146—2.149).
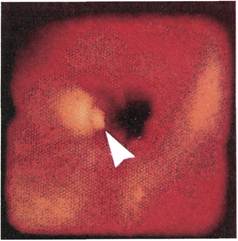
При эндоскопии стенок артерии
после выполнения из нее полуза-
крытой эндартерэктомии хорошо
визуализируется гладкая поверх-
ность белесовато-желтого цвета с
четко очерченными, циркуляр-
но располагающимися волокнами
среднего слоя без перфораций и
кровоизлияний. В случаях полуза-
Рис. 2.147. Ангиофиброскопия (пато-
логоанатомический материал). Атеро-
склеротическая бляшка в просвете на-
ружной подвздошной артерии.
Рис. 2.149. Ангиофиброскопия (пато-
логоанатомический материал). Атеро-
склеротическая бляшка в просвете по-
верхностной бедренной артерии.
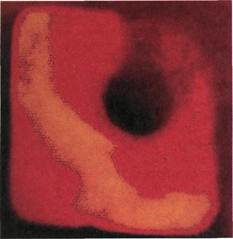
Рис. 2.150. Ангиофиброскопия (экспе-
риментальный материал). Внутренняя
поверхность бедренной артерии после
выполнения из нее полузакрытой эн-
дартерэктомии.
крытой эндартерэктомии, когда
стенка артерии расслаивается не-
равномерно, в просвете сосуда ви-
зуализируются свисающие обрывки
неудаленной интимы и выстоящие
из устьев коллатералей остатки ате-
росклеротических бляшек. Подоб-
ные находки в просвете артерии
требуют выполнения дополнитель-
ной эндартерэктомии с последую-
щим эндоскопическим контролем
(рис. 2.150, 2.151).
К числу эндоскопических при-
знаков, на основании которых
можно судить о том, что анастомоз
выполнен без дефектов, относятся
ровная линия шва без деформаций
и сужений, отсутствие прорезыва-
ния интимы анастомозируемых со-
судистых сегментов, отсутствие вы-
стоящих в просвет анастомоза ни-
тей синтетических сосудистых про-
тезов и отсутствие пристеночных
тромбов на линии сосудистого шва.
Ангиоскопия анастомозов, осмот-
ренных в отдаленные сроки наблю-
дения в ходе повторных операций,
позволяет установить наличие или
отсутствие сужений и деформаций
линии шва, а также пристеночных
тромбов и участков гиперплазии
интимы (рис. 2.152, 2.153).
При эндоскопии стенок протеза,
полностью освобожденных от тром-
Рис. 2.151. Ангиофиброскопия (экспе-
риментальный материал). Просвет бед-
ренной артерии после полузакрытой
эндартерэктомии. В просвет выстоит
обрывок интимы из устья коллатерали.
Рис. 2.152. Ангиофиброскопия (экспе-
риментальный материал). Без дефекта
выполненный анастомоз между алло-
протезом и общей подвздошной арте-
рией.
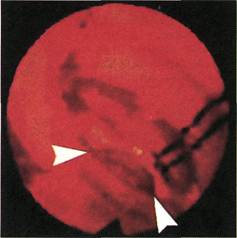
Рис. 2.153. Ангиофиброскопия (клини-
ческий материал). Стеноз анастомоза
конец в бок между аллопротезом и об-
щей бедренной артерией.
ботических масс и «неоинтимы»,
хорошо визуализируются четко
очерченные, с ровными контурами
циркулярные гофры. В случаях пе-
рекрута протеза по оси или сдавле-
ния его извне окружность просвета
резко деформирована. Не полно-
стью удаленные остатки тромботи-
ческих масс имеют вид единичных
или множественных наложений
различной формы и величины тем-
но-красного цвета, выстоящих в
просвет протеза. Остатки неудален-
ной «неоинтимы» в виде выстилки
ярко-красного цвета покрывают
гофры, делая их поверхность глад-
кой. Отслоившиеся участки «нео-
интимы» в виде диафрагмы частич-
но или полностью перекрывают
просвет протеза (рис. 2.154, 2.155).
При ангиофиброскопии неизме-
ненных вен хорошо визуализирует-
ся их просвет, имеющий округ-
лую форму с ровными контурами.
В норме эндотелиальная выстилка
белесоватого цвета, без кровоизли-
яний и пристеночных наложений.
В просвете вен визуализируются
устья боковых притоков округлой
формы различного диаметра, из ко-
торых поступает поток крови. Кла-
паны вен в положении «замкнуто»
выглядят как створки диафрагмы
белесоватого цвета, полностью за-
крывающие просвет сосуда. Откры-
тые створки клапанов, прилегая к
стенкам вены, имеют вид валиков,
Рис. 2.154. Ангиофиброскопия (экспе-
риментальный материал). Стенки ал-
лопротеза полностью освобождены от
тромботических масс и «неоинтимы».
Рис. 2.155. Ангиофиброскопия (экспе-
риментальный материал). Неудаленные
остатки тромботических масс на стен-
ках протеза.
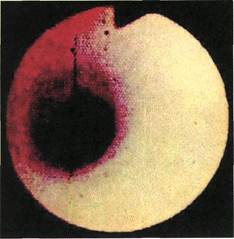
Рис. 2.156. Ангиофиброскопия (пато-
логоанатомический материал). Просвет
неизмененной большой подкожной
вены.
незначительно выступающих над ее
поверхностью. При использовании
вены in situ на месте иссеченного
клапана эндоскопически визуали-
зируется венчик остатков створок,
незначительно выстоящих в про-
свет вены. Грубое обращение с
аутовенозным трансплантатом не-
редко приводит к травме эндотелия
и появлению кровоизлияний, легко
диагностируемых в ходе ангиоско-
пии (рис. 2.156-2.158).
Таким образом, изучение эндо-
скопической семиотики сосудов и
сосудистых трансплантатов явилось
основой интраоперационной диа-
гностики сосудистых поражений и
погрешностей оперативной техни-
ки, что позволило определить так-
тику их хирургической коррекции в
ходе 31 первичной и 37 повтор-
ных реконструктивных операций у
68 больных с поражением аорто-
подвздошного и бедренно-подко-
ленного сегментов.
В целях контроля за качеством
выполнения сосудистого шва нами
произведена ангиофиброскопия 51
анастомоза, из которых 30 первич-
ных анастомозов выполнены в ходе
первичных и повторных операций и
21 анастомоз осмотрен в отдален-
ные сроки наблюдения при повтор-
ных операциях. В ходе выполнения
ангиоскопии анастомозов в 21,6 %
случаев выявлены дефекты, нали-
чие которых могло привести к ран-
ним послеоперационным тромбо-
зам и кровотечениям.
Рис. 2.157. Ангиофиброскопия (пато-
логоанатомический материал). Клапа-
ны аутовены в положении «замкнуто».
Рис. 2.158. Ангиофиброскопия (пато-
логоанатомический материал). Откры-
тые створки клапана.
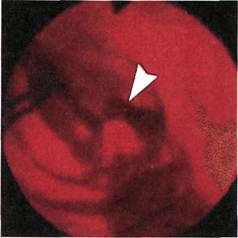
Рис. 2.159. Ангиофиброскопия (клини-
ческий материал). Стеноз анастомоза
конец в бок аллопротеза с бедренной
артерией. Стрелкой указан участок ги-
перплазии интимы.
Дефекты первичных анастомозов
нами диагностированы в 16,7 %
первично выполненных анастомо-
зов. Ангиоскопия позволила выя-
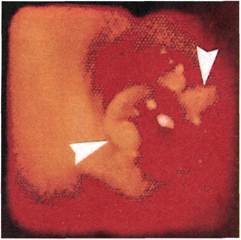
Рис. 2.160. Ангиофиброскопия (клини-
ческий материал). Просвет поверхност-
ной артерии бедра после выполнении
из нее полузакрытой эндартерэктомии.
В просвет артерии выстоят обрывки
интимы.
вить и устранить до восстановления
кровотока в зоне реконструкции та-
кие погрешности хирургической
техники сосудистого шва, как про-
резывание интимы, оставление
пристеночных тромбов на линии
шва, стеноз анастомоза и выстоя-
ние в его просвет нитей синтетиче-
ских сосудистых протезов.
Ангиоскопию анастомозов в от-
даленные сроки наблюдения вы-
полняли в случаях, когда до опера-
ции ни ангиография, ни ультразву-
ковое сканирование не давали до-
стоверной информации о состоя-
нии анастомозов. Подобная ситуа-
ция возникала при тромбозах син-
тетических протезов. После выпол-
нения тромбэктомии ангиоскопия
позволила диагностировать стенозы
в области анастомозов в 28,6 % слу-
чаев, что потребовало выполнения
их соответствующей коррекции
(рис. 2.159).
В целом ангиоскопия позволила
избежать развития ранних после-
операционных осложнений со сто-
роны анастомозов у всех больных,
которым она выполнялась.
В клинике ангиоскопический
контроль осуществляли в ходе 20
операций полузакрытой эндартерэк-
томии из подвздошных и бедренных
артерий. В половине случаев эндар-
терэктомию выполняли с помощью
ультразвукового комплекса. Прове-
денные эндоскопические исследова-
ния показали, что в 20 % случаев
полузакрытой эндартерэктомии вы-
явлены не полностью удаленные об-
рывки атеросклеротически изме-
ненной интимы, наличие которых
могло привести к ранним послеопе-
рационным тромбозам. Дополните-
льная эндартерэктомия, предприня-
тая в этих случаях до восстановле-
ния кровотока в зоне реконструк-
ции, позволила избежать развития
тромбозов в раннем послеопераци-
онном периоде (рис. 2.160, 2.161).
Полученные нами результаты ан-
гиофиброскопии свидетельствуют о
более высокой эффективности уль-
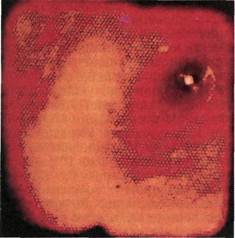
Рис. 2.161. Ангиофиброскопия (клини-
ческий материал). Тот же участок про-
света артерии после дополнительной
эндартерэктомии.
тразвуковои эндартерэктомии по
сравнению с другими методиками
полузакрытой эндартерэктомии.
Ангиофиброскопия 30 тромбиро-
ванных синтетических сосудистых
протезов после тромбэктомии осу-
ществлена в ходе 28 повторных
операций. Целью исследования
явилось осуществление контроля за
полнотой удаления тромботических
масс из синтетических сосудистых
протезов в ходе традиционной
тромбэктомии катетером Фогарти,
а также тромбэктомии с использо-
ванием ультразвукового комплекса.
Восстановление центрального
кровотока после непрямой тромб-
эктомии не гарантирует отсутствия
пристеночных тромбов, отрыв ко-
торых после восстановления крово-
тока может привести к развитию
эмболии. Данное положение под-
тверждено результатами ангиофиб-
роскопии. Эндоскопические иссле-
дования показали, что восстановле-
ние кровотока в тромбированном
сосудистом протезе в 32,1 % наблю-
дений сопровождалось наличием
в просвете протеза неудаленных
тромботических масс, что потребо-
вало выполнения дополнительной
тромбэктомии, во время которой
остатки тромбов и участки «неоин-
тимы» отделяли от стенок протеза с
помощью металлических петель и
колец с последующим удалением их
катетером Фогарти (рис. 2.162,
2.163).
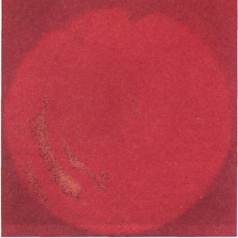
|
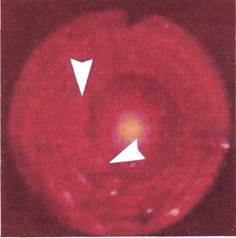
|
Рис. 2.162. Ангиофиброскопия (клини-
ческий материал). Остатки тромботиче-
ских масс в просвете протеза.
Рис. 2.163. Ангиофиброскопия (клини-
ческий материал). Просвет протеза по-
сле дополнительной тромбэктомии.
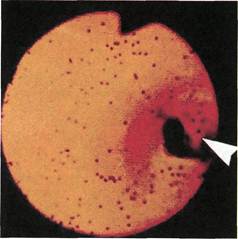
Рис. 2.164. Ангиофиброскопия (клини-
ческий материал). Просвет аутовены
после деструкции створок клапана.
Стрелкой указана неразрушенная
створка клапана.
Полученные нами данные анги-
оскопии свидетельствуют о более
высокой эффективности ультразву-
ковой тромбэктомии по сравнению
с традиционной тромбэктомией ка-
тетером Фогарти. Применение эн-

Рис. 2.165. Ангиофиброскопия (клини-
ческий материал). Просвет той же ауто-
вены после дополнительной деструк-
ции створок клапана.
доскопического контроля за полно-
той выполнения тромбэктомии из
синтетических сосудистых протезов
способствовало снижению частоты
ретромбозов в раннем послеопера-
ционном периоде до 3,6 %.
Эндоскопический контроль за
полнотой разрушения клапанов и
выявление мест впадения притоков
при использовании большой под-
кожной вены по методике in situ
нами применены в ходе 10 реконст-
руктивных операций на бедрен-
но-подколенном и подколенно-ти-
биальном сегментах. Во время ан-
гиоскопии не полностью разрушен-
ные створки клапанов выявлены у
60 % больных, что потребовало вы-
полнения их дополнительной дест-
рукции.
Точное определение мест впаде-
ния в большую подкожную вену
притоков облегчило их выделение и
лигирование в ходе реконструкции.
Полученные результаты свидетель-
ствуют о высокой информативно-
сти ангиоскопии при выполнении
шунтирующих операций по методи-
ке in situ. В ближайшем послеопе-
рационном периоде не отмечено ни
одного случая тромбоза в зоне ре-
конструкции (рис. 2.164, 2.165).
Завершающим этапом реконст-
руктивных вмешательств на сосудах
являлась интраоперационная анги-
ография, которую выполняли после
восстановления кровотока в зоне
реконструкции. Проведенные ис-
следования не выявили дефектов в
зоне реконструкции ни в одном
случае, что свидетельствует о высо-
кой информативности предшество-
вавшей ей ангиофиброскопии.
Таким образом, на основании
проведенных нами исследований
разработана эндоскопическая се-
миотика сосудов и сосудистых
трансплантатов в норме и при раз-
личных формах поражения, что
позволяет оценить эффективность
и качество выполнения реконст-
руктивных вмешательств на сосу-
дах. Информация, получаемая в
ходе интраоперационной ангио-
фиброскопии на этапе, предшест-
вующем восстановлению кровотока
в зоне реконструкции, дает воз-
можность своевременно диагности-
ровать и устранять погрешности
хирургической техники, что в ко-
нечном итоге значительно снижает
количество ранних послеопераци-
онных тромбозов.
В заключение мы выражаем на-
дежду, что ангиофиброскопия зай-
мет достойное место среди интра-
операционных методов исследова-
ния сосудов и сосудистых транс-
плантатов и позволит улучшить ре-
зультаты реконструктивных вмеша-
тельств на магистральных сосудах.
Литература
Вахидов В.В., Гамбарин Б.Л. Хирургиче-
ское лечение тромбозов сосудистых про-
тезов и венозных трансплантатов//Хирур-
гия. - 1985. - № 3. - С. 27.
Гамбарин Б.Л., Аганов Т.Н. Интраопера-
ционная оценка реконструктивных опе-
раций на глубокой артерии бедра//Мед.
журн. Узбекистана. — 1982. — № 11. —
С. 48.
Кузин М.И., Саргин М.Е. Вазофиброско-
пия//Вестн. хир. — 1980. - № 5. — С. 8.
Кулик Я.П., Марущенко Т.Н. История раз-
вития и перспективы применения эндо-
кардиоскопии (обзор литературы)//Хи-
рургия. - 1982. - № 12. - С. 117.
Марущенко Т.Н. Фиброкардиоскопия в
диагностике пороков сердца: Автореф.
дис.... д-ра мед. наук. — Хабаровск, 1983.
Покровский А.В., Ашуров Б.М. Хирургиче-
ское лечение осложнений в области дис-
тальных анастомозов после аортобедрен-
ных реконструкций//Хирургия.— 1983.—
4. - С. 69.
Allen D.S., Graham E.A. Intracardiac surge-
ry—a new method//J.A.M.A. — 1922. —
Vol. 79. - P. 1028.
Beck A., Milic S., Dinkel E. et a I. Arterielle
gefaubendoskopic und lokale lysetherapie//
C.V.World Report. - 1989. - Vol. 2. -
P. 190.
Bloomberg A.E., Hurwitt E.S. Endoscopy of
the heart//Surg. Clin. N. Amer. — 1957. -
Vol. 37. - P. 1337.
Bolton H.E., Baily СР., Costas-Durieux J. et
al. Cardioscopy — simple and practical//J.
Thorac. Surg. - 1954. - Vol. 27. - P. 323.
Butterworth R.F. A new operating cardiosco-
pe//J. Thorac. Surg. - 1951. - Vol. 22. -
P. 319.
Crispin H.A., Baarle A.F. Intravascular obser-
vation and surgery using the flexible fibers-
cop//Lancet. - 1973. - Vol. 1, N 7. -
P. 750.
Greenstone S.M., Shore J.M., Heriugman E.G.
et al. Arterial endoscopy (Arterioscopy)//
Arch. Surg. - 1966. - Vol. 93. - P. 811.
likawa Т., Hattori K., Inomata K. et al. Study
on the cardioscope//Bull. Heart. Inst. Jap. —
1957. -Vol. 1, N 1. -P. 85.
Lee G., Garcia J.M., Corso P.J. et al. Corre-
lation of coronary angioscopic to angiograp-
hic findings in coronary artery diseases//
Amer. J. Cardiol.- 1986.- Vol. 58, N 3.-
P. 238.
Litvac F., Grundfest W.S., Lee M.E. et al.
Angioscopic visualization of blood vessel in-
terior in animals and humans//Clin. Cardi-
ol. - 1985. - Vol. 8. - P. 65.
Miller A., Lipson W.E., Isaacsohn J.L. et al.
Intraoperative angioscopy: principles of irri-
gation and description of a new dedicated ir-
ridation pump//Amer. Heart J. — 1989. —
Vol. 118, N 2. - P. 391.
Pearce R.B. Vascular endoscopy is coming of
age//Car. - 1986. - Vol. 152. - P. 139.
Phea L., Walker L.C., Cutler E.C. The surgi-
cal treatment of mitral stenosis: Experimen-
tal and clinical studies // Arch. Surg. —
1924. - Vol. 9. - P. 689.
Sakakibara S., Iicawa Т., Hattori I. et al. Di-
rect visual operation for aortic stenosis: Car-
dioscopic studies // J. Int. Coll. Surg. —
1958. - Vol. 29. - P. 548.
Sargin M. Angioscopy of congenital cardiac
lesions//Lasers in cardiovascular medicine
and surgery: fundamentals and techniques/
Ed. G.S.Abela. — Boston — Dordrecht —
London: Kluwer Academic Publishers, Inc.,
1990. - P. 411.
Shure D., Gregoratos G, Moser K.M. Fibe-
roptic angioscopy: role in the diagnosis of
chronic pulmonary//Ann. intern. Med. —
1982. - Vol. 103. - P. 844.
Tanabe Т., Yokota A., Sugie S. Cardiovascu-
lar fiberoptic endoscopy: development and
clinical application//Surgery. — 1980. —
Vol. 87. - P. 375.
Vollmar J., Junghanns K. Die Arteroskopie,
eine neue moglichkeit der intraoperativen er-
folgsbeurteilung bei reconstruktiven gefabein-
griffen (Farbfilm)//Langenbecks Arch. klin.
Chir. - 1969. - Vol. 325. - P. 1201.
Vollmar J., Storz L.W. Vascular endoscopy.
Possibilities and limits of its clinical applica-
tion//Surg. Clin. N. Amer. — 1974. - Vol.
54, N 1. - P. 111.
Дата добавления: 2015-02-06 | Просмотры: 771 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|