Принципы сосудистой реконструкции
Идея восстановления проходимости
сосуда наложением шва всегда была
заманчивой и давно привлекала
внимание хирургов. Начало исто-
рии сосудистого шва обычно свя-
зывают с именем английского врача
Hallowel, который еще в 1758 г.
успешно наложил боковой шов на
плечевую артерию.
А.А.Ясиновский (1889) впервые
сформулировал основные теорети-
ческие принципы шва артерии,
справедливые и по сей день: соблю-
дение строгой асептики, недопусти-
мость попадания в просвет сосуда
периадвентициальных тканей и
шовного материала, необходимость
проведения нити через все слои со-
судистой стенки, обязательная
адаптация интимы двух отрезков
сшиваемого сосуда, нежелатель-
ность излишней травматизации ар-
терий, необходимость прижатия ли-
нии шва для остановки кровотече-
ния.
Одно из условий правильного на-
ложения сосудистого шва — вре-
менное прекращение кровотока в
зоне наложения шва за счет адек-
ватного пережатия сосудистых
стволов. При этом возможны три
варианта.
• Частичное боковое отжатые.
Преимуществом способа является
отсутствие полного прекращения
кровотока по сосуду. Однако такой
способ увеличивает риск поврежде-
ния сосудистой стенки, особенно в
случаях выраженного склероза или
кальцификации артерий, и затруд-
няет экспозицию сосудистой стен-
ки при наложении шва.
• Полное поперечное пережатие.
При этом достигается наилучшая
экспозиция сшиваемых краев сосу-
да и обеспечивается их максималь-
ная подвижность при выполнении
реконструкции. Риск повреждения
сосудистой стенки значительно ме-
ньше в случае, если зажим накла-
дывают в зоне без явлений склероза
и кальцификации (рис. 3.1), однако
на практике это не всегда выполни-
мо, поэтому для снижения риска
фрагментирования бляшки и эмбо-
лии бранши зажима должны распо-
лагаться параллельно зоне пораже-
ния;
• Внутрипросветная окклюзия —
ее выполняют при помощи баллон-
ного катетера. Используют редко,
например в случае тонкой сосуди-
стой стенки, которая может быть
повреждена при пережатии зажи-
мами, или в случае затруднения
при обнаружении источника кро-
вотечения с целью максимально-
го сокращения времени операции
и уменьшения объема кровопо-
тери.
В настоящее время в сосудистой
хирургии применяют несколько ва-
риантов выполнения сосудистого
шва и сосудистых анастомозов.
Наиболее простой является техника
выполнения артериотомии с после-
дующим закрытием разреза с помо-
щью сосудистого шва. Эту технику
используют главным образом при
операциях тромб(эмбол)эктомии,
эндартерэктомии. Существует два
варианта артериотомии — продоль-
ная и поперечная. Чаще всего вы-
полняют продольную артериото-
мию. Это позволяет более тщатель-
но осмотреть просвет и стенку со-
суда и в случае необходимости вы-
полнить реконструктивную шунти-
рующую операцию; продольное ар-
териотомическое отверстие может
быть использовано для наложения
проксимального анастомоза.
Основной недостаток продольной
артериотомии, особенно протяжен-
ной, — высокая вероятность суже-
ния просвета сосуда после ушива-
ния разреза, поэтому для сосудов
малого диаметра (менее 4 мм) более
предпочтительна поперечная арте-
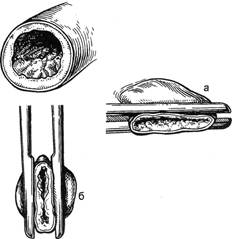
Рис. 3.1. Правильное (а) и неправиль-
ное (б) наложение зажима на стенку
сосуда в области атеросклеротической
бляшки.
риотомия. Начальный прокол стен-
ки сосуда осуществляют при помо-
щи скальпеля, тщательно следя за
тем, чтобы не повредить противо-
положную стенку сосуда. Затем, ис-
пользуя угловые ножницы, разрез
увеличивается в продольном или
поперечном направлении (рис. 3.2).
В последующем артериотомическое
отверстие ушивают непрерывным
сосудистым швом или с использо-
ванием заплаты. При этом возмож-
ны два варианта: 1) первый шов
выполняют в одном из углов ар-
териотомического отверстия, пос-
ле чего его непрерывно ушивают
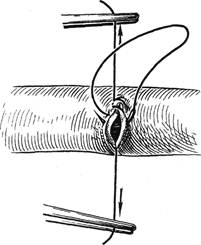
Рис. 3.3. Ушивание артериотомическо-
го отверстия непрерывным швом.
(рис. 3.3); 2) накладывают два пер-
вых шва по углам раны и затем вы-
полняют два непрерывных шва на-
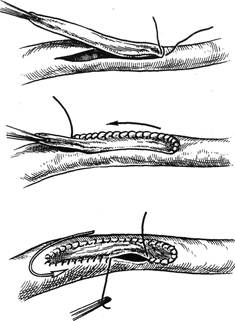
Рис. 3.4. Пластика артериотомического
отверстия с использованием заплаты.
встречу друг другу от углов к центру
разреза.
Как уже отмечалось выше, уши-
вание продольного артериотомиче-
ского отверстия может привести к
сужению просвета сосуда. В этом
случае применяют пластику запла-
той. В качестве заплат могут быть
использованы различные материа-
лы — аутовена, ксеноперикард,
синтетические ткани и др. Приме-
нение аутовены более физиологич-
но. Использование тонкой аутове-
нозной заплаты нежелательно, так
как при этом в условиях артериаль-
ного кровотока высока вероятность
развития аневризматического рас-
ширения. Предпочтение при этом
отдают синтетическим заплатам.
Наилучшими свойствами обладают
заплаты из политетрафторэтилена.
Выкроенная заплата должна соот-
ветствовать размерам артериотоми-
ческого отверстия, углы заплаты
слегка закругляют. Заплату вшива-
ют непрерывным швом (рис. 3.4).
Первый шов накладывают в облас-
ти одного из углов заплаты либо
накладывают два шва на противо-
положные углы, выполняя в после-
дующем два шва навстречу друг
другу.
Важнейшим вопросом сосудистой
хирургии является техника выпол-
нения сосудистых анастомозов. При
этом могут быть использованы сле-
дующие варианты швов (рис. 3.5):
• отдельные узловые швы — ис-
пользуют при наложении анастомо-
зов конец в конец сосудов малого
диаметра или при выполнении со-
судистого шва у детей, так как при
этом варианте возможен рост зоны
анастомоза;
• отдельные горизонтальные мат-
рацные швы — используют глав-
ным образом при реконструкции
крупных сосудов, расположенных
близко к сердцу;
• непрерывный шов — применя-
ют наиболее часто;
• непрерывный горизонтальный
матрацный шов — выполняют при
реконструкции грудной и брюшной
аорты.
Существует три основных вари-
анта наложения сосудистых анасто-
мозов: конец в конец; конец в бок
и бок в бок.
Наиболее простым в техническом
отношении является соединение
двух перпендикулярно срезанных
концов сосуда (или сосуда и проте-
за) техникой конец в конец (рис.
3.6). При этом первый шов накла-
дывают по задней стенке анастомо-
за либо выполняют два первых шва
по передней и задней стенке, после
чего накладывают непрерывный
шов. В случае сшивания сосудов
малого диаметра применяют следу-
ющую модификацию шва: первона-
чально накладывают три шва-дер-
жалки под углом 120°, с помощью
которых просвет сосуда растягива-
ют. После этого анастомоз выпол-
няют с помощью отдельных узло-
вых швов.
Выполнение описанных анасто-
мозов требует достаточной подвиж-
ности сшиваемых концов для адек-
ватного выполнения шва по задней
стенке. Кроме того, при сшивании
сосудов, срезанных перпендикуляр-
но, высока вероятность стеноза
анастомоза. Поэтому чаще всего
при выполнении анастомоза конец
в конец сшиваемые отрезки среза-
ют не перпендикулярно, а под уг-
лом, что позволяет предотвратить
сужение анастомоза, а кроме того,
облегчить его наложение в случае
исходной разницы диаметров сши-
ваемых отрезков.
При выполнении любого вида
сосудистых швов целесообразнее
использовать атравматические иглы
и монофиламентные нити. Вкол
иглы в артериальный сосуд осуще-
ствляют изнутри кнаружи (рис. 3.7).
Это особенно важно в случае атеро-
склеротических изменений артери-
альной стенки, так как такой спо-
соб выполнения шва предотвращает
отслойку интимы и вворачивание
ее в просвет сосуда.
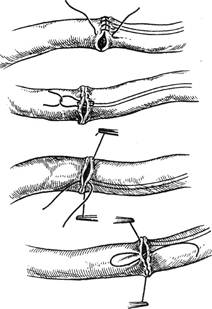
Рис. 3.5. Швы, используемые при опе-
рациях на сосудах.
| Рис. 3.6. Анастомоз конец в конец.
|
Анастомоз конец в бок (рис.
3.8) — наиболее часто используемый
в сосудистой хирургии вариант пла-
стики. Общими принципами нало-
жения такого вида анастомозов яв-
ляются следующие. Длина артерио-
томического отверстия должна со-
ставлять около двух диаметров под-
шиваемого шунта (аутовена, синте-
тический протез и др.); проксималь-
ный отрезок подшиваемого шунта
срезается под углом, после чего ему
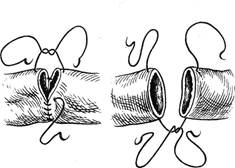
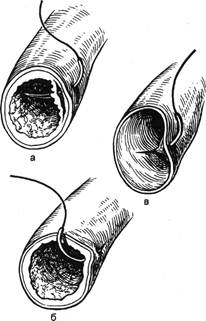
Рис. 3.7. Правильное (б) и неправиль-
ное направление вкола иглы в артери-
альную (а) и венозную (в) стенки.
сшиваемого отрезка с артериотоми-
ческим отверстием на один из его
углов накладывают первый шов, а
затем выполняют непрерывный
шов по обеим полуокружностям
анастомоза. Залогом успеха являет-
ся максимально точное соответст-
вие диаметра шунта и размера арте-
риотомического отверстия.
Наиболее редко используемым
вариантом сосудистого анастомоза
является анастомоз бок в бок (рис.
3.9). Его используют при наложе-
нии портокавальных анастомозов, а
также при формировании артерио-
венозных фистул. При этом, как
правило, применяют боковое отжа-
тие стенок сшиваемых сосудов. По-
сле выполнения артериотомий на
углы накладывают швы-держалки, с
помощью которых анастомоз растя-
гивают. Затем непрерывным швом
сшивают сначала внутренние, а за-
тем наружные стенки артериотоми-
ческих отверстий.
придают округлую форму. Это по-
зволяет, с одной стороны, увеличить
диаметр анастомоза, а с другой —
расположить шунт под необходи-
мым углом относительно артерии.
Как правило, этот угол должен
составлять 30—45°, однако в неко-
торых случаях (например, при вы-
полнении проксимального анасто-
моза при подмышечно-бедренном
шунтировании) этот угол может до-
стигать 75°. После сопоставления
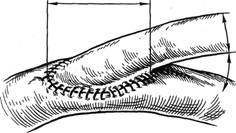
Рис. 3.8. Анастомоз конец в бок.
Рис. 3.9. Анастомоз бок в бок.
Как отмечалось выше, во многом
залог успеха выполняемого анасто-
моза зависит от соответствия диа-
метров сшиваемых сосудов (при
выполнении анастомозов конец в
конец) или соответствия диаметра
сосуда размеру артериотомического
отверстия, однако на практике час-
то приходится встречаться с проти-
воположной ситуацией. В этом слу-
чае могут быть использованы раз-
личные способы. Чаще всего при-
меняют синтетические заплаты,
вшиваемые со стороны артерии с
меньшим диаметром, в результате
чего ее диаметр увеличивается.
Литература
Андросов П. И. Механический шов в хи-
рургии сосудов. — М.: Медгиз, 1960.
Власов Г. П. Модификация сосудистого
кругового шва//Здравоохранение (Киши-
нев). - 1976. - № 6. - С. 48-49.
Демецкий A.M. Модификации кругового
шва артерии/Ддравоохр. Белоруссии. —
1976. - № 2. - С. 72-73.
Краковский И.И. Решенные и нерешен-
ные вопросы пластики магистральных со-
судов конечностей//Клин. хир. — 1971. —
№ 1. - С. 7-10.
Кривчиков Ю.Н. Техника соединения и
шунтирования кровеносных сосудов. —
Киев: Здоров'я, 1966.
Марулин Б.А. Полурастворимый протез
для замещения кровеносных сосудов//
Материалы Всесоюзн. конф. по пересадке
тканей и органов, 3-я. — Ереван, 1963. —
С. 530-531.
Махачев М.О. Модификация циркулярно-
го сосудистого шва//Экспер. хир. —
1975. - № 4. - С. 20-23.
Медведев И.А. Замещение дефекта груд-
ной аорты консервированным аорталь-
ным гомотрансплантатом: Автореф. дис...
канд. мед. наук. — М., 1953. — 22 с.
Петрова И. И Механический сосудистый
шов при пластике кровеносных сосудов//
Экспер. хир. — 1961. — № 2. - С. 41-46.
Петросян Х.А. Огнестрельные ранения с
повреждением сосудов//Госпитальное
дело. - 1945. - № 9. - С. 26-28.
Покровский А. В. Новые направления в ре-
конструктивной сосудистой хирургии//
Вестн. АМН СССР. - 1974. - № 6. -
С. 77-83.
Сапожников Е.И. Новая модификация со-
судистого шва//Хирургия. — 1946. —
№ 2.- С. 61-65.
Сычеников И.А., Абоянц Р.К., Дронов А.Ф.
и др. Коллагенопластика в медицине. —
М.: Медицина, 1978.
Сыченников И.А. Шов и пластика арте-
рий. — М.: Медицина, 1980.
Хилъкин А М., Дронов А. Ф., Шехтер А. Б. и
др. Использование полубиологических
протезов в сосудистой пластике. Пласти-
ка брюшного отдела аорты синтетически-
ми протезами, импрегнированными кол-
лагеном и желатином//Экспер. хир. —
1965. - № 1. - С. 26-30.
Хилъкин A.M., Шехтер А.Б., Истра-
нов Л.П., Леменев В.Л. Коллаген и его
применение в медицине. — М.: Медици-
на, 1976.
Шиловцев СП. Модификация сосудистого
шва//Хирургия.- 1950.- №7.- С. 70-71.
3.3. Сосудистые трансплантаты
Окклюзирующие поражения арте-
рий составляют в настоящее время
значительную часть в структуре
сердечно-сосудистых заболеваний.
Для хирургического лечения таких
поражений было предложено мно-
жество вариантов сосудистых
трансплантатов: аутовена (реверси-
рованная, in situ), вена пупочного
канатика человека, ксеноартерия,
алловена, синтетические протезы и
др. [Беличенко И.А. и др., 1980; Ка-
тельницкий И.И., 1981; Сергеева
И.А. и др., 1991; Kunlin J., 1949; Sa-
biston A., 1997]. Наиболее часто в
практике сосудистой хирургии ис-
пользуются аутовенозные транс-
плантаты и синтетические протезы.
Аутовена, впервые предложенная
для пластики сосудов почти век на-
зад (в экспериментальных работах
Carrel в 1902 г.), до настоящего вре-
мени остается «золотым стандар-
том» для реконструкции сосудов,
позволяя в ряде случаев достичь
75—90 % проходимости шунтов в
сроки до 2 лет [Беличенко И.А. и
др., 1980; Geiger G. et al., 1984; Sa-
biston A., 1997], при этом наиболее
часто в качестве трансплантата ис-
пользуют большую подкожную
вену. Показанием к выполнению
аутовенозного шунтирования чаще
всего служат окклюзионно-стено-
тические поражения бедренно-под-
коленно-тибиального сегмента, а
также поражения коронарных арте-
рий. Кроме того, аутовенозные
трансплантаты применяют при вы-
полнении операций на артериях ка-
ротидного бассейна, почечных ар-
териях, висцеральных ветвях брюш-
ной аорты и др. Перед операцией
рекомендуется предварительно ис-
следовать состояние предназначен-
ной для шунтирования аутовены с
помощью метода дуплексного ска-
нирования. Это позволяет оценить
тип строения большой подкожной
вены (магистральный, рассыпной),
ее проходимость, состояние стенки,
а также диаметр ствола вены в про-
ксимальном и дистальном отделах.
При этом использование аутовен в
качестве шунта может быть затруд-
нено при рассыпном типе их строе-
ния, варикозных изменениях стен-
ки, нарушениях проходимости, а
также диаметре вены в дистальном
отделе менее 3 мм.
Выполнение шунтирования с ис-
пользованием аутовены возможно в
двух вариантах: реверсированной
аутовеной и аутовеной in situ.
При шунтировании реверсиро-
ванной веной используют подкож-
ную вену конечности, на которой
выполняют шунтирующую опера-
цию, или вену контралатеральной
конечности. Для профилактики по-
вреждения трансплантата и его
спазма пациенту подкожно в ткани,
прилегающие к подкожной вене
вдоль ее прохождения, вводят теп-
лый раствор папаверина. Затем бо-
льшую подкожную вену выделяют
на протяжении, соответствующем
необходимой длине трансплантата.
Видимые притоки подкожной вены
перевязывают и отсекают. После
забора подкожной вены исследуют
ее целость, нагнетая в вену через
шприц теплый раствор папаверина
или гепарина. Видимые поврежде-
ния вены ушивают. Затем вену ре-
версируют, т.е. «переворачивают»
таким образом, что ее дистальный
конец располагается в области на-
ложения проксимального анасто-
моза, а проксимальный конец — в
области наложения дистального
анастомоза. После этого по приня-
той методике выполняют два ана-
стомоза между артерией и веной,
чаще всего по типу конец в бок.
Реверсированную вену с успехом
используют в качестве короткого
шунта, обеспечивая хорошие отда-
ленные результаты [Джаббаров В.В.,
1999; Haimovici H., 1982]. Сложно-
сти возникают при наложении так
называемых длинных шунтов, так
как методике шунтирования ревер-
сированной аутовеной присущ ряд
недостатков: малый калибр вены в
проксимальном отделе, который не
в состоянии обеспечить достаточ-
ный приток крови; широкий диста-
льный отдел, деформирующийся
при наложении дистального анасто-
моза; расходящаяся форма шунта,
не позволяющая обеспечить эффек-
тивный ламинарный кровоток и
приводящая к снижению скорости
кровотока в дистальных отделах
шунта. Кроме того, выделение вены
из ложа сопровождается ишемией и
холодовой травмой, что ведет к по-
следующему эндотелиальному отеку
и повреждению субэндотелиальных
структур, чему приписывается роль
в развитии различных осложнений
[Джаббаров В.В., 1999; Abbot W. et
al., 1974; Butson R. et al., 1985].
Аутовенозное шунтирование по
методике in situ позволяет избежать
гидравлического и теплового по-
вреждения вены; кроме того, вслед-
ствие равномерного сужения шунта
данный метод обеспечивает адек-
ватный кровоток и сохраняет жиз-
неспособность шунта, что обеспе-
чивает растущую популярность ме-
тода среди ангиохирургов. Впервые
вена в позиции in situ была исполь-
зована в 1959 г. канадским хирур-
гом Carrier. Среди отечественных
исследователей первым доложил о
результатах операций шунтирова-
ния артерий подвздошно-бедренно-
го сегмента подвздошной и бедрен-
ной аутовеной А.А.Шалимов в
1961 г. Первое сообщение о резуль-
татах бедренно-подколенного шун-
тирования по методике in situ с ис-
пользованием большой подкож-
ной вены в клинической практике
опубликовал Hall в 1961 г.
Методика операции аутовенозно-
го шунтирования in situ. Выполняют
доступ к артериальным стволам в
области наложения проксимально-
го анастомоза. Подкожную вену
выделяют в этой области на протя-
жении около 5 см, чтобы ею можно
было свободно манипулировать.
Вену отсекают, проксимальную
часть прошивают, а на дистальную
накладывают атравматический мяг-
кий зажим Де Бейки. Затем выделя-
ют артерии в области наложения
дистального анастомоза (подколен-
ная или тибиальная), проводят их
ревизию, определяют место диста-
льного анастомоза. Дистальный ко-
нец вены также выделяют на протя-
жении около 5 см, дистальный ко-
нец вены прошивают, на проксима-
льный накладывают атравматиче-
ский зажим.
Через дистальный отдел подкож-
ной вены вводят венотом соответ-
ствующего размера, который про-
двигают до проксимального участка
вены. После этого венотом медлен-
но, осторожно проводят в дисталь-
ном направлении к дистальному от-
резку подкожной вены. Когда вено-
том входит в каждый клапан и ис-
секает створки, ощущается сопро-
тивление. Эту манипуляцию повто-
ряют 2—3 раза до исчезновения
ощущения сопротивления; это кос-
венно подтверждает, что створки
клапанов иссечены. Венотом извле-
кают из дистального отрезка под-
кожной вены.
Вначале накладывают проксима-
льный анастомоз атравматической
иглой 5/0 в предварительно пере-
жатую бедренную артерию, после
чего производят пробный пуск кро-
вотока. При адекватном кровотоке
по аутовенозному шунту наклады-
вают дистальный анастомоз с вы-
бранным участком артерии, предва-
рительно оценив ретроградный
кровоток из дистального участка
артерии. На основании доопераци-
онного (ультразвукового) или инт-
раоперационного картирования
ветвей подкожной вены их перевя-
зывают через отдельные небольшие
разрезы. Притоки перевязывают от
наиболее проксимальных отделов
вены к дистальным под контролем
интраоперационной флоуметрии.
Оптимальным показателем объем-
ной скорости кровотока по шунту
считается значение не менее 120
мл/мин. Следует перевязывать мак-
симальное число ветвей большой
подкожной вены с целью устране-
ния артериовенозного сброса при
проходимых артериях голени. При
поражения «путей оттока» следует
сохранять боковые ветви в области
дистального анастомоза с целью
формирования артериовенозного
сброса (т.е. «разгрузки» шунта).
Аутовены используют для рекон-
струкции как периферических, так
и коронарных артерий. Одно из до-
стоинств использования аутовен —
отсутствие тканевой несовместимо-
сти. Однако имеются указания на
возможность структурных измене-
ний стенки аутовены в условиях
повышенной гемодинамической
нагрузки. Аутовенозные трансплан-
таты могут подвергаться аневризма-
тической дегенерации и даже ате-
росклеротической окклюзии [Пи-
ченников А.П., 1983; Abbot W. et
al., 1974]. В то же время у 20-30 %
пациентов использование аутовены
для артериальной реконструкции
невозможно из-за тонких вен, рас-
сыпного типа строения вен, заболе-
ваний вен (флебиты, варикозное
расширение), предшествующего
удаления вен. Применение аутове-
ны также не всегда возможно в ур-
гентных ситуациях, требующих
максимального сокращения време-
ни операции. Общепринятой аль-
тернативой во всех этих случаях яв-
ляется использование синтетиче-
ских протезов; эти протезы служат
также основным пластическим ма-
териалом при выполнении реконст-
руктивных операций на крупных
сосудах — аорте, подвздошных ар-
териях.
К современным синтетическим
протезам, используемым в сосуди-
стой хирургии, предъявляется ряд
требований:
• во-первых, протезы должны
быть изготовлены из химически
нейтрального синтетического во-
локна, не вызывающего выражен-
ной местной реакции тканей;
• во-вторых, сосудистый протез
должен быть проницаемым для жи-
вых тканей и в то же время прони-
цаемость (порозность) стенки сосу-
дистого протеза должна быть такой,
чтобы кровопотеря при импланта-
ции была минимальной;
• в-третьих, сосудистый протез
должен обладать механическими
свойствами, обеспечивающими
наиболее выгодные условия крово-
тока по протезу;
• в-четвертых, протез должен лег-
ко стерилизоваться и быть простым
в обращении [Лебедев Л.В. и др.,
1981].
В настоящее время известны три
основных типа протезов из синте-
тических материалов: вязаные, тка-
ные, плетеные.
Положительными качествами вя-
заных сосудистых протезов являют-
ся их значительная эластичность и
гибкость. При разрезании такого
протеза не происходит разлохмачи-
вания краев, однако при включе-
нии таких протезов в кровоток че-
рез их стенку происходит значите-
льное кровотечение, которое не
предотвращает даже предваритель-
ное пропитывание протеза кровью
больного (praeclotting).
Основное преимущество тканого
протеза — небольшая кровопотеря
при его применении вследствие
низкой проницаемости стенки про-
теза. Существенным недостатком
является их ригидность и жесткость.
Протезы плетеной конструкции
занимают промежуточное положе-
ние между ткаными и плетеными.
При их применении отмечается не-
большая кровопотеря при имплан-
тации, они эластичны и растяжимы
в продольном и поперечном на-
правлениях.
Широко разрабатывается пробле-
ма химической модификации син-
тетических протезов, в том числе
обработка их различными соедине-
ниями, улучшающими свойства
протезов. Достаточно распростра-
ненными являются желатинизиро-
ванные протезы. Обработка проте-
зов желатином улучшает их биоме-
ханические свойства, снижает по-
розность, улучшает характеристики
внутренней поверхности протеза.
Кроме того, в состав протезов часто
включают гепарин и антибиотики
для предупреждения тромбообразо-
вания и развития инфекционных
осложнений. Эти средства исполь-
зуют в протезах на специальных но-
сителях, препятствующих их быст-
рому «вымыванию» в системный
кровоток.
Перспективна также обработка
внутренней поверхности протезов
гидрогелями, в которые могут быть
добавлены различные вещества, в
том числе антибиотики и гепарин.
Гидрогели способствуют повыше-
нию тромборезистентности проте-
зов и обеспечивают длительное су-
ществование высоких концентра-
ций включенных в них веществ.
Новым направлением являются
попытки биологической модифика-
ции внутренней поверхности син-
тетических протезов, в частности
покрытия поверхности слоем эндо-
телиальных клеток. Эти работы на-
ходятся на стадии эксперименталь-
ных исследований.
Наибольшую популярность при-
обрели синтетические протезы из
политетрафторэтилена (PTFE) —
«Гортекс», «Витафлон». Для них ха-
рактерны высокая пористость, гиб-
кость, подвижность, прочность, вы-
раженная биологическая инерт-
ность. Несмотря на наличие много-
численных пор, стенка протеза не-
проницаема для крови (нулевая хи-
рургическая порозность) и в то же
время доступна для прорастания
тканями организма. Такие протезы
могут быть использованы для ре-
конструкции артерий различных
диаметров [Покровский А.В. и др.,
1997].
Следует подчеркнуть, что наибо-
лее успешно синтетические проте-
зы могут быть использованы только
для реконструкции сосудов боль-
шого диаметра (аорта, подвздош-
ные артерии). Результаты их испо-
льзования при реконструкции сосу-
дов среднего и малого диаметра
значительно хуже.
Особое место занимают разраба-
тываемые в последние годы стенты
и эндопротезы. Стенты, изготавли-
ваемые из нитинола (металла с «за-
поминающими» свойствами), при
эндоваскулярном введении в пора-
женную артерию способны модели-
ровать ее просвет и прочно удержи-
ваться в нужном месте в течение
длительного времени. Сочетание
стентирования с использованием
эндопротезов улучшает результаты
операции. Применение метода во
многом ограничено его высокой
стоимостью.
Неудовлетворительные результа-
ты применения синтетических про-
тезов при отсутствии возможности
использования аутовены вели к не-
обходимости поиска подходящего
материала для шунтирующих опе-
раций. В 1960 г. Barner, DeWeese и
Schenk высказали идею о возмож-
ном длительном сохранении и ис-
пользовании венозных аллопроте-
зов. Существуют различные подхо-
ды к проблеме консервации алло-
вен. Были предложены методы их
сохранения в растворах альдегидов
(формалин, глутаральдегид), способ
обработки ферментами. Такие спо-
собы не сохраняют жизнеспособ-
ность алловены, поддерживая тем
не менее на необходимом уровне ее
биомеханические свойства, кото-
рые, по мнению ряда авторов, яв-
ляются основными факторами в
оценке пригодности сосудистых
трансплантатов. Сохранения жиз-
неспособности ткани можно до-
стичь за счет обратимой остановки
клеточного метаболизма при замо-
раживании ткани [Abbott W. et al.,
1974; Sabiston A., 1997].
Внедрение криотехники открыло
возможность длительного сохране-
ния жизнеспособных донорских
вен при сверхнизких температурах
(до —196 °С в присутствии крио-
протекторов) без существенного
повреждения элементов венозной
стенки. При этом возможно созда-
ние банка вен, содержащего раз-
личные образцы венозных алло-
трансплантатов, полностью подго-
товленных к использованию для ре-
конструктивных сосудистых опера-
ций. Первые клинические экспери-
менты применения криовен в соче-
тании с применением низких доз
иммуносупрессоров показали луч-
шие результаты, чем при использо-
вании синтетических протезов [Фе-
ренц Ю.С., 1986; Sabiston А., 1997].
С середины 70-х годов ряд авто-
ров сделали попытку использовать
для обходного шунтирования ок-
клюзии артерий нижних конечно-
стей вену пуповины. Однако ре-
зультаты были неудовлетворитель-
ными вследствие большого процен-
та тромбозов пуповинной вены.
Чрезмерная толщина стенки пупо-
винной вены является одним из ее
недостатков и вызывает техниче-
ские сложности при выполнении
анастомозов артерий с относитель-
но более плотным и менее эластич-
ным пластическим материалом. Во
всех случаях между пуповинной ве-
ной и артерией необходимо было
использовать аутовенозную встав-
ку, что также отрицательно сказы-
валось на результате [Беличенко
И.А. и др., 1980; Лукьянов Ю.В.,
1983; Андреев И.Б. и др., 1985]. В
настоящее время интерес к исполь-
зованию пуповинной вены заметно
угас.
Крупным направлением поиска
новых пластических материалов
явилось исследование возможности
применения ксенотрансплантатов,
прежде всего ксеногенных артерий.
«Свежие» ксенотрансплантаты в
эксперименте были испытаны
А.И.Морозовой (1909); впоследст-
вии были предложены различные
методы консервации ксеноартерий.
Непосредственные результаты при-
менения ксенотрансплантатов вна-
чале были обнадеживающими, од-
нако с увеличением сроков наблю-
дения выяснилось, что консерва-
ция любым способом ненадолго
продлевает «жизнь» ксеногенных
артерий: местная реакция всегда
была выражена, тромбозы и анев-
ризматические дегенерации встре-
чались в большом проценте слу-
чаев.
Из используемых в настоящее
время ксенопротезов следует отме-
тить кемеровский, получаемый из
внутренней грудной артерии круп-
ного рогатого скота. Новизна про-
теза состоит в том, что в отличие от
других ксенопротезов при его под-
готовке используют не альдегиды, а
эпоксисоединения, что, по мнению
авторов, существенно улучшает его
свойства. Несмотря на то что при
использовании ксенотранспланта-
тов в клинике для реконструкции
крупных сосудов получен ряд поло-
жительных результатов, большинст-
во хирургов с осторожностью отно-
сятся к возможности применения
ксенотрансплантатов в клиниче-
ской практике.
Таким образом, в настоящее вре-
мя предпочтение отдают аутовеноз-
ным трансплантатам, а в случае не-
возможности их применения —
синтетическим протезам, хотя по-
иски оптимального пластического
сосудистого материала постоянно
продолжаются.
Литература
Андреев И. Б., Мойсюк Я.Г., Попов В.А.
Модифицированные методики приготов-
ления биопротезов различного назначе-
ния из вены пупочного канатика челове-
ка//Хирургия.- 1985,- № 6.- С. 68-73.
Беличенко И.А., Кунгурцев В.В., Шиман-
ко А.И. Возможности применения вены
пупочного канатика в реконструктивной
хирургии артерий нижних конечностей//
Хирургия. - 1980. - № 8. - С. 8-11.
Джаббаров В. В. Аутовенозное шунтирова-
ние по методике in situ в реконструктив-
ной хирургии сосудов нижних конечно-
стей: Автореф. дис.... канд. мед. наук. —
М., 1999. - 24 с.
Кателъницкий И. И. Консервирование и
аллотрансплантация артерий с примене-
нием щадящей иммуносупрессии: Авто-
реф. дис.... канд. мед. наук.— М., 1981.—
14 с.
Лебедев Л.В., Плоткин Л.Л., Смирнов А.Д.
Протезы кровеносных сосудов. — Л.: Ме-
дицина, 1981. - 190 с.
Лукьянов Ю.В. Применение вены пупови-
ны человека для пластики артерий: Авто-
реф. дис.... канд. мед. наук.— Л., 1983.—
16 с.
Пшенников А. П. Судьба аутовенозного
трансплантата после пересадки в артериа-
льное русло//Экстренная хирургия сосу-
дов. — Ярославль, 1983. — С. 118—125.
Сергеева П.А., Макарова Л.Д., Булыче-
ва И. В. и др. К вопросу о применении ве-
нозных аллотрансплантатов в сосудистой
хирургии//Бюлл. экспер. биол. и мед. —
1991. - Т. 61, № 3. - С. 330-332.
Ференц Ю.С. Консервация и пластика со-
судов малого диаметра: Автореф. дис....
канд. мед. наук. — М., 1986. — 22 с.
Шалимов А.А. Замена и шунтирование пе-
риферических магистральных артерий од-
ноименной собственной веной без выде-
ления ее из ложа//Вестн. хир. — 1961. —
Т. 87. - С. 44-49.
Abbot W. et al. Structural changes during
preservation of autogenous venous graft//
Surgery.- 1974.- Vol. 76.- P. 1031-1038.
Butson R., Sattinrar V. Nonreversed and in
situ vein grafts//Ann. Surg. — 1985. — Vol.
51. - P. 771-779.
Geiger G. et al. Vascular grafts in below-knee
femoro-popliteal bypass//J. Cardiovasc.
Surg. - 1984. - Vol. 25. - P. 523-529.
Haimovici H. Ideal arterial graft//Surgery. —
1982. -Vol. 92. - P. 117-119.
Hall K. The great saphenous vein used in situ
as an arterial shunt after extirpation of the
vein valves//Surgery. — 1961. — Vol. 51. —
P. 492-495.
Kunlin J. Le traitement d'arterite obliterante
par la greffe veneuse//Arch. Mai. Coeur. —
1949. - Vol. 42. - P. 371-375.
Sabiston A. The biological basis of modem
surgical practice. — W.B.Saunders Company,
1997. - P. 203-218.
3.4. Интраоперационный контроль качества
сосудистых реконструкций
Основой успеха в ангиохирургии
являются правильный выбор пока-
заний к операции, определение
объема реконструктивного вмеша-
тельства у каждого конкретного бо-
льного, а главное — тщательность и
прецизионная техника исполнения
каждой реконструкции.
Современная ангиохирургия уже
не довольствуется достижением хо-
роших ближайших результатов опе-
рации (проходимость и клиниче-
ский эффект). Огромное внимание
также уделяется улучшению отда-
ленных хирургических результа-
тов — снижению частоты рестено-
зов, увеличению сроков проходи-
мости шунтов. Постоянно ведется
поиск факторов, влияющих на по-
вышение этих показателей.
Любая ангиохирургическая опе-
рация не защищена от технических
ошибок, которые могут быть связа-
ны с опытом хирурга, его теорети-
ческой и практической подготов-
кой, а также могут явиться следст-
вием ряда предсказуемых, но не
очевидных причин, гарантированно
избежать которых не может ни
один даже опытный специалист.
Причинами осложнений опера-
ции могут стать неадекватный объ-
ем реваскуляризующего вмешатель-
ства, некачественный сосудистый
шов, скрытые от глаз внутрисосу-
дистые факторы (например, от-
слойка и флотирование интимы,
пристеночные тромбы, перегиб или
избыточная длина шунта и т.д.).
В последующем это нередко приво-
дит к необходимости повторных
вмешательств.
Завершая основной этап опера-
ции, хирург, помимо визуальной
оценки, всегда имеет возможность
пальпаторно выявить технические
погрешности вмешательства. Сис-
толическое дрожание в зоне анасто-
моза или ослабление пульсации ди-
стальнее анастомоза позволяет с
большой долей вероятности гово-
рить о грубых технических ошиб-
ках.
Проконтролировать адекватную
проходимость и отсутствие значи-
мых препятствий кровотоку помо-
гают введение через анастомоз спе-
циальных бужей нужного диаметра,
а также контроль антеградного и
ретроградного кровотока.
Главными техническими факто-
рами, ухудшающими ближайшие и
отдаленные результаты операции,
являются:
• резидуальные стенозы, т.е. не-
удаленные бляшки, значительные
деформации контуров анастомоза
или просвета сосуда (например, его
чрезмерное подтягивание анасто-
мозом);
• чрезмерное расширение сосуда в
результате пластики (например, за-
платой);
• флотирующие участки интимы
или ее отслойка на границе эндар-
терэктомии, а также на линии ана-
стомоза; разрывы и отслойка инти-
мы в месте наложения зажимов;
• нарушения хода сосудистых про-
тезов, их перегибы, перекрут и т.д.;
• эмболия артериального русла и
окклюзия артериальной магистрали
дистальнее зоны реконструкции.
Зачастую их невозможно выявить
без специальных технических мето-
дов, однако практически всегда
можно и нужно устранять. К разде-
лам ангиохирургии, где специаль-
ный контроль качества может
иметь важное значение, относятся
реконструкции сонных артерий,
висцеральных ветвей аорты, рева-
скуляризации артерий конечностей
(иногда и при реконструктивных
вмешательствах на венозных маги-
стралях конечностей).
В данной главе рассматриваются
наиболее часто используемые в
клинической практике методы инт-
раоперационного определения ка-
чества выполненного вмешатель-
ства.
Интраоперационная ангиография.
Метод применяют для визуализа-
ции просвета и проходимости ре-
конструированных артерий и шун-
тов (протезов сосудов), конфигура-
ции анастомозов. Критерии оценки
те же, что и при дооперационной
ангиографии.
Как правило, используют пере-
носной рентгеновский аппарат и
кассету с пленкой (при отсутствии
приспособленного к ангиографии
операционного стола кассету обо-
рачивают стерильным материалом
или вкладывают в стерильный па-
кет). Применяют также специаль-
ные интраоперационные цифровые
ангиографические установки.
Обычно достаточно одной арте-
риограммы в одной выбранной
проекции нужного сегмента. Метод
введения контрастного вещества
может быть пункционным; можно
вводить его и через катетер, уста-
новленный в одной из ветвей сосу-
да. Например, при артериографии
уровня дистального анастомоза
аутовенозного бедренно-подколен-
ного шунта катетер вводят через
один из заведомо не перевязанных
притоков вены. Другой пример: по-
сле каротидной эндартерэктомии
катетер вводят через верхнещито-
видную артерию в общую сонную
артерию. Каротидную ангиографию
выполняют без пережатия арте-
рий — на кровотоке, тогда как при
артериографии конечностей можно
вводить раствор контрастного ве-
щества при наложении зажима про-
ксимальнее места введения контра-
ста. Для исследования используют
от 6—10 мл (каротидная артерио-
графия) до 20—25 мл неионного
контрастного средства. По данным
различных исследователей, интра-
операционная ангиография увели-
чивает время операции незначи-
тельно: при достаточном опыте она
занимает до 3—5 мин. Среди ангио-
хирургов методика находит как
убежденных сторонников повсед-
невного ее применения при указан-
ных выше операциях, так и привер-
женцев использования этой «до-
полнительной инвазии» лишь при
явных сомнениях в качестве выпол-
ненной реконструкции.
Осложнениями интраоперацион-
ной ангиографии могут быть мик-
роэмболии в дистальное русло (это
является важным обстоятельством
при манипуляциях на сонных арте-
риях), а также отслойка интимы в
месте пункции. Ограничивать ис-
пользование этой процедуры могут
индивидуальная непереносимость
контрастных препаратов и выра-
женные нарушения функции по-
чек.
Интраоперационная ангиоскопия.
В современных условиях, как пра-
вило, применяют различные техни-
ческие разновидности видеоангио-
скопии. Метод является более
травматичным для сосудистой
стенки, требует выключения кро-
вотока по сосуду на время исследо-
вания, дополнительного введения
перфузионных растворов и нужда-
ется в разрезе артерии или протеза
длиной 2,5—3,5 мм для введения
волоконно-оптического ангиоско-
па или непосредственно видеока-
меры.
Создание дополнительной арте-
риотомии само по себе нежелатель-
но, а введение оптического устрой-
ства через анастомоз до его оконча-
тельного формирования значитель-
но снижает информативность ис-
следования. Это, однако, может
рассматриваться и как преимущест-
во ангиоскопии перед остальными
методами контроля, так как конт-
роль возможен во время и после
окончания пластики сосудов, сле-
довательно, устранение обнаружен-
ных дефектов осуществить намного
легче.
Методом ангиоскопии с наиболь-
шей точностью можно выявлять от-
слойку и флотацию интимы, хоро-
шо выявляются резидуальные сте-
нозы, однако методика требует хо-
роших практических навыков, а
также умения правильно интерпре-
тировать ангиоскопическую карти-
ну.
С ангиоскопическим контролем
может быть связано и некоторое
повышение числа осложнений, в
том числе инфекционных, поэтому
следует стараться соблюдать неко-
торые условные показания к ее
применению:
• контроль за качеством эндар-
терэктомии при невозможности
адекватного визульного контроля
(например, полузакрытая или ульт-
развуковая эндартерэктомия);
• контроль за качеством тромбэк-
томии из сосудистых эксплантатов;
• контроль за качеством вальву-
лотомии при операциях in situ, a
также необходимость прицельного
выделения и лигирования притоков
вены;
• исследование анастомозов при
повторных операциях для уточне-
ния показаний к их реконструкции.
Интраоперационная ультразвуко-
вая допплерография. Ультразвуко-
вые приборы с непрерывным излу-
чением являются самыми простыми
и интраоперационно позволяют
дать быструю оценку проходимости
сосудов, а выраженные сдвиги в
слышимых допплеровских частотах
могут указывать на наличие стено-
тического, резидуального пораже-
ния, недостаточной вальвулотомии,
оставшихся не перевязанными вет-
вями вены in situ и т.д. При этом
субъективная оценка позволяет
лишь высказать предположение о
каких-либо патологических измене-
ниях.
В отличие от первых высокочас-
тотные импульсные допплерографы
со спектральным анализом потока
позволяют дать количественную и
качественную оценку изменений
потока в любом доступном для
установки датчика сегменте сосуда.
Локальное повышение пиковой си-
столической скорости и расшире-
ние спектра связаны с уменьшени-
ем диаметра сосуда (стенозом). Для
интраоперационной диагностики
технических ошибок, нарушающих
ламинарный поток крови, особенно
локальных изменений (резидуаль-
ные стенозы артерий, стенозы или
расширения анастомозов, значите-
льная флотация или отслойка инти-
мы), метод признан достаточно
чувствительным и специфичным.
Дата добавления: 2015-02-06 | Просмотры: 1392 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
|









