|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Диагностика парапротезной инфекцииПри диагностике ППИ прежде всего приходится отвечать на следующие вопросы, влияющие на лечебную тактику и прогноз заболевания: • инфекционным или асептическим является воспалительный процесс; • имеется ли связь гнойного процесса с зоной сосудистого протеза и какова распространенность гнойного процесса по протезу, вовлечены ли анастомозы в гнойный процесс;
• сохранена ли функция протеза и насколько адекватно восстановлено кровообращение в конечности; • каково состояние окружающих протез тканей; • имеются ли эндоваскулярное инфицирование и бактериемия. Несмотря на кажущуюся простоту, диагноз ППИ почти всегда неоднозначен. В ранние сроки после имплантации приходится дифференцировать ППИ от поверхностного нагноения раны, парапротезной гематомы и скопления серозной жидкости, лимфореи. В позднем послеоперационном периоде под маской гнойного осложнения иногда может протекать острая или хроническая реакция отторжения имплантата (так называемый агрессивный гранулематоз, или псевдоинфекция) или специфическая иммунная реакция организма на ксеноматериал, продукты его деградации в тканях. Как правило, во всех этих случаях присутствуют классические клинические признаки воспаления (dolor, color, rubor, tumor et functio laesa) либо свищ с интактным гноеподобным отделяемым. Выявление в тканях или экссудате, полученном из зоны имплантата микроорганизмов, дает формальный повод для установления диагноза ППИ. В значительном числе случаев первым или единственным проявлением инфекции становятся общие или местные осложнения. Согласно результатам согласительной конференции в Чикаго, которые в последние годы находят все более широкое признание в нашей стране, в качестве основных диагностических критериев сепсиса приняты следующие симптомы: синдром системной воспалительной реакции (температура тела свыше 38 °С или ниже 36 °С, тахикардия более 90 в 1 мин, лейкоцитоз более 12 • 109/л, лейкопения менее 4 • 109/л или сдвиг формулы крови влево (>10 % палоч-коядерных нейтрофилов) на фоне выявленного очага инфекции.
Таким образом, наличие очага ППИ в сочетании с соответствующими общими проявлениями позволяет установить диагноз сепсиса у значительной части больных с гнойными осложнениями после ангиохирурги-ческих операций. Другим характерным признаком ППИ является нарушение функции эндопротеза, связанное с поражением окружающих имплантат тканей хроническим инфекционным процессом. Наиболее грозное осложнение ППИ — кровотечение из зоны анастомозов на фоне ложной аневризмы или формирование аортоки-шечной фистулы. Ранняя диагностика этих состояний крайне затруднена, а летальность при аортокишечных свищах приближается к 100 %.
Бактериологическое исследование традиционно считается основным для установления диагноза ППИ. Следует, однако, учитывать, что, с одной стороны, частота ложноположитель-ных результатов достигает 5—7 %, а с другой — высеваемость низковирулентных штаммов стафилококка при использовании стандартных методик не превышает 70 %, особенно при отсутствии явлений острого воспаления (рис. 6.70). В наших наблюдениях в 13,2 % случаев, несмотря на наличие явных клинических признаков нагноения, роста микрофлоры на стандартных питательных средах не было обнаружено. Повысить частоту обнаружения микроорганизмов при ППИ удается путем использования in vitro ультразвуковой кавитации материала перед высеванием на питательную среду [Padberg E.T.Jr., 1992]. При этом происходят разрушение гликокаликса и дезинтеграция колоний микроорганизмов. Лабораторные данные. Данные лабораторных методов исследования играют второстепенную роль в диагностике ППИ из-за их низкой специфичности. При клиническом анализе крови лейкоцитоз свыше 10 • 109/л наблюдался у 46,2 % больных, коррелируя в первую очередь с выраженностью клинической картины острого воспаления. Лейкоцитарный индекс интоксикации и индекс сдвига формулы нейтрофилов у больных с поверхностным инфицированием ран и инфицированием трансплантатов также не различаются. До настоящего времени не разработаны информативные специфичные иммунологические тесты для диагностики ППИ. Изучение местного иммунитета в клинических условиях затруднено в связи со сложностью забора материала, однако результаты экспериментальных исследований и интраоперационные данные не позволяют выявить достоверных признаков специфичной иммунной реакции при развитии ППИ. Ультразвуковые методы исследования. Наиболее распространенным не-инвазивным методом оценки структурных изменений в тканях на сегодняшний день является ультрасоно-графия. Метод позволяет с высокой степенью достоверности обнаружить гипоэхогенные зоны, выявить и оценить изменения структуры перипро-тезных тканей, провести первичную дифференциальную диагностику послеоперационных гематом, скоплений серозной жидкости и нагноения. Наличие в зоне протеза участка по-
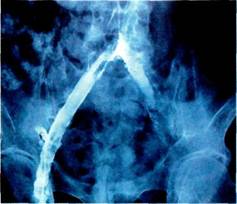
Рис. 6.71. Гипоэхогенное образование (абсцесс) вокруг проходимого бедрен-но-подколенного протеза. ниженнои эхоплотности, окруженного зоной инфильтрации тканей, служит достаточным основанием для предположения диагноза ППИ. Обнаружение пузырьков газа более чем через 3 нед после операции еще более повышает достоверность исследования. Наиболее эффективным является сочетание ультрасонографических находок с результатами микробиологического и цитологического исследования пунктата, полученного под контролем УЗИ. В то же время в ранние сроки после операции обнаруживаемые при УЗИ гипоэхогенные скопления в зоне протеза могут быть обусловлены гематомой, что несколько снижает специфичность исследования. Ультразвуковое сканирование мягких тканей в сочетании с дуплексным сканированием позволяет получить максимум информации о состоянии и функции протеза, наличии перипротезных скоплений жидкости, формировании ложных аневризм анастомозов (рис. 6.71). Рентгенологические методы исследования. При наличии гнойных свищей весьма информативным методом исследования является фистулогра-фия с водорастворимыми контрастными препаратами. Распространение контрастного вещества по ходу протеза является достоверным признаком вовлечения этой зоны в гной- ный процесс (рис. 6.72). В то же время отсутствие контрастирования того или иного участка протеза не является поводом для исключения диагноза ППИ. В ряде случаев при фистулографии удается выявить и другие состояния, сопровождающие парапротезную инфекцию. Так, например, у больной, перенесшей протезирование брахиоцефального ствола по поводу злокачественной хемо-дектомы, по данным рентгеноконт-растной фистулографии был диагностирован бронхиальный свищ, не связанный с протезом.
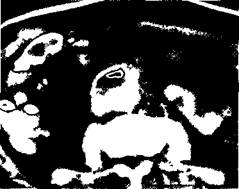
Рис. 6.72. Распространение контрастного вещества вдоль аортобифеморального протеза при фистулографии. Рентгеноконтрастная фистулогра-фия является достаточно надежным методом дифференциальной диагностики ППИ с поверхностными формами нагноения послеоперационной раны и лигатурными свищами. На сегодняшний день одним из наиболее информативных методов диагностики ППИ является компьютерная томография. Достоверные КТ-признаки инфекции — инфиль-тративные изменения окружающих тканей, скопление жидкости и газа вокруг протеза. Наличие пузырьков газа в просвете тромбированного протеза с высокой достоверностью позволяет установить диагноз инфекции. Следует, однако, отметить, что эти симптомы представляют диагностическую ценность лишь в поздние сроки после операции, так как в ранние сроки после нее небольшие скопления жидкости вокруг имплан-тата определяются и при неослож-ненном течении. Спиральная компьютерная томография с внутривенным болюсным контрастированием позволяет оценить проходимость протеза, наличие пристеночных тромбов. В паренхиматозной фазе контрастирования повышенное накопление контрастного вещества в перипротезных тка-
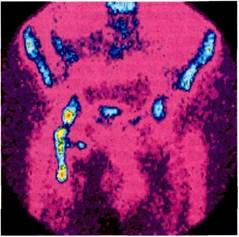
Рис. 6.73. Парапротезное скопление жидкости с пузырьком газа в области проксимального анастомоза после аорто-бифеморального шунтирования. нях позволяет более четко дифференцировать скопление жидкости и инфильтративные изменения тканей (рис. 6.73). Спиральная компьютерная томография также имеет большую ценность для определения состояния протеза — его анатомической локализации, а также изменений, развивающихся вследствие ППИ, например ложной аневризмы анастомозов и тромбоза шунта. Радионуклидные методы исследования. Радиоизотопная сцинтигра-фия, традиционно используемая для обнаружения очагов воспаления, значительно превосходит по чувствительности другие методы исследования. В то же время специфичность сканирования с наиболее часто используемыми изотопами (99Тс, 111In, 67Ga и др.) по отношению к вялотекущему гнойному процессу невелика — около 40 %. Повышенное накопление радиофармпрепарата (РФП) отмечается при таких состояниях, как консолидирующиеся переломы, опухоли и различные варианты асептического воспаления. После эндопро-тезирования тазобедренного сустава небольшое повышение накопления РФП происходит в течение 1—2 лет при неосложненном течении. С конца 70-х годов для обнаружения очагов инфекции и дифференциальной диагностики хронического гнойного процесса и неинфекционного воспаления все шире используют аутологичные лейкоциты больного, меченные радиоизотопами. В настоящее время для этой цели наиболее часто применяют 111In и 99Тс, обладающие сходной фармакодинамикой и сравнимыми диагностическими показателями. Сцинтиграфия с мечеными лейкоцитами является одним из наиболее информативных методов диагностики ППИ. Методика включает ряд последовательных этапов: • забор крови из периферической вены; • выделение аутолейкоцитов больного, определение их числа и жизнеспособности; • приготовление препарата 99mTc_ НМРАО; • мечение лейкоцитов; • внутривенное введение культуры меченых лейкоцитов; • сцинтиграфическое полипозиционное исследование через 1, 3 и при необходимости через 6—12—24 ч после введения. При оценке сцинтиграмм считают, что картина, полученная в течение первого часа, отражает сосудистую фазу распределения РФП. Участки повышенного накопления препарата вне проекции крупных сосудов, печени, почек, селезенки и мочевого пузыря принято считать соответствующими очагам острого воспаления (рис. 6.74). Через 3—4 ч после введения нормальное распределение меченых аутолейкоцитов соответствует проекции почек, мочевого пузыря и костей скелета. Выявление в этот период участков повышенного накопления РФП вне зон нормального распределения соответствует очагам хронического воспаления. В качестве критериев диагноза используют визуальную оценку сцинтиграмм, кривые распределения радиофармпрепарата по времени, а также количественную оценку степени накопления изотопа в тканях в процентах по отношению к симметричному участку тела. Метод обладает чрезвычайно высокой чувствительностью (90—98 %), однако его специфичность не так высока (60—70%). Ложноположитель-ные результаты наблюдаются главным образом в ранние сроки после операции при наличии парапротезной гематомы, активных регенераторных процессах в окружающих тканях, а также при различных вариантах асептического воспаления (реакции отторжения имплантата). В нашей стране использование этой методики долгое время было ограничено от-
Рис. 6.74. Сцинтиграмма больного через 3 ч после введения аутолейкоцитов, меченных 99mТс. Отмечается повышенное накопление радиофармпрепарата в области подвздошно-бедренного протеза. сутствием доступного препарата НМРАО и высокой стоимостью коммерческого препарата ceretec (фирмы "Amersham plc".). Однако в последние годы в ГНЦ "Институт биофизики" разработан отечественный препарат теоксим, по своим фарма-кокинетическим параметрам не уступающий зарубежному аналогу. Таким образом, открываются новые возможности для работы в этом направлении. Цитологическое исследование отделяемого из зоны протеза позволяет уточнить характер воспалительного процесса. Преобладание в материале нейтрофильных лейкоцитов может свидетельствовать об остром инфекционном характере процессов, в то время как наличие макрофагов, лимфоцитов и многоядерных клеток более характерно для асептических или хронических форм воспаления. Таким образом, диагноз параэндо-протезной инфекции в ряде случаев устанавливается на основании комплекса критериев и требует от лечащего врача большой ответственности и клинического мышления. Дата добавления: 2015-02-06 | Просмотры: 1530 | Нарушение авторских прав |