|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
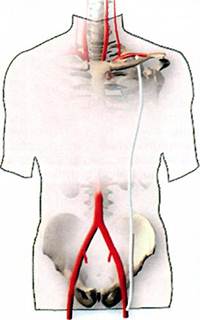
Тактика лечения парапротезной инфекцииНеутешительные результаты лечения парапротезной инфекции, высокая летальность и частота ампутаций конечности заставляют хирургов искать новые пути профилактики и лечения этого грозного осложнения. До настоящего времени не выработано единой обоснованной тактики при различных формах ППИ. При нагноении вокруг синтетических протезов консервативное лечение (или так называемая активно-выжидательная тактика), как правило, не приводит к купированию воспаления и чревато развитием кровотечения из зоны анастомозов или тромбоза протеза. Практически все авторы считают ППИ абсолютным показанием к хирургическому лечению, однако объем предлагаемого хирургического вмешательства варьирует от резекции и замены инфицированного участка протеза ауто-, го-мо- или ксеноматериалом in situ до тотального удаления протеза во всех случаях инфекции с обходным экстраанатомическим шунтированием. С учетом современных принципов ключевым звеном комплексного лечения раневой инфекции является радикальная хирургическая обработка гнойного очага. По отношению к ППИ это означает широкое рассечение всех обнаруженных "карманов". Вмешательство должно заключаться в полном удалении всех воспаленных и рубцово-измененных мягких тканей. Целесообразно применение таких дополнительных физических методов обработки, как низкочастотная ультразвуковая обработка раны и обнаженного участка протеза через растворы антибиотиков или антисептиков, или обработка раны пульсирующей струей антибактериальных препаратов. Помимо дополнительной механической очистки и удаления с поверхности протеза биопленки, содержащей микроорганизмы, это способствует активизации микроцирку- ляции, а также позволяет создать в поверхностном слое тканей и протеза значительную концентрацию антибактериального препарата. Всем больным показаны парентеральная антибактериальная терапия с учетом чувствительности микрофлоры, ан-тикоагулянтная и антиагрегантная терапия. Вопрос о судьбе инфицированного протеза должен решаться в каждом случае индивидуально в зависимости от распространенности гнойного процесса, адекватности функции шунта, степени изменений окружающих тканей, а также общего состояния пациента и характера сопутствующих заболеваний. Рассмотрим положительные и отрицательные стороны различных вариантов хирургической тактики. Удаление протеза без одномоментного повторного протезирования производят в случае тромбоза инфицированного трансплантата и отсутствия критической ишемии конечности. Важным является тотальное удаление всего протеза, так как, по нашему мнению, это не только позволяет более надежно справиться с гнойным осложнением, но и снижает риск инфекции при повторных отсроченных вмешательствах в этой зоне. Если необходима пластика зоны проксимального анастомоза, используют заплаты из аутовены. При удалении инфицированного аортального протеза аорту ушивают двойным швом и укрывают прядью сальника или предпозвоночной фасцией. Исключение составляют случаи, когда вторичное инфицирование протеза происходило в результате нагноения раны культи бедра после ампутации по поводу тромбоза бранши аортоби-феморального протеза. Полное удаление инфицированной бранши протеза позволило сохранить единственную конечность 4 пациентам. В одном случае распространение гнойного процесса на вторую браншу привело к необходимости тотального удаления протеза с подмышечно-бедрен-ным обходным шунтированием. Повторная реконструктивная операция после купирования инфекции сопряжена с повышенным риском рецидива нагноения и должна выполняться в отсроченном периоде по строгим показаниям. В этих случаях вопросам профилактики инфекции должно быть уделено самое пристальное внимание. Удаление инфицированного протеза с обходным экстраанатомическим шунтированием применяют с 60-х годов [Shaw R.S., 1963], и в настоящее время оно считается методом выбора при инфицировании протеза [Зате-вахин И.И., 1999; Sharp W.J., 1994]. Действительно, полное удаление протеза позволяет быстро и надежно ликвидировать гнойный процесс, при этом риск нагноения шунта, проведенного в интактных тканях, значительно ниже, чем при повторной пластике in situ. При локализации гнойного очага в паху и верхней трети бедра оптимальным является проведение протеза в обход инфицированной зоны через обтураторное отверстие как наиболее прямой и короткий путь экстраанатомического шунтирования. В случаях массивного вовлечения в гнойный процесс мягких тканей внутренней поверхности бедра целесообразно проведение армированного подвздошно-подколенного шунта над гребнем подвздошной кости по наружной поверхности бедра в подколенную область. Подобные вмешательства выполнены нами у 4 больных, причем в 3 случаях удалось сохранить конечность. При инфицировании протеза аорты единственным надежным методом купирования инфекции и профилактики профузного кровотечения на сегодняшний день является удаление аллопротеза с обходным подклю-чично-бедренным шунтированием. Нами такие операции выполнены у 3 больных. Схемы операций представлены на рис. 6.75—6.78. К недостаткам указанной тактики лечения можно отнести опасность повреждения запирательных сосудов при "обтураторном" шунтировании, а также значительную частоту тромбоза длинных извитых обходных протезов. При использовании подключич-но-бедренного шунтирования целесообразно выполнение в отдаленном периоде реконструкции проксимального анастомоза с имплантацией протеза в аорту. Полное или частичное удаление инфицированного протеза с одномоментной заменой in situ на ауто- или ксеноматериал применяется рядом авторов в качестве альтернативы обходному шунтированию [Jackobs M.J., 1991]. При этом основной проблемой является высокая частота рецидивов инфекции. Авторы, использующие парциальное удаление с ре-протезированием in situ, отмечают, что более чем в 1/3 случаев происходит реинфицирование протеза в отдаленные сроки. Для профилактики повторного инфицирования сосудистых трансплантатов предложены различные пластические материалы. Наиболее надежно купировать инфекцию удается при использовании аутовены. В частности, A.Nevelsteen и соавт. (1997) предложили использование бедренной вены в старом ложе протеза при инфекции аортобедренного трансплантата. Во всех случаях удалось устранить инфекцию трансплантатов, однако отдаленные результаты оказались неудовлетворительными в связи с тромботически-ми осложнениями и проявлениями венозной недостаточности. Использование большой подкожной вены в значительном числе случаев оказывается невозможным из-за резкого несоответствия диаметров сосудов. Другим перспективным направлением лечения ППИ является использование протезов с антибактериальными свойствами. В последние годы появились многочисленные работы, посвященные применению протезов, импрегнированных различными антибиотиками, однако главным об-
12-4886
Рис. 6.75. Экстраанатомическое подвздошно-бедренное шунтирование через запирательное отверстие. Рис. 6.76. Экстраанатомическое подвздошно-подко-ленное шунтирование с огибанием крыла подвздошной кости и медиальным доступом к подколенной артерии выше щели коленного сустава. Рис. 6.77. Экстраанатомическое подвздошно-под-коленное шунтирование с огибанием крыла подвздошной кости и латеральным доступом к подколенной артерии ниже щели коленного сустава.
разом они касаются доклинических исследований. P.D.Hayes (1999) для замены инфицированного трансплантата использовал у 11 пациентов протезы, пропитанные рифампици-ном. Рецидив ППИ у 2 больных сопровождался тяжелыми осложнениями — сепсисом и кровотечением, в 7 случаях достигнуто стойкое купирование инфекции. Развитие этого, несомненно, прогрессивного направле- ния в настоящее время тормозят две основные нерешенные проблемы: создание длительной эффективной концентрации антибиотика в тканях вокруг протеза и чувствительность конкретного штамма микроорганизмов к используемому антибиотику. Сохранение инфицированного протеза представляет наименее травматичный путь лечения ППИ. В своей работе мы пытаемся сохранить про- тез при соблюдении следующих условий: • сохранение проходимости протеза и отсутствие признаков ишемии дистальных отделов конечности; • отсутствие признаков инфицирования зоны анастомозов или их несостоятельности (кровотечение в анамнезе, наличие ложной аневризмы); • отсутствие признаков эндовас-кулярной инфекции и бактериемии; • отсутствие ишемических и воспалительных изменений в мышцах, окружающих протез. В наших наблюдениях этим условиям соответствовали 10 случаев. После вскрытия гнойного очага и радикальной хирургической обработки раны во время ежедневных перевязок раневую поверхность и особенно обнаженный участок протеза обрабатывали низкочастотным ультразвуком через растворы антисептиков. После купирования явлений воспаления, снижения бактериальной обсемененности раны до 101—2 микробных тел в 1 г ткани и перехода раневого процесса в фазу регенерации по данным цитологического исследования выполняли повторную хирургическую обработку с полным иссечением всех измененных тканей, включая грануляции и уплотненные участки краев и дна раны. Раневую и обнаженную поверхности эндопро-теза дополнительно обрабатывали низкочастотным ультразвуком через 1 % раствор диоксидина. В литературе описано использование широкого спектра лоскутов для пластики парапротезной зоны [Horch R., 1994]. При локализации гнойного процесса в паху и верхней трети бедра мы использовали у 6 пациентов лоскуты m.gracilis и m.sarto-rius, так как сегментарный тип кровоснабжения этих мышц дает возможность формировать длинные и относительно тонкие лоскуты, позволяющие укрыть практически любой участок протеза в паху и на бедре. Это выгодно отличает их от предлагаемых лоскутов m.vastus lateralis и
Рис. 6.78. Подключично-бедренное шунтирование. m.semitendinosus. Кроме того, выпадение функции одной из этих мышц практически не сказывается на объеме движений в конечности в отличие от лоскута прямой мышцы живота на дистальной питающей ножке, после использования которого в ряде случаев наблюдаются асимметрия и слабость передней брюшной стенки. При пластике области брахиоце-фальных артерий нами в одном случае использован лоскут большой грудной мышцы. В 2 случаях при сочетании ППИ с передним медиастинитом применен лоскут большого сальника. Лоскут выкраивали с таким расчетом, чтобы при его перемещении не возникало натяжения лоскута или сдавления шунта. Целью миопластики мы считали создание вокруг ксеноматериала плотной муфты из биологически активной хорошо кровоснабжаемой ткани и ликвидацию полости вокруг протеза. Лоскут плотно фиксировали к ок-
12* ружающим тканям швами из рассасывающегося синтетического материала. В рану помещали перфорированную трубку для проточно-аспираци-онного дренирования на срок 5—7 сут после операции. В течение первых 10 дней у всех больных применяли направленную парентеральную антибактериальную терапию с учетом чувствительности выделенного штамма микроорганизмов. В последующем проводили длительную (до 1 мес) антибактериальную профилактику пероральными препаратами с учетом чувствительности микрофлоры. Приводим клинический пример. Больной Т., 70 лет, поступил в отделение ран и раневой инфекции с клинической картиной флегмоны левого бедра. В анамнезе в 1993 г. — бедренно-подколен-ное шунтирование протезом "Goretex" по поводу атеросклеротической окклюзии. Через 3,5 года после операции на фоне тромбофлебита большой подкожной вены развилась клиническая картина флегмоны. При поступлении состояние больного средней тяжести, лихорадка до 38,6 °С. Внутренние органы без патологических изменений. Артериальная гипертония 150—160/80 мм рт.ст. Местно — наличие инфильтрата в средней трети бедра с зоной флюктуации в центре, зона гиперемии и пастозности кожи по внутренней поверхности бедра до нижней трети. Больной в срочном порядке обследован. При компьютерной томографии выявлено 2 изолированных гнойника по ходу протеза: вскрытый проксимальный — в пределах подкожной клетчатки и не-дренированный дистальный — в нижней трети бедра, непосредственно связанный с портняжной мышцей. Данных о вовлечении в гнойный процесс проксимального и дистального анастомозов не обнаружено. При дуплексном сканировании выявлено, что протез полностью проходим, инфильтрация тканей в области анастомозов отсутствует, в нижней трети бедра вдоль протеза имеется зона разрежения размером 8 х 2,5 см, трактовавшаяся как гнойная полость. Произведены вскрытие флегмоны левого бедра, некрэктомия (рис. 6.79, а). Во время операции выявлено, что гнойная полость располагается вокруг сосудисто- го протеза и межмышечно. Протез обнажен на участке 6 см, пульсирует. При бактериологическом исследовании обнаружен рост эпидермального стафилококка. В послеоперационном периоде проводили антибактериальную терапию с учетом чувствительности микрофлоры (ци-профлоксацин по 200 мг 2 раза в сутки внутривенно), ежедневную обработку раны и протеза низкочастотным ультразвуком через растворы диоксидина и хи-мотрипсина, перевязки с диоксидиновой мазью. После купирования явлений гнойного воспаления выполнены повторная хирургическая обработка и пластика па-рапротезного пространства перемещенным лоскутом m.gracilis (рис. 6.79, б). Послеоперационный период протекал гладко, рана зажила первичным натяжением (рис. 6.79, в). Антибактериальная терапия ципрофлоксацином (по 500 мг 2 раза в день per os) в течение 3 нед. Контрольный осмотр через 2 года 6 мес: признаков воспаления нет, шунт функционирует, признаки ишемии конечности отсутствуют, при контрольном УЗИ мышечный лоскут плотно прилежит к протезу, жидкостных скоплений не определяется (рис. 6.79, г). В результате проведенного лечения удалось сохранить 7 из 10 протезов со сроком послеоперационного наблюдения от 4 мес до 5 лет. В 3 случаях отмечен тромбоз шунта, что потребовало выполнения обходного экстраанатомического шунтирования у 1 больного. Рецидива инфекции в наших наблюдениях не отмечено. Таким образом, наши наблюдения позволяют отказаться от пессимистичного взгляда на судьбу инфицированных сосудистых протезов, что согласуется с данными литературы. Следует отметить, что только сочетание радикальной хирургической обработки гнойного очага, дополнительных методов обработки раны, направленной антибактериальной терапии и пластики парапротезной зоны васкуляризованным лоскутом дает надежду на сохранение функционирующего имплантата и стойкую ликвидацию проявлений инфекции. Мы ни в коем случае не склонны предлагать сохранение инфициро-
Рис. 6.79. Клиническое наблюдение. а — вскрыт абсцесс внутренней поверхности бедра в области бедренно-подколенного протеза "Гортекс"; б — выполнена хирургическая обработка раны и пластика перипротезной зоны мобилизованным лоскутом m. gracilis; в — послеоперационное течение без осложнений, рана зажила первичным натяжением; г — контрольное УЗИ через 2 года 6 мес: протез функционирует, мышечный лоскут плотно прилежит к протезу, жидкостных скоплений не определяется. ванного протеза в качестве метода выбора для всех случаев гнойной инфекции в хирургии сосудов, однако считаем, что в некоторых строго определенных случаях он может стать достойной альтернативой ампутации конечности. 6.12.4. Профилактика инфекции трансплантатов С учетом основных путей инфицирования и патогенеза параэндопротез-ной инфекции профилактика развития инфекции должна состоять из следующих звеньев. Предоперационная подготовка — санация очагов хронической инфекции, особенно с учетом возможного лимфогенного пути инфицирования. При наличии трофических язв или гангренозных изменений дистальных отделов конечности на первом этапе целесообразно купирование явлений острого воспаления с помощью местной и общей антибактериальной терапии. В ряде случаев при наличии флегмоны стопы на фоне критической ишемии мы выполняли на первом этапе хирургическую обработку, а после демаркации зоны некроза и купирования перифокального воспаления — реконструктивное ангиохи-рургическое вмешательство. Строжайшее соблюдение правил асептики на всех этапах лечения является краеугольным камнем профилактики инфекции. Хирургические аспекты профилактики инфекции: • щадящее обращение с тканями и непродолжительность операции, так как имеется прямая зависимость между длительностью операции и частотой гнойных осложнений; • профилактика повреждения лимфатических сосудов. В частности, при операциях на бедренной артерии целесообразно использовать латеральный доступ к бедренным сосудам. Для профилактики лимфоген-ной инфекции некоторыми авторами предлагается выполнять лимфаден-эктомию при наличии хронических очагов инфекции в дистальных отделах конечности, что позволяет значительно снизить частоту гнойных осложнений, однако клиническое применение этого метода ограничено в связи с опасностью лимфедемы [Folsom D.L., 1992]; • гемостаз; • дренирование парапротезного пространства с активной аспирацией экссудата в течение первых суток после операции позволяет избежать скопления крови и серозной жидкости и, таким образом, ликвидировать возможную среду для развития микроорганизмов. Выбор вида протеза для имплантации с учетом резистентности к инфекции. Как упоминалось выше, в настоящее время ведутся интенсивные работы по созданию протезов с антибактериальными свойствами. Клиническое применение этих импланта-тов пока ограничено, однако имеются данные об эффективности использования протезов с антибактериальными свойствами для профилактики гнойных осложнений. По данным некоторых авторов, использование протезов, импрегнированных рифампи-цином, уменьшает частоту поверхностной инфекции с 3,5 до 2,3 % и глубокой инфекции — с 0,9 до 0,6%. В то же время исследование, проведенное M.D'Addato и соавт. в 1991—1994 гг. у 904 пациентов, не показало статистически достоверных различий, касающихся профилактики инфекций протезов. Через год частота инфекции у больных с протезами, пропитанными рифампици-ном, составила 1,7 %, в то время как в контрольной группе — 2 %. Через 5 лет частота инфекции в обеих группах составила 2,3 %. По всей видимости, окончательно судить о возможности использования этих протезов для снижения частоты развития инфекций трансплантатов — дело будущего. Антибактериальная терапия традиционно применяется для профилактики гнойных осложнений. Считаем необходимым остановиться на ряде чрезвычайно важных положений. C.Santini и соавт. показали, что троекратное введение антибиотиков в течение 24 ч не повышает частоту развития инфекции, однако это положение можно использовать с тремя оговорками: — необходимо обязательное инт-раоперационное введение антибиотиков; — использование комбинации це-фалоспоринов последнего поколения с аминогликозидами; — при имеющейся инфекции хирургические процедуры должны быть дополнены длительной антибактериальной терапией. Нами установлено следующее: • выполнение превентивных мер снижает частоту развития инфекции трансплантатов; • повторные операции, особенно в ранние сроки, повышают риск возникновения инфекции трансплантата; • наиболее информативными являются методы диагностики лейкоцитами, меченными радиоактивным индием или технецием, в сочетании с компьютерной томографией; • при тромбированном протезе и компенсации кровообращения целесообразно удаление протеза с отсроченным репротезированием; • попытку сохранения инфицированного протеза можно предпринимать при отсутствии распространения процесса на анастомозы; • метод выбора при проходимом трансплантате — удаление протеза с одним из вариантов экстраанатомического шунтирования; • повторное вмешательство необходимо производить до возникновения эрозивного кровотечения; • при выполнении протезирования синтетическим протезом in situ риск реинфекции выше, чем при экстраанатомическом шунтировании. Литература Покровский А. В., Светухин А.М., Чупин А.В., Цветков В.О. Профилактика в лечении гнойных осложнений после реконструктивных операций в аортобедренной позиции с использованием сосудистых трансплантатов // Ангиол.-сосуд, хир.—1996.—№ 1.— С.72-80. Balas P. An Overview of Aortofemoral Graft Infection // Europ.J.Surg. Endovasc. Surg.— 1997.-Vol.14.-P.3-5. Becquemin J.P., Qvarfordt P., Kron G et al. Aortofemoral Graft Infection is there a Place for Patial Graft Removal? // Europ.J.Surg. Endovasc. Surg.-1997.-Vol. 14.-P.53-59. Daddato M., Curti Т., Freyrie A. The Rifam-picin-bonded Gelseal Graft // Europ.J.Surg. Endovasc. Surg.-1997.-Vol.-P.15-18. Hicks R.C.J., Greenhalgh R.M. The pathogenesis of Vascular Graft Infection // Europ.J.Surg. Endovasc. Surg. — 1997. — Vol. 14. - P.5-10. Nevelsteen A., Lacroix #., Suy R. Infrarenal Aortic Graft Infection in situ Aortoiliofemoral Reconstruction with the Lower Extremity Depp // Europ. J. Surg. Endovasc. Surg.— 1997. - Vol. 14. - P.88-93. Santini C, Baiocchi P., Sena P. Perioperative Antibiotic Prophylaxis in Vascular Surgery // Europ.J.Surg. Endovasc. Surg. — 1997. — Vol.14. -P.13-15. Torsello G., Sandmann W. Use antibiotic-bonded Grafts in Vascular Graft Infection // Europ. J. Surg. Endovasc. Surg. — 1997. — Vol. 14. - P.84-88. Zeltsman D., Tzarnas CD., Kerstein M.D. Management of vascular prosthetic infections: results of long-term follow-up // Amer. J. Surg. — 1999. - Vol. 65, N 4. - P.331-333. Дата добавления: 2015-02-06 | Просмотры: 1647 | Нарушение авторских прав |