|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Облитерирующий атеросклероз
Облитерирующие заболевания сосудов конечностей занимают первое место по клиническому значению и частоте проявления. В данном разделе речь пойдет о хронической артериальной недостаточности нижних конечностей, вызванной поражением артерий ниже уровня пупартовой связки. Рассматриваются поражения бедренных, подколенных артерий и артерий голени. Эпидемиология. Основным симптомом проявления окклюзии магистральных артерий служит перемежающаяся хромота, которая, по данным Всемирной организации здравоохранения за 1988 г., встречается у 5 % лиц пожилого возраста. Хронические облитерирующие заболевания сосудов нижних конечностей составляют 3—4 % числа всех хирургических заболеваний [Поцвей А.В., 1977]. Частота хронических облитериру-ющих заболеваний зависит прежде всего от возраста: 0,3 % приходится на 4-й десяток жизни, 1 % — на 5-й, 2—3 % — на 6-й и 5—7 % — на 7-й десяток [Bakir R. et al, 1981]. Имеется тенденция к увеличению числа больных облитерирующими заболеваниями артерий нижних конечностей. На Всемирном конгрессе Международного общества протезистов и ортопедов в 1980 г. было отмечено, что причиной первичной ампутации нижних конечностей в 10 % случаев являются сосудистые пора- жения. При сохранении имеющейся тенденции к 2020 г. эта цифра может достигнуть 45 % [Кирнус М.Л., 1987]. Если количество ампутаций, выполненных в Швеции в 50-х годах, было 17 на 100 000 жителей, то в настоящее время число ампутаций приближается к 50. Этому процессу способствуют не только омоложение атеросклероза и увеличение продолжительности жизни, но и увеличение факторов риска развития данного заболевания. Перемежающаяся хромота (ПХ) — основной клинический синдром ате-росклеротического поражения артерий нижних конечностей. По данным многочисленных исследований, ПХ встречается у 1—5 % лиц моложе 50 лет. Распространенность ПХ значительно увеличивается с возрастом, достигая 10—14 % среди людей 50— 70 лет [Dormandy J. et al., 1989; Cri-qui M.H. et al., 1992]. Частота возникновения симптомов ПХ у первично здоровых субъектов в возрасте 40— 60 лет составляет 5—8,6 случаев на 1000 человек в год [Bowlin S.J. et al., 1994]. Этиология. Наиболее частой причиной бедренно-подколенных окклюзии является облитерирующий атеросклероз (75—80 % больных). Окклюзия артерий вследствие обли-терирующего тромбангиита наблюдается почти у 20 % больных, в основном с поражением подколенной артерии в сочетании с облитерацией артерий голени и стопы. Посттравматические и постэмболические окклюзии наблюдаются реже. Еще более редкими причинами окклюзии подколенной артерии являются кистоз-ная дегенерация адвентиции и врожденные аномалии расположения артерии с ущемлением ее икроножной мышцей. Кистозная дегенерация адвентиции вызывает сужение просвета сосуда с последующим тромбозом. Типичная локализация поражения — подколенная артерия. Синдром ущемления подколенной артерии, так называемый popliteal entrapment syndrome, наблюдается у юношей и мужчин молодого возраста. Аномалия заключается в том, что сухожильная часть медиальной головки икроножной мышцы, располагаясь латеральнее подколенной артерии, смещает ее медиально и вызывает компрессию артерии между мышцей и медиальным мыщелком бедра при разгибании коленного сустава. Клиническая картина ишемии нижних конечностей зависит от степени нарушения кровоснабжения. Основное клиническое проявление — болевой синдром. Выраженность болевого синдрома определяет 4 степени ишемии (по А.В.Покровскому — Фонтейну). При I степени боль в нижних конечностях (икроножных мышцах) появляется только при большой физической нагрузке, при ходьбе на расстояние больше 1 км. При II степени ишемии боль возникает при ходьбе на меньшее расстояние. При этом важным критерием считается расстояние протяженностью 200 м. Если больной может обычным шагом (не медленно) пройти 200 м, не отмечая появления боли, то его состояние относится ко ПА степени ишемии. Если боль при нормальной ходьбе возникает раньше, чем будет пройдено 200 м, — это НБ степень ишемии конечности. Если боль появляется в покое и при ходьбе до 25 м, — это III степень ишемии. IV степень ишемии характеризуется возникновением язвенно-некротических изменений тканей стопы и голени. Боль возникает обычно внезапно при ходьбе по ровному месту и длительное время не проходит. Больной вынужден остановиться, чтобы компенсировать в покое ишемию мышц. При подъеме в гору или по лестнице боль возникает значительно быстрее. Кроме того, при ходьбе больные отмечают онемение и похолодание ишеми-зированной конечности. Пациенты обращают внимание на выпадение волос и медленный рост ногтей на пальцах ног. При осмотре важно отметить ги-потрофичность мышц нижних конечностей. У половины больных наблюдается изменение окраски кожных покровов, преимущественно в области стопы (цианоз, а у больных с IV степенью ишемии — отек и гиперемия). Диагностика. При осмотре нижних конечностей отмечают изменения окраски кожи, атрофию мышц, изменения формы ногтей и выпадение волос. Бледность кожных покровов обусловлена недостаточным капиллярным кровотоком спастического происхождения. При атонии капилляров кожные покровы приобретают багрово-цианотичную окраску, особенно при диапедезе эритроцитов через стенку паретичных капилляров. Пульсацию артерий нижних конечностей изучают поэтапно и симметрично: на бедренных, подколенных артериях, артериях стоп. Необходимо помнить, что у 6—24 % людей пульсация тыльной артерии стопы может отсутствовать. Следует сравнивать пульсацию артерий на стопах с пульсацией лучевых артерий. Выполняют аускультацию в стандартных точках брюшной части аорты, подвздошных, бедренных, сонных, позвоночных, подключичных артерий. Обязательно определяют и сравнивают артериальное давление на руках и ногах. Методы инструментальной диагностики. Основным методом диагностики при поражении артерий нижних конечностей является ультразвуковая допплерография, которая дает возможность определить наличие пульсового кровотока, артериальное давление и скорость кровотока по артериям. Важным показателем является величина систолического артериального давления на уровне лодыжки и его отношение к систолическому давлению на плече — ло-дыжечно-плечевой индекс (ЛГТИ) (рис. 7.1). При ишемии II степени ЛПИ составляет в среднем 0,7. При ишемии III степени ЛПИ снижается до 0,5, а при ишемии IV степени падает до 0,3 и ниже. Исключение составляют больные с дистальными формами поражения артерий голени и стопы, у которых ЛПИ может быть высоким. Малоинформативным ЛПИ бывает у больных сахарным диабетом за счет выраженного медиокаль-циноза артерий среднего диаметра; у этих пациентов необходимо измерять пальцевое давление на пораженной конечности. Метод дуплексного сканирования позволяет с большой точностью оценить гемодинамические изменения в пораженном сегменте дистальнее уровня окклюзии, оценить просвет и качество артериальной стенки и адекватно выбрать участок для наложения дистального анастомоза. Дуплексное сканирование дает возможность оценить состояние сосудов в области бифуркации общих сонных артерий, поражение которых очень часто наблюдают у пациентов с ате-росклеротическими изменениями артерий нижних конечностей. В последующем это определяет тактику оперативного лечения.
Рис. 7Л. Методика проведения ультразвуковой доп-плерографии с измерением сегментарного артериального давления. Для оценки изменений микроциркуляции стопы используют чрескож-ное определение напряжения кислорода (ТсР02) в первом межпальцевом промежутке, которое хорошо коррелирует с напряжением кислорода в артериальной крови и характеризует степень оксигенации и микроциркуляции в коже. В норме базальный уровень ТсР02 на стопе достигает 60—70 мм рт.ст. При II степени ишемии эти значения составляют 38— 52 мм рт.ст., а при III степени ишемии ТсР02 на стопе ниже критического — 30 мм рт.ст. При IV степени ишемии конечности ТсР02 — ниже 10 мм рт.ст. (базальный уровень), что свидетельствует о тяжелой степени нарушений микроциркуляции. Степень нарушения микроциркуляции в коже можно оценить и при помощи лазерной флоуметрии, используя допплеровский эффект изменения частоты гелий-неонового лазера при прохождении через поток форменных элементов крови. Ценность метода повышается при проведении пробы с реактивной гиперемией и термопроб, постуральной и ортостатической проб. Полезно оценить индекс капиллярного кровотока по соотношению его на тыле стопы и кисти. Основным методом топической диагностики поражений артерий нижних конечностей остается рентгено-контрастная ангиография (рис. 7.2). Если больному не показано оперативное вмешательство, ангиографию проводить не следует — достаточно применить ультразвуковые методы исследования. Оценка состояния периферических артерий возможна как при помощи внутривенной ангиографии, так и с помощью чрескожной артериальной ангиографии. Внутривенную ангиографию с цифровой обработкой изображения выполняют, вводя рен-тгеноконтрастное вещество в куби-тальную вену. Достоинствами метода является то, что не требуется пункции артерии, и возможность применения
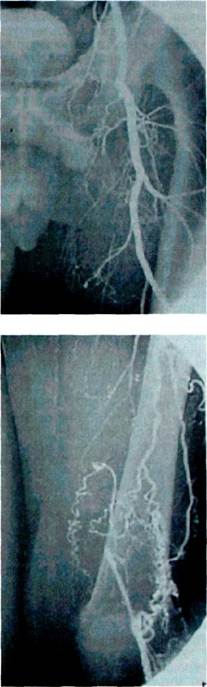
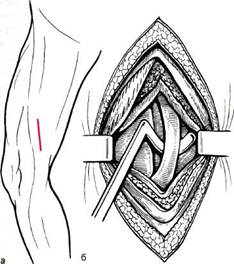
Рис. 7.2. Окклюзия поверхностной бедренной артерии. в амбулаторных условиях. К недостаткам необходимо отнести малую разрешающую способность и поэтому неудовлетворительное изображение. Для проведения артериальной ангиографии используют то же оборудование, что и при внутривенной ангиографии, но контрастное вещество вводят в артериальное русло. Возможно получение удовлетворительного изображения с помощью небольшого количества контрастного вещества. Для пациентов с поражением артерий нижних конечностей обязательно выполнение ангиографии с контрастированием дистального сосудистого русла и применением фар-макопроб (артерии голени и стопы). Ангиография остается наиболее информативным методом диагностики при планировании и выполнении реконструктивных операций на сосудах нижних конечностей. Лечение консервативное. Больным с поражением артерий нижних конечностей при I и ПА степени ишемии показано консервативное лечение курсами продолжительностью 1—2 мес. Такое же лечение целесообразно проводить 1—2 раза в год у больных после реконструктивных сосудистых операций. У больных с поражением артерий нижних конечностей, как правило, отмечаются гиперкоагуляция и ухудшение реологических свойств крови. В настоящее время большое значение придается улучшению реологических свойств крови, поэтому для уменьшения риска агрегации и адгезии тромбоцитов и эритроцитов целесообразно назначение ацетилсалициловой кислоты (100 мг один раз в сутки) или тиклида (250 мг 2 раза в день), обладающих дезагрегирующими свойствами. Для улучшения микроциркуляции применяют трентал по 400 мг (суточная доза 1200 мг). В условиях стационара для улучшения микроциркуляции назначают реополиглюкин из расчета 5 мл/кг внутривенно, 5—10 инфузий через день (при артериальной гипертензии следует применять осторожно). Для лечения больных с ишемией I и ПА степени используют баротерапию, УФ-лучи, диадинамические токи (токи Бернара), лазертерапию, магнитотерапию, массаж, санаторный режим с применением сероводородных ванн. В комплекс консервативных мероприятий очень важно включить дозированную ходьбу (ки-незитерапия) с обязательным контролем проходимой дистанции и ежедневной фиксацией ее в дневнике больного. При поражении артерий нижних конечностей обязателен отказ от курения. Необходимо контролировать артериальную гипертензию и нарушения липидного обмена и проводить соответствующую коррекцию. Хирургическое лечение показано больным с ишемией конечности ПБ, III и IV степени. Противопоказания к хирургическому лечению: инфаркт миокарда, инсульт, перенесенные в течение предшествующих 3 мес; сердечная недостаточность III степени. Возраст и наличие сопутствующих заболеваний не являются противопоказаниями к операции. Доступы к артериям при сосудистых реконструктивных операциях ниже пупартовой связки. Доступ к бедренной артерии в бедренном треугольнике описан в разделе, посвященном аортоподвздошно-бедренным реконструкциям. Поэтому в данном разделе будут представлены доступы к артериям, расположенным дистальнее средней трети бедра. Доступ к подколенной артерии выше щели коленного сустава (рис. 7.3) используют в том случае, когда предполагается наложение дистального анастомоза при бедренно-подколен-ной реконструкции выше щели коленного сустава, если, по данным рентгеноконтрастной ангиографии, имеется контрастирование подколенной артерии на всем протяжении. Положение конечности: ее сгибают в коленном суставе и ротируют кнаружи. Под среднюю треть бедра
Рис. 7.3. Доступ к подколенной артерии выше щели коленного сустава (а, б).
Рис. 7.4. Доступ к подколенной артерии ниже щели коленного сустава и начальным отделам задней большеберцовой и малоберцовой артерий (а, б).
следует положить небольшой валик. При таком положении внутренняя поверхность бедра направлена к хирургу. Разрез кожи, подкожной клетчатки и поверхностной фасции длиной 8—10 см проводят по краю сухожилия m.adductor magni от верхнего края внутреннего мыщелка бедра кверху. После рассечения фасции портняжную мышцу отводят медиально, сухожилие большой приводящей мышцы оттягивают кпереди, а сухожилия полумембранозной, полусухожильной и стройной мышц — кзади. После этого доступна обозрению рыхлая клетчатка надмыщелко-вой ямки Жобера, где тупым путем выделяют сосудисто-нервный пучок. Выделяют и берут на держалку подколенную артерию. Необходимо быть осторожным, чтобы не повредить a.genus descendens, расположенную на этом уровне. Подколенную артерию мобилизуют на протяжении 3—4 см для наложения анастомоза. Доступ к подколенной артерии и проксимальным отделам задней болъ-шеберцовой и малоберцовой артерий ниже щели коленного сустава (рис. 7.4) применяют при поражении проксимального сегмента подколенной артерии. Положение оперированной конечности аналогично доступу к подколенной артерии выше щели коленного сустава (см. ранее). Ориентирами при внутреннем доступе к дистальной порции подколенной артерии являются медиальный край большеберцовой кости и медиальная головка икроножной мышцы. Кожный разрез длиной 10—12 см проводят вдоль медиального края большеберцовой кости, отступив на 1 см кзади от него. Начало разреза располагается на 1 см ниже tuberositas tibia. При рассечении кожи и подкожной клетчатки необходимо соблюдать осторожность, так как в проекции этого доступа проходит большая подкожная вена, которую можно легко повредить, а она является основным пластическим материалом для бед-ренно-подколенных и бедренно-берцовых реконструкций. После рассечения собственной фасции медиальную головку икроножной мышцы отводят медиально (нога должна быть согнута в коленном суставе), и при этом в небольшом слое рыхлой клетчатки становится видным больше-берцовый нерв, идущий вдоль задней стенки вен (реже одной вены), прикрывающих подколенную артерию. Артерию выделяют из сосудисто-нервного пучка и берут на держалку.
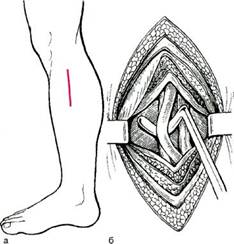
Для удобного наложения анастомоза подколенную артерию выделяют на протяжении не менее 4 см. В нижней трети разреза выявляется верхнемедиальный край камбаловидной мышцы, которую можно надсечь у внутреннего края большеберцовой кости и отвести кзади; тогда обнажается дистальный отдел подколенной артерии в месте ее деления. Этот доступ также используют при выделении начальных отделов задней болыпеберцовой и малоберцовой артерий — необходимо лишь продлить кожный разрез книзу. После рассечения собственной фасции определяют зону прикрепления камбаловидной мышцы, на этом протяжении медиальный край камбаловидной мышцы сращен только с собственной фасцией голени. Необходимо надсечь камбало-видную мышцу с фасцией, приподняв которую, можно проникнуть в глубокое ложе голени. Затем в проксимальном направлении камбало-видную мышцу отсекают от больше-берцовой кости в мышечно-костной зоне прикрепления. Обнажают задние большеберцовые сосуды, которые проходят на расстоянии 2—2,5 см от медиального края болыпеберцовой кости. Для обнажения малоберцовых сосудов из этого доступа следует пересечь внутреннюю часть сухожильной дуги икроножной мышцы. После этого можно отвести кожно-мышечный лоскут еще кзади и кнаружи и увидеть малоберцовые сосуды. При выделении берцовых артерий следует стремиться, чтобы они были мобилизованы на протяжении не менее 3 см — это необходимо для удобного наложения анастомоза. Доступ к передней тибиальной артерии в верхней трети голени (рис. 7.5). В верхней трети голени при доступе к передней тибиальной артерии внешними ориентирами являются передняя борозда голени и передний край болыпеберцовой кости. После определения передней борозды, отступив на 1 см кнутри, проводят параллельно ей разрез длиной 7—8 см, начиная его на уровне бугристости болыпеберцовой кости. После рассечения кожи и подкожной клетчатки определяют промежуток между mm.tibialis anterior и extensor digito-rum longus и разводят их. Передняя болынеберцовая артерия находится под m.extensor digitorum longus вблизи малоберцовой кости. Для удобства наложения анастомоза необходимо также выделить артерию на протяжении 4 см. Доступ к задней болъшеберцовой артерии на уровне нижней трети голени (рис. 7.6). Задняя болыпеберцовая артерия проходит на этом уровне сравнительно неглубоко между боль-шеберцовой костью и внутренним краем ахиллова сухожилия на протя-
Рис. 7.6. Доступ к задней большеберцовой артерии на уровне нижней трети голени (а, б). жении 8—9 см выше лодыжки. Поверхностное их расположение зависит от уровня перехода камбаловидной мышцы в сухожилие, отделяющего сосудисто-нервный пучок, который окажется покрытым только фасци-альным листком или мышцей. К задней большеберцовой артерии возможны два доступа — выше лодыжки и позади нее. При доступе выше лодыжки разрез следует проводить на границе задней и средней трети промежутка между большеберцовой костью и ахилловым сухожилием. После рассечения кожи с подкожной клетчаткой на положение сосудисто-нервного пучка может указывать большеберцовый нерв (желтая полоска под фасцией вблизи внутреннего края ахиллова сухожилия). У края кости проходит сухожилие длинного сгибателя пальцев. Фасцию следует рассечь вдоль нерва, после чего выделяют артерию. При доступе к задней большеберцовой артерии на уровне лодыжки разрез длиной 4—5 см выполняют на 1 см кзади от лодыжки. После рассечения кожи и удерживающей связки легко выделить артерию. Доступ к малоберцовой артерии (рис. 7.7). Малоберцовую артерию в ее проксимальной части обнажают через медиальный разрез в верхней трети голени с частичным рассечением камбаловидной мышцы. При шунтировании доступ к средней части артерии осуществляют через разрез длиной 8—10 см по латеральной поверхности голени в промежутке между длинной и короткой малоберцовыми и камбаловидной мышцей. Последнюю смещают кзади и обнаруживают длинный сгибатель большого пальца, который острым путем отделяют от малоберцовых мышц.
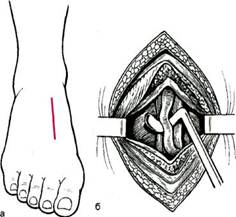
Рис. 7.7. Доступ к малоберцовой артерии (а, б). В глубине раны обнаруживают а.ре-rоnеа. В нижней трети голени от малоберцовой артерии обычно отходят rami communicans к ветвям больше-берцовых артерий. Эти ветви следует сохранить. Доступ к артерии тыла стопы (рис. 7.8). Для кожного разреза пользуются проекционной линией или положением сухожилия m. extensor hallucis longus, позволяющим определить ход сосудисто-нервного пучка. Можно различать верхний (над-лодыжковый), средний (лодыжко-вый) и нижний (подлодыжковый) доступы к тыльной артерии стопы. При верхнем доступе к тыльной артерии стопы разрез длиной 5—6 см производят над медиальной лодыжкой тотчас кнаружи от сухожилия m.tibialis anterior. Собственную фасцию рассекают в промежутке между сухожилиями mm.tibialis anterior и extensor hallucis longus. При разведении сухожилий на болыпеберцовой кости в небольшом слое клетчатки видны тыльная артерия стопы и глубокий малоберцовый нерв. При доступе к тыльной артерии на уровне внутренней лодыжки разрез длиной 4—5 см ведут вдоль промежутка между сухожилиями передней болыпеберцовой мышцы и разгиба-
Рис. 7.8. Доступ к артерии тыла стопы (а, б). телем большого пальца. Артерия на этом уровне лежит под сухожилием длинного разгибателя большого пальца, которое можно отвести кнаружи. При доступе к тыльной артерии ниже лодыжки кожный разрез длиной 4—5 см проводят кнаружи от сухожилия m.extensor hallucis longus. Артерия проходит над головкой таранной кости, ладьевидной и средней клиновидной кости и окружена сухожилиями длинного разгибателя большого пальца (изнутри), длинного разгибателя пальцев (проксимально) и коротким разгибателем большого пальца (дистально). На этом уровне артерию легко выделить, так как она лежит поверхностно. Пластический материал при реконструктивных операциях на артериях нижних конечностей ниже уровня пупартовой связки. При шунтирующих операциях на нижних конечностях ниже уровня пупартовой связки в качестве пластического материала применяют как аутовенозный трансплантат, так и аллотрансплантаты. Предпочтение отдают аутовенозному трансплантату, в качестве которого используют большую подкожную вену. Известно две методики ее применения: забор вены с ее реверсией и использование вены на месте (in situ) с разрушением клапанов специальным инструментом. Подготовка реверсируемой аутове-ны. Забор большой подкожной вены производят через отдельные кожные разрезы (2—4) по медиальной поверхности бедра с сохранением небольших (до 1—2 см) кожных перемычек. При заборе вены необходимо правильно определить длину трансплантата. Следует аккуратно лигировать боковые ветви вены, не допуская их отрыва, который может привести к продольному надрыву основного ствола. После лигирования и пересечения боковых веток большую подкожную вену пересекают в верхней трети бедра, проксимальный конец прошивают и лигируют. Аналогичную манипуляцию выполняют с дис-
Рис. 7.9. Использование большой подкожной вены по методике in situ (этапы операции). тальной частью большой подкожной вены на уровне верхней трети голени, лигируя дистальный конец вены. Иссеченную вену погружают в лоток с изотоническим раствором натрия хлорида, куда предварительно введено 5000 ЕД гепарина. В дистальный конец вены вводят тупую канюлю на шприце. Вену сначала промывают, затем подвергают гидравлической дилатации, одновременно проверяя герметичность перевязанных ветвей. Имеющиеся дефекты ушивают мо-нофиламентной нитью 6/0 и 7/0. Вену реверсируют и размещают при выполнении шунтирования таким образом, что с дистальным концом вены формируют проксимальный анастомоз, а с проксимальным концом вены — дистальный. Использование большой подкожной вены in situ (рис. 7.9). Данная методика имеет свои преимущества при большой длине трансплантата: происходит лучшая адаптация дисталь-ного конца вены к более мелкому диаметру соответствующего уровня артерий и сохраняется кровоснабжение венозной стенки. При методике in situ сначала формируют проксимальный анастомоз с проходимым сегментом артерии, после наложения
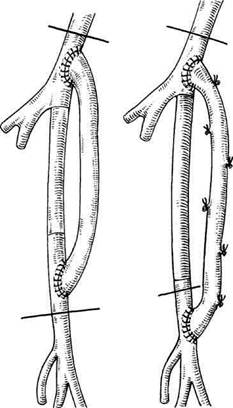
13-4886 анастомоза пускают кровоток и отмечают пульсацию до первого венозного клапана. Затем выделяют сегмент большой подкожной вены на уровне предполагаемого дистально-го анастомоза, вену пересекают, дистальный конец вены лигируют. В проксимальный конец в краниальном направлении вводят инструмент для разрушения клапанов до уровня проксимального анастомоза. Затем тракцией клапанотома к стопе на пульсирующем кровотоке разрушают клапаны. Данную манипуляцию выполняют несколько раз с вращением инструмента по оси до получения пульсирующего кровотока на дис-тальном конце вены, после чего формируют дистальный анастомоз. При пуске кровотока выраженное систо-лодиастолическое дрожание по ходу трансплантата позволяет определить крупные венозные ветки, которые лигируют через единичные небольшие кожные разрезы. Гомотрансплантаты и аллотранс-плантаты используют при рассыпном типе большой подкожной вены, при ее облитерации и повторных реконструкциях, когда отсутствует ау-томатериал. При реконструкциях ниже пупартовой связки применяют аллопротезы из политетрафторэтилена (ПТФЭ), которые по своим свойствам лишь незначительно уступают аутовене. Существуют конические протезы с армированными участками для применения в области коленного сустава, а также протезы из ПТФЭ малого диаметра (до 4 мм), применяемые в подколенно-берцовой области. В ситуации, когда невозможно использовать аутовену или протез из ПТФЭ, применяют гомоартериаль-ный трансплантат, который уступает вышеуказанным трансплантатам, но тем не менее дает возможность выполнить реконструктивную операцию и спасти конечность от ампутации. При бедренно-подколенном шунтировании выше щели коленного сустава используют линейный протез из дакрона диаметром 7—8 мм. Наиболее важные моменты при бедренно-подколенно-берцовых реконструкциях: • избегать эндартерэктомии из подколенной и берцовых артерий; • реконструкцию начинать с формирования дистального анастомоза; • дистальный анастомоз формировать по типу конец в бок. Бедренно-подколенное шунтирование выше щели коленного сустава (рис. 7.10) выполняют при окклюзии поверхностной бедренной артерии в устье, в гунтеровом (приводящем) канале и на всем протяжении при сохранной проходимости подколенной артерии после выделения бифуркации общей бедренной артерии и подколенной артерии в месте выхода из гунтерова канала, а также забора и приготовления большой подкожной вены. Сначала формируют дистальный анастомоз по типу конец в бок реверсированной аутовеной с подколенной артерией непрерывным об-вивным швом монофиламентной нитью 5/0 или 6/0. Длина анастомоза — более 15 мм. Затем трансплантат проводят по ходу сосудисто-нервного пучка на верхнюю треть бедра и формируют проксимальный анастомоз. Существует два варианта формирования проксимального анастомоза: 1) при сохранной проходимости поверхностной бедренной артерии в верхней трети анастомоз формируют по типу конец трансплантата в бок общей бедренной артерии с переходом на начальный отдел поверхностной бедренной артерии; 2) при окклюзии поверхностной бедренной артерии непосредственно в устье артерию отсекают, дистальный конец ее перевязывают с прошиванием, а разрез от устья продлевают на 1,5—2 см по передней стенке общей бедренной артерии и формируют косой анастомоз с общей бедренной артерией. Проксимальный анастомоз формируют монофиламентной нитью 5/0. При бедренно-подколенной реконструкции выше щели коленного сустава в качестве пластического ма- териала предпочтение отдают синтетическому протезу из ПТФЭ или дакрона. Бедренно-подколенное шунтирование ниже щели коленного сустава (рис. 7.11) выполняют при окклюзии поверхностной бедренной артерии с одновременной окклюзией проксимального отдела подколенной артерии. Дистальный анастомоз формируют с подколенной артерией ниже щели коленного сустава по типу конец в бок монофиламентной нитью 6/0. Длина анастомоза больше 10 мм. Затем трансплантат проводят на верхнюю треть бедра. На уровне коленного сустава предпочтительнее провести его по ходу сосудисто-нервного пучка, чтобы избежать большого отклонения оси трансплантата по отношению к артерии. На бедре возможно подкожное проведение трансплантата. Проксимальный анастомоз формируют аналогично описанной выше методике при бедренно-подко-ленном шунтировании выше щели коленного сустава. При бедренно-подколенной реконструкции ниже щели коленного сустава в качестве пластического материала можно использовать аутовену, как реверсированную, так и по методике in situ, или армированный протез из ПТФЭ. Бедренно-тибиальное шунтирование (при условии, что берцовые артерии проходимы в верхней трети голени) (рис. 7.12). Данную реконструкцию выполняют при окклюзии подколенной артерии на всем протяжении с одновременными изменениями в поверхностной бедренной артерии. В этой ситуации предпочтительнее наложение дистального анастомоза в тибиоперонеальный ствол по типу конец в бок непрерывным обвивным швом монофиламентной нитью 6/0. В связи с тем что уровень дистального анастомоза значительно ниже щели коленного сустава, трансплантат можно провести подкожно, при этом угол между артерией и трансплантатом не будет слишком большим. Проксимальный анасто-
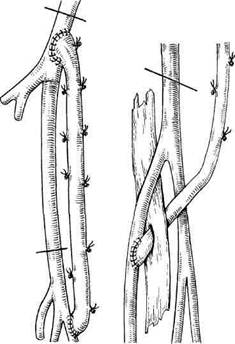
Рис. 7.10. Бедренно-подколенное шунтирование выше щели коленного сустава. Рис. 7.11. Бедренно-подколенное шунтирование ниже щели коленного сустава. моз формируют с общей бедренной артерией аналогично методике, описанной выше (см. Бедренно-подколенное шунтирование выше щели коленного сустава). Даже при сохраненной проходимости поверхностной бедренной артерии до уровня гунтерова (приводящего) канала не рекомендуется формировать анастомоз с данной артерией, так как она часто поражена атеросклеротическим процессом. В качестве пластического материала при бедренно-берцовых реконструкциях предпочтение отдают использованию аутовены по методике in situ. При отсутствии аутопласти-
13*
Рис. 7.12. Бедренно-заднетибиальное шунтирование. Рис. 7.13. Бедренно-переднетибиальное шунтирование. ческого материала можно применять армированный тонкостенный протез из ПТФЭ конической формы диаметром 7—5 мм. При окклюзии тибиоперонеально-го ствола и сохранной проходимости начальных отделов берцовых артерий выполняют бедренно-заднебольше-берцовое шунтирование. Техника операции не отличается от описанной выше с дистальным анастомозом с тибиоперонеальным стволом. При проходимости лишь передней тибиальной артерии выполняют бед-ренно-переднебольшеберцовое шунтирование (рис. 7.13). Следует выделить переднюю тибиальную артерию в верхней трети голени и выполнить медиальный доступ к трифуркации подколенной артерии. Через эти до- ступы удобно сформировать отверстие в межкостной мембране для проведения трансплантата. Дистальный анастомоз формируется с передней тибиальной артерией по типу конец в бок непрерывным обвивным швом монофиламентной нитью 6/0. После наложения дистального анастомоза реверсированную аутовену выводят через заранее образованное отверстие в межкостной мембране на медиальную поверхность голени и далее подкожно по медиальной поверхности нижней конечности проводят на верхнюю треть бедра, где формируют проксимальный анастомоз по описанной выше методике. При реконструкции с использованием вены по методике in situ после формирования проксимального анастомоза и разрушения клапанов в стволе большой подкожной вены дистальный мобилизованный конец вены через межкостную мембрану проводят на латеральную поверхность голени и формируют дистальный анастомоз с передней тибиальной артерией. При реконструкции передней тибиальной артерии проведение трансплантата по латеральной поверхности области коленного сустава и бедра также возможно, но нежелательно. Ранний послеоперационный период. Все раны после операции активно дренируют на протяжении суток. Необходимо проводить наблюдение за пульсацией трансплантата и периферических артерий, если после операции на них появилась пульсация. При невозможности определить пульсацию пальпаторно используют ультразвуковое допплеровское исследование. При развитии тромбоза трансплантата показано экстренное оперативное вмешательство, направленное на выявление и устранение причин тромбоза. При раннем послеоперационном тромбозе показано выполнение интраоперационной ангиографии, которая дает возможность увидеть тактические и технические ошибки первичной реконструкции.
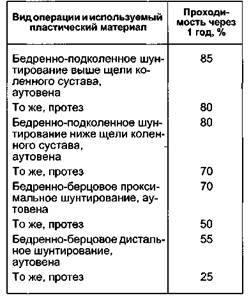
Причиной раннего послеоперационного тромбоза у больных после реконструктивной операции ниже уровня паховой складки могут быть нестабильная гемодинамика (тенденция к гипотонии) и гиперкоагуляция. Поэтому больные после таких реконструктивных операций первые сутки должны находиться в отделении интенсивной терапии, где им проводят круглосуточный мониторинг центральной гемодинамики и через каждые 3—6 ч определяют уровень гемоглобина и показатель гема-токрита. Всем больным рекомендовано поддерживать уровень гемоглобина в пределах 110 г/л и гематокрита ниже 35 ед. Этих показателей удается придерживаться в случае использования аутокрови, взятой у больного в объеме 350—400 мл за сутки до операции. Больные в раннем послеоперационном периоде должны получать дезагреганты и реологические растворы. У пациентов с нарушениями лим-фовенозного дренирования и при реконструкции артерий голени показано назначение прямых антикоагулянтов. Гепарин вводят через инфузомат в суточной дозе 20 000—25 000 ЕД под контролем времени свертывания крови (не менее 15 мин) в течение 3—5 сут с последующим переводом пациента на подкожное введение в течение 7 дней. Перед выпиской пациента оценивают дистанцию безболевой ходьбы (тредмил-тест) и определяют ЛПИ. На амбулаторном этапе лечения после реконструктивных операций больным рекомендуют постоянно принимать ацетилсалициловую кислоту по 100 мг в день постоянно (если нет заболеваний желудка), 2—3 раза в год проходить 1—2-месячные курсы лечения таблетированными препаратами в сочетании с физиотерапевтическим лечением. После сосудистых операций больные нетрудоспособны в течение 1 — 3 мес. Летальность при реконструктивных операциях на артериях ниж- них конечностей составляет менее 1 %, причина летальных исходов — в основном осложнения ИБС. Проходимость сосудов через год после операции представлена в табл. 7.1. Как видно из табл. 7.1, на проходимость реконструированных сосудов влияет как уровень наложения дистального анастомоза, так и используемый пластический материал. Благоприятный прогноз течения окклюзирующего процесса в артериях нижних конечностей сомнителен, так как без адекватного лечения прогрес-сирование ишемии приводит к ампутации нижней конечности. Таким образом, при выявлении окклюзии магистральных артерий конечности показано комплексное лечение, соответствующее степени ишемии конечности. Проводимое лечение должно быть ориентировано не только на сохранение конечности, но и на сохранение и улучшение качества жизни пациента. Дата добавления: 2015-02-06 | Просмотры: 1360 | Нарушение авторских прав |