|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Данным методом определяется лишь человеческая эластаза, поэтому на результаты теста не влияет проведение заместительной ферментной терапииСледует отметить, что не существует какой-либо закономерной взаимосвязи между эластазой кала и содержанием нейтрального жира, мышечных волокон, жирных кислот и мыл при копрологическом исследовании. Эта мысль является концептуальной для понимания того факта, что клинически выраженный синдром мальабсорбции у больных панкреатитом может быть обусловлен не только первичной внешнесекреторной недостаточностью ПЖ, но и другими нарушениями (инактивация панкреатических ферментов, нарушение всасывания в тонком кишечнике и др.).
3. Инструментальная диагностика билиарнозависимого ХП
Трансабдоминальное ультразвуковое исследование (УЗИ) при использовании современного оборудования с датчиком, обеспечивающим широкое поле обзора и высокую разрешающую способность, с компьютерной цифровой обработкой изображения, в большинстве случаев оказывается достаточным для качественной визуализации всех отделов ПЖ, ее паренхимы и протоковой системы (таблица 2). Для ХП вне обострения характерно гетерогенное повышение эхогенности ПЖ. Область хронического воспалительного процесса, фиброза или кальцинаты в паренхиме представляются в виде отдельных участков повышенной эхогенности. В зависимости от размеров пораженных участков наблюдается микро- и макронодулярная сонографическая структура паренхимы, наиболее выраженная в случае кальцифицирующего панкреатита. Некоторые кальцинаты, обычно крупные, дают «акустическую тень». Часто, при выраженном повышении эхогенности всей паренхимы ПЖ, конкременты выявляются только по наличию «акустических теней». Линейное расположение указывает на их расположение в ГПП. Нередко выявляется значительное расширение протока, дистальнее расположенных в нем конкрементов. Выявление крупных гипоэхогенных участков на фоне повышения эхогенности паренхимы указывает на наличие активного воспалительного процесса — обострения ХП. Таблица 2.
Приблизительно в 30% случаев ХП контур ПЖ представляется размытым, неровным, или даже зазубренным, что, вероятно, является артефактом, вызванным гетерогенностью паренхимы и снижением четкости границы между и перипанкреатической клетчаткой. Таким образом, границу между ПЖ и окружающей тканью при ХП нельзя точно определить отчасти вследствие того, что зазубренный контур может быть не краем собственно железы, а лишь границей наиболее периферических мелких участков фиброза. В других случаях контуры ПЖ могут быть ровными, без зазубрин, но с крупными гладкими выступами, «горбами», нарушающими в некоторой степени форму железы. При ХП вне обострения размеры железы нормальные или уменьшены, иногда значительно, так что в проекции ПЖ может визуализироваться лишь расширенный ГПП с плотными стенками, иногда проток изогнут вследствие фиброза окружающей ткани. Ультразвуковым признаком прогрессирующего фиброза и уменьшения размеров ПЖ является увеличение расстояния между ПЖ и аортой более 20 мм. Увеличение размера ПЖ однозначно свидетельствует об обострении ХП, либо об объемном образовании ПЖ. Увеличение чаще бывает локальным, связанным с сегментарным отеком. Визуализация в пределах локального отека расширенного ГПП подтверждает наличие активного воспалительного процесса. При отеке в области головки ПЖ возможно сдавление общего желчного протока, приводящее к расширению последнего выше области обструкции на большом протяжении. Считается, что диагностика «классического» ХП очень надежна при УЗИ и применение КТ или ЭРХПГ только удорожает обследование и несет риск для больного, не давая дополнительной информации. Необходимость в применении последних двух методов возникает в случае невозможности визуализации каких-либо отделов ПЖ при УЗИ, при наличии объемных процессов в ПЖ, а также при так называемом «панкреатите минимальных изменений» (minimal change pancreatitis). Кроме того, УЗИ позволяет одновременно осмотреть печень, желчный пузырь, холедох, выявить явления гастро- и дуоденостаза, информация о которых может дополнить представление об этиологии, внепанкреатических осложнениях, дает возможность установить выпот в брюшной полости. Эндоскопическая ультрасонография (ЭУС) является высокоинформативным методом ультразвуковой диагностики заболеваний ПЖ, при котором сканирование проводится не через брюшную стенку, а через стенку желудка и ДПК. Такое приближение датчика к ПЖ позволяет детально изучить структуру ткани органа, состояние протоковой системы, провести дифференциальную диагностику панкреатита с раком ПЖ, оценить размеры парапанкреатических лимфоузлов, выявить конкременты протоковой системы ПЖ, холедоха и БДС. Большая роль отводится ЭУС для диагностики холедохолитиаза у больных билиарнозависимыми формами панкреатитов, поскольку ЭУС обладает существенно большей чувствительностью, чем трансабдоминальное УЗИ. Кроме того, ЭУС позволяет с большой точностью выявлять участки панкреонекроза и перипанкреатических жидкостных скоплений, что может играть большое прогностическое значение при тяжелых формах панкреатитов. Ряд авторов считают, что ЭУС и ЭРХПГ равноценны в диагностическом отношении, а их результаты тесно коррелируют, однако при всех прочих условиях, ЭУС однозначно менее инвазивна, чем ЭРХПГ и вряд ли может существенно усугубить клинику панкреатита. Ещё более информативным является внутрипротоковое УЗИ, диагностическое значение которого в отношении панкреатитов, опухолей ПЖ и билиарного тракта, конкрементов ГПП и холедоха достигает 100%. Особенно целесообразно проводить внутрипротоковое УЗИ ПЖ для выяснения причины нарушения оттока секрета: при подозрении на аденому или рак фатерова соска. Этот метод позволяет также оценить двигательную активность сфинктера Одди и определить тип его дискинезии. Компьютерная томография (КТ) дает возможность поставить диагноз, прежде всего на стадии осложнения панкреатита, когда чаще всего обнаруживают кальцификацию, псевдокисты, поражение соседних органов, атрофию паренхимы ПЖ и малигнизацию. Пожалуй, единственно достоверным признаком неосложненнго ХП, который позволяет выявить этот метод, является изменение крупных протоков железы (дилатация или стенозирование). Чувствительность и специфичность КТ в значительной степени колеблются в зависимости от стадии заболевания и составляют 80-90%. В качестве критериев ХП по данным КТ можно использовать следующие признаки (таблица 3).
Таблица 3 Данные компьютерной томографии при ХП
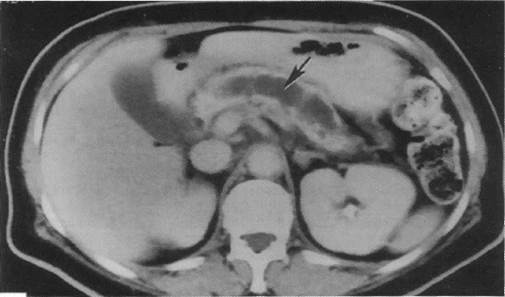
При обострении ХП выявляется увеличение ПЖ, нечёткость контуров, инфильтрация окружающих тканей. Признаком панкреатита может быть неоднородность структуры органа — за счёт неравномерного отёка и участков фиброза, кальцификатов и кальцинатов в ткани, в протоках ПЖ (кальцифицирующий панкреатит). Для поздних стадий ХП также характерно уменьшение размеров ПЖ и расширение вирсунгова протока (Рисунок 1). Фаза экссудации при панкреатите характеризуется экстравазацией панкреатического секрета со скоплением жидкости в пространствах брюшной полости. Главное преимущество КТ — меньшая частота неудач, затрудняющих обследование (тучность больных, наличие газа в толстой кишке и т.д.), как это наблюдается при УЗИ. Большинство авторов считают, что сочетание УЗИ и КТ достаточно эффективно при ХП, но если остаются какие-либо сомнения, следует прибегать к ЭРХПГ ввиду боле высокой диагностической информативности последней.
Рис. 1. Компьютерная томограмма поджелудочной железы у больного хроническим панкреатитом. Определяется значительно дилатированный главный панкреатический проток (показано стрелкой), вокруг значительно уменьшенная в размерах атрофированная паренхима поджелудочной железы.
Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) в настоящее вpeмя играет одну из ведущих ролей в диагностике панкреатитов, в большинстве современных научных публикаций и руководств именно ЭРХПГ приводится в качестве «золотого стандарта» диагностики ХП. ЭРХПГ позволяет выявить стеноз ГПП и определить локализацию обструкции, обнаружить структурные изменения мелких протоков, внутрипротоковые кальцинаты и белковые пробки, а также патологию общего желчного протока (стриктуры, холедохолитиаз и др.). Для ХП характерны неровность контуров протоков, их извилистость, участки стеноза и дилатаций — «чёткообразный» проток, кистозные расширения протоков — симптом «цепи озёр», ригидность стенок протоков, наличие в них конкрементов, расширение боковых ветвей, их укорочение и обрывы, замедление выхода контраста в ДПК. Сходные изменения могут иметь место и со стороны холедоха. Метод также позволяет получить чистый панкреатический сок и провести эндоскопическую биопсию ПЖ. Нужно помнить, что ЭРХПГ является инвазивной процедурой с невысокой диагностической результативностью при остром панкреатите и холангите. По этой причине, есть мнение, что вначале следует использовать УЗИ или КТ и прибегать к ЭРХПГ только в случае сомнительного диагноза. Осложнения связаны в первую очередь с тем с тем, что контраст вводится в ГПП ретроградно и под давлением. К наиболее частым осложнениям относят острый панкреатит, холангит, сепсис, аллергические реакции на йодсодержащий контраст, перфорацию двенадцатиперстной кишки и холедоха, кровотечении и др. Частота их колеблется от 0,8 до 36,0%, летальность составляет 0,15-1,0% случаев. Необходимо помнить, что в ряде случаев после ЭРХПГ наблюдается повышение лабораторных маркеров холестаза и цитолиза гепатоцитов. Поэтому для достижения хороших результатов чрезвычайно важными являются исключение больных с высоким риском осложнений и соответствующая предоперационная подготовка пациента с участием бригады врачей в составе хирурга, радиолога и эндоскописта. Эндоскопическое исследование. В последние годы вновь возникает интерес к использованию эндоскопического исследования желудка и ДПК, как метода диагностики ХП. Эзофагогастродуоденоскопия является необходимой для проведения ЭРХПГ и позволяет: • осуществлять эндоскопический осмотр ГПП, • выполнять селективный забор панкреатического сока для ферментного и морфологического исследования, • диагностировать патологию БДС, • выявить заболевания желудка и ДПК, являющиеся возможной причиной развития ХП. Манометрия сфинктера Одди заключается, в основном, в эндоскопическом введении манометрического зонда в область фатерова соска и в регистрации результатов с помощью подсоединенного датчика. Метод весьма дорог и может быть выполнен только в специализированных медицинских центрах. Недостатком метода также является большое число не стандартизированных технических особенностей, что объясняет достаточно большой диапазон сообщенных в литературе данных об успешном выполнении метода. Кроме того, высокая частота осложнений (преимущественно атака панкреатита) сообщенная в ряде исследований в диапазоне 9-33%, также ограничивают широкое применение этого метода. Обзорная рентгенография органов брюшной и грудной полости. В настоящее время рентгенологический метод уже не является методом диагностики ХП. Это связано не только с внедрением в практику УЗИ, КТ и МРТ, но и, в целом, с известным фактом - ПЖ по своей плотности почти не отличается от окружающих ее органов и тканей и поэтому обычно не обнаруживается с помощью обзорной рентгенографии. Чаще всего она позволяет определить только крупные кальцинаты в проекции ПЖ. Кальцификаты могут располагаться по ходу всей железы, повторяя ее форму, либо занимать только головку или дистальную часть органа. Камни могут прослеживаться цепочкой только по ходу ГПП либо создавать очаги, особенно в головке железы. Недостаточное знание рентгенологической картины калькулеза ПЖ нередко приводит к тому, что врачи при обнаружении характерных изменений на рентгенограмме предполагает холе- и нефролитиаза, обызвествление забрюшинных лимфоузлов и опухолей и даже следы бариевой взвеси в кишечнике. Кроме того, целесообразно провести рентгеноскопию органов грудной клетки, при которой иногда выявляются патогномоничные признаки осложнений тяжелой атаки ХП — левосторонний (реже двусторонний) экссудативный плеврит или дисковидный ателектаз нижней доли левого легкого, ограничение подвижности диафрагмы.
V. ЛЕЧЕНИЕ
Принципы лечения ОП и атак ХРП сходны. 1. Базисная терапия (этиотропное, антибактериальное лечение, обеспечение оттока панкреатического секрета, цитопротекция). 2. Патогенетическая терапия: · коррекция ферментно-ингибиторного дисбаланса (ФИД) в ткани ПЖ и в крови; · улучшение микроциркуляции, коррекция дисбаланса между коагуляцией и фибринолизом, профилактика ДВС-синдрома; · антиоксидантные средства; · иммуномодуляция; · нивелирование волемических и гемодинамических расстройств; · восстановление водно-электролитных нарушений; · борьба с эндотоксикозом; · лечение пареза кишечника. 3. Симптоматическая терапия: · адекватное обезболивание; · компенсация функциональной недостаточности ПЖ. Этиотропные мероприятия возможны при вторичных панкреатитах и обычно состоят в оперативном устранении причины заболевания. К таким вмешательствам можно отнести традиционную или лапароскопическую холецистэктомию при ЖКБ, оперативное устранение холедохолитиаза, папиллостеноза, гастродуоденальных язв (лечение язвенной болезни следует начинать с консервативного, которое эффективно в подавляющей части случаев). Хирургические вмешательства являются этиотропными при панкреатитах, развившихся вследствие некоторых вариантов дуоденостаза (например, при дуоденостазе после резекции желудка по Бильрот 2 декомпрессию ДПК обеспечивают путем реконструкции желудочно-кишечного соустья по Ру или редуонизации). Коррекция оттока секрета ПЖ проводится с помощью эндоскопической терапии, если нарушения носят органический характер (стенозирующий папиллит, кальцинаты в вирсунговом протоке и т.д.) или путем медикаментозного лечения, если нарушения носят функциональный характер (дуоденостаз, спазм или недостаточность сфинктера Одди). Еще до решения вопроса о направленности лечения следует выполнить два обязательных условия, без соблюдения которых даже самая верная и мощная терапия будет неэффективной: · отказ от алкоголя; · соблюдения жесткой диеты в зависимости от выраженности атаки от голода до стола №5п. Первоначальные задачи лечебного питания при обострении ХП сводятся к созданию функционального покоя ПЖ и другим органам проксимального отдела пищеварительного тракта. С этой целью больным рекомендуется полное прекращение орального приема воды и пищи, что позволяет если не остановить секрецию ПЖ, то, во всяком случае, снизить ее до уровня базальной секреции. Обеспечение организма необходимыми пищевыми веществами в период голодания и преобладания катаболических процессов осуществляется за счет нутритивной поддержки. Основные принципы диетотерапии больных ХП в период обостреия: · голод и нутритивная поддержка в период выраженных клинических и метаболических признаков аутолитического процесса в ПЖ; · переход к полноценному питанию по возможности в кратчайшие сроки, особенно это касается квоты белка; · постепенное включение блюд и продуктов в пищевой рацион при расширении диеты; · постепенное увеличение объема вводимой пищи и калорийности рациона при расширении диеты; · максимальное механическое и химическое щажение ПЖ и других органов проксимального отдела пищеварительного тракта. При обострении ХП с выраженным болевым синдромом, высокой ферментемией, амилазурией рекомендуются голод в течение 1-3 дней и прием 1-1,5 л в сутки щелочных минеральных вод («Боржоми», «Ессентуки №4», «Смирновская», «Славяновская», «Буковинская» и др) комнатной температуры, отвара шиповника (1-2 стакана), некрепкого чая. В период голодания назначают парентеральное питание – проводят внутривенные инфузии белковых гидролизатов и аминокислот (альбумин, гидролизаты казеина, аминокровин, альвезин, аминозол и др.), а также жировых эмульсий (липофундин, интралипид, клофибрат). Для подготовки к переходу на прием пищи парентеральное питание дополняют (или заменяют) зондовым энтеральным питанием (смесями «Инпитан», «Композит» и др.). При этом зонд с помощью эндоскопа устанавливают в тощей кишке. Энтеральное зондовое питание более физиологично, способствует нормальному функционированию тонкой кишки, предотвращает атрофию ворсинок тонкокишечного эпителия, увеличивает кровообращение в мезентериальных сосудах и создает функциональный покой для ПЖ. При энтеральном питании все три фазы экзокринной стимуляции ПЖ (церебральная, желудочная и кишечная) исключаются. Отсутствие дуоденального пассажа питательных веществ снижает энтеропанкреатическую стимуляцию, выброс антрального гастрина, секрецию соляной кислоты и, следовательно, секретина, который усиливает гидрокинетическую функцию ПЖ и желчеобразование. Противопоказаниями к энтеральному зондовому питанию являются: парез кишечника, полная тонко- или толстокишечная непроходимость, неукротимая рвота, высокая кишечная фистула, ишемия кишечника, несостоятельность межкишечного анастомоза. Основой лечебного питания при ХП является стол №5п (панкреатический). Диета должна быть механически и химически щадящей, малокалорийной и содержащей физиологическую норму белка (с включением 30% белка животного происхождения). Так как жидкая пища и углеводы в наименьшей степени стимулируют панкреатическую и желудочную секрецию, пероральное питание начинают со слизистых супов, жидких протертых молочных каш, овощных пюре и киселей из фруктового сока. При расширении диеты строго соблюдается принцип постепенности как в отношении увеличения объема и калорийности рациона, так и в отношении включения в него отдельных блюд и пищевых продуктов. Необходимо принимать во внимание возможные отрицательные эффекты на течение заболевания длительного редуцированного питания, а, следовательно, перевод больных на полноценный пищевой рацион должен осуществляться в кратчайшие, по возможности, сроки, особенно это касается белковой части рациона, так как достаточное количество белка необходимо для обеспечения синтеза ингибиторов панкреатических ферментов. Исключаются продукты, вызывающие метеоризм, содержащие грубую клетчатку, богатые экстрактивными веществами, стимулирующие секрецию пищеварительных соков (мясные и рыбные бульоны, грибные и крепкие овощные отвары, жирные сорта мяса и рыбы; жареные блюда, сырые овощи и фрукты, копчености, консервы, колбасные изделия, сдобные и свежевыпеченные мучные и кондитерские изделия, черный хлеб, мороженое, алкоголь, пряности и специи). Всю пищу готовят в вареном виде, на пару жидкой или полужидкой консистенции. Режим питания дробный (5-6 раз в сутки). Перечень рекомендуемых продуктов и блюд: сухари, супы слизистые из различных круп, мясо и рыба нежирных сортов, яйцо всмятку, паровой омлет, молоко только в блюдах, творог свежеприготовленный некислый, паровые пудинги. Несоленое сливочное масло можно добавлять в готовые блюда, овощи в виде пюре, яблоки в печеном виде, исключаются антоновские. Разрешаются протертые компоты из сухих и свежих фруктов, кисели, желе, мусс на ксилите, сорбите; чай некрепкий, минеральная вода, отвар шиповника. Подобную диету больным необходимо назначать еще 3-4 дня. Затем можно перевести больного на механически щадящий вариант диеты на 3-8 недель. А затем при стойкой ремиссии разрешить вариант диеты без механического щажения. Традиционное питание больных хроническим панкреатитом в периоде ремиссии должно содержать повышенное количество белка – 120-140 г/сутки, 60% белка должно быть животного происхождения. Рекомендуется пониженное количество жиров (60-80 г/сутки), причем количество жира должно быть равномерно распределено на все приемы пищи в течение дня. Жиры в чистом виде из рациона исключаются вовсе. Рацион должен содержать около 350 г углеводов в сутки, главным образом за счет простых легкоусвояемых. Общий калораж должен составлять 2500-2800 ккал/сутки. Также ограничивается в рационе поваренная соль (до 6 г в сутки). Даже при значительном улучшении состояния здоровья и кажущемся благополучии не следует допускать резких нарушений ни со стороны качественного содержания диеты, ни со стороны питания. Диета больных в этом периоде включает в основном те же продукты, что и при обострении, только блюда могут быть менее щадящими: протертые супы заменяют обычными вегетарианскими, каши могут быть более густыми, рассыпчатыми, включаются макаронные изделия, растительная клетчатка в сыром виде (овощи и фрукты), могут включаться мягкие неострые сыры, докторская колбаса, отварное мясо кусками, печеная рыба. Пищу готовят в протертом виде, на пару или запекают в духовке. Режим питания дробный (5-6 раз в день), приемы пищи рекомендуются небольшими по объему порциями. Обязательным дополнением этому принципу является медленная еда и тщательное пережевывание пищи. Перечень рекомендуемых продуктов и блюд: хлеб пшеничный, подсушенный, несдобное печенье, вегетарианские овощные супы (капуста исключается), крупяные супы (кроме пшена) протертые или слизистые с добавлением небольшого количества сливочного масла или сметаны. Мясо и рыба нежирных сортов в отварном или паровом виде (котлеты, фрикадельки, бефстроганов, пюре, суфле, рулет и пр.); курица, кролик, индейка, треска, окунь, щука, судак, сазан разрешаются в отварном виде куском или рубленная; белковый омлет, творог свежеприготовленный некислый, паровые пудинги. Сыр голландский, российский. Каши из различных круп, протертые полувязкие, готовятся на воде или пополам с молоком. Овощи отварные и запеченные в протертом виде (морковь, тыква, кабачки, картофель, цветная капуста, зеленый горошек, молодая фасоль, свекла), яблоки в печеном виде, исключаются антоновские. Разрешаются протертые компоты из сухих и свежих фруктов, кисели, желе, мусс на ксилите, сорбите; чай некрепкий с лимоном, фруктово-ягодные соки без сахара, разбавленные водой, отвар шиповника или черной смородины. Таким образом, целью назначения указанной диеты является: · обеспечение полноценного питания больного; · создание функционального «комфорта» ПЖ, что способствует профилактике воспалительно-дегенеративных явлений в ПЖ и восстановлению ее функциональной способности; · обеспечение химического щажения ПЖ и других органов желудочно-кишечного тракта; · предотвратить развитие жировой инфильтрации печени; · уменьшить рефлекторную возбудимость желчного пузыря. Купирование боли. Для купирования боли при обострении ХП используют препараты, обладающие спазмолитической активностью, ликвидирующие спазм сфинктера Одди, восстанавливающие отток панкреатического сока, уменьшающие внутриорганное давление. Атропин- 1 мл 0,1% раствора подкожно 2-3 раза в день; Метацин – 1 мл 0,1% раствора подкожно 2-3 раза в день; Гастроцепин – по 0,05 г 2-3 раза в день в таблетках; Папаверин – по 2 мл 2% раствора; Но-шпа – по 2-4 мл 2% раствора; Анальгин – по 2 мл 50% раствора внутримышечно 2-3 раза в день; Баралгин – по 5 мл внутримышечно 2-3 раза в день; Новокаин – 100 мл 0,25% раствора внутривенно капельно; Эуфиллин – 10 мл 2,4% раствора внутривенно медленно; Нитроглицерин – по 0, 0005 г под язык Нейролептаналгезия – вводится внутривенно 1-2 мл 0,005% раствора наркотического анальгетика фентанила и 1-2 мл 0,25% раствора нейролептика дроперидола в 10 мл изотонического раствора натрия хлорида. Среди препаратов, снижающих тонус сфинктера Одди, обращает на себя внимание одестон. Препарат оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, а также усиливает образование и отделение желчи, т.е. снимает давление во внутри- и внепеченочной билиарной системе. Выраженным спазмолитическим действием в отношении сфинктера Одди обладает дюспаталин (мебеверин). Этот препарат в 20-40 раз эффективнее папаверина по способности релаксировать сфинктер Одди. Кроме того, дюспаталин нормализует тонус кишки, т.е. устраняет гиперперистальтику и спазм, не вызывая гипотонии. При недостаточности сфинктера Одди (дуодено- или билиопанкреатический рефлюкс) следует назначать прокинетики: метоклопрамид, мотилиум, сульпирид или координакс в средних терапевтических дозах. На практике часто трудно решить, что предпочесть – спазмолитики или гастрокинетики. Этот вопрос помогает решить, кроме ЭРХПГ и эндоскопического УЗИ, проба с морфином и нитроглицерином. Если морфин усиливает боль, а нитроглицерин – уменьшает, то следует думать о спазме сфинктера Одди. Универсальным корректором моторики пищеварительного тракта, в том числе сфинктера Одди, является дебридат (тримебутин малеат), который назначают по 1-2 табл. (100-200 мг) 3 раза в день. Действуя на энкефалинергическую систему кишечника и обладая сродством к рецепторам подавления и возбуждения, препарат оказывает стимулирующее действие при гипокинетических состояниях гладкой мускулатуры кишечника и спазмолитическое – при гиперкинетических, корригируя и тонус сфинктеров. Антибактериальной терапии придают одно из центральных мест в лечении панкреатитов, т.к. в ряде случаев она является этиотропной, а также предупреждает развитие инфекционно-гнойных осложнений ОП, ХРП, предотвращает транслокацию микробной флоры из просвета кишки в брюшную полость. Доказана возможность проникновения бактерий в ПЖ четырьмя путями: гематогенным, восходящим из ДПК или общей части холедоха и вирсунгова протока, из портальной вены, путем транслокации из кишки через лимфатические пути, т.к. у больных повышается кишечная проницаемость. При выборе антибактериального препарата следует учитывать их следующие качества: · степень проникновения в ткань ПЖ; · выраженность эффекта относительно микробной флоры, наиболее часто встречающейся при ОП и ХРП; · наличие у препарата панкреотоксичности. В зависимости от способности проникать в ткань ПЖ выделяют три группы антибактериальных препаратов: · препараты, хорошо проникающие в ткань ПЖ и создающие в ней концентрации, значительно превышающие минимально подавляющую, - карбапенемы, фторхинолоны (ципрофлоксацин и, особенно, пефлоксацин), клиндамицин, мезлоциллин. Метронидазол также достигает бактерицидной концентрации в ткани ПЖ для анаэробных бактерий, поэтому его целесообразно использовать в комбинации с цефалоспоринами III-IV поколения. При грибковом поражении ПЖ препаратом выбора является флуконазол; · препараты, тканевая концентрация которых в ПЖ при внутривенном введении превышает минимально подавляющую. В эту группу входят защищенные пенициллины (тазобактам и тикарциллин), а также цефалоспорины III (цефоперазон и цефотаксим) и IV (цефепим) поколений; · препараты, плохо проникающие в ПЖ, доза которых в ее ткани не достигает минимально подавляющей – аминогликозиды, цефалоспорины I поколения, тетрациклины, аминопенициллины. Чаще других обнаруживают E. coli и Staph. aureus. Для их подавления рекомендуют цефуроксим в виде внутривенных вливаний по 1,5 г 3 раза в день, клацид по 500 мг 2 раза в день до клинического выздоровления. Из других антибактериальных средств эффективны тиенам, цефтазим, амикацин и метронидазол. Для борьбы с псевдомонадами, энтерококком, стафилококком и грибами рода Candida назначают ванкомицин, имипенем и флуконазол. При ОП, особенно некротизирующем, важен перитонеальный лаваж в течение 5-7 суток, который снижает вероятность сепсиса. Развитию аутолиза способствует «поломка» механизмов самозащиты ПЖ. Целостность мембран панкреацитов обусловлена по существу динамическим равновесием между утратой поврежденных структур (фосфолипидов) и притоком вновь синтезированных молекул. Поэтому назначение мембраностабилизаторов (цитопротекторов) относится к базисной терапии гиперферментемических панкреатитов. Препаратом выбора является Эссенциале Н. Особенно эффективен Эссенциале Н при ОП, ХРП алкогольной этиологии, т.к. препарат хорошо проникает через мембраны панкреацитов и ускоряет метаболизм этанола. Эссенциальные фосфолипиды не только восстанавливают поврежденные мембраны, но и защищают целостные мембраны от повреждения и, что является особенно важным прогностическим критерием, замедляют индуцированный ацетальдегидом синтез коллагена. Эссенциальные фосфолипиды подавляют синтез провоспалительных цитокинов, играющих важную роль в патогенезе панкреатитов; влияют на агрегацию эритроцитов и тромбоцитов; повышают антиоксидантные функции мембран; оказывают гипогликемический эффект, увеличивая чувствительность инсулиновых рецепторов; благодаря своим гидрофильным и гидрофобным свойствам, являются эмульгаторами желчи и обеспечивают ее нормальное коллоидное состояние, что особенно важно при билиарных панкреатитах. Эссенциале Н назначается внутривенно по 500-750 мг (2-3 ампулы) в сутки 10 дней, а затем по 1800 мг в сутки (по 2 капсулы 3 раза в день) длительно -2-3 месяца. Коррекция ферментно-ингибиторного дисбаланса (ФИД) является центральным звеном патогенеза панкреатитов. Основным патогенетическим принципом лечения гиперферментных панкреатитов является снижение функциональной активности ацинарных клеток – подавление продукции ими ферментов. Этот принцип – создание функционального покоя ПЖ. Функциональный покой ПЖ может быть обеспечен двумя путями: снижением стимулирующих влияний на внешнесекреторную функцию и воздействие на сами панреациты. Созданию функционального покоя ПЖ способствует диета со значительным ограничением жира, а при выраженном болевом синдроме – голод. При голодании назначают парентеральное питание белковыми гидролизатами и жировыми эмульсиями, которые имеют и антиферментное значение, являясь мишенями для иммобилизации циркулирующей в крови липазы. При панреонекрозе, выраженном болевом синдроме голод и парентеральное питание могут быть недостаточно эффектины. В этих случаях для подавления секретинового механизма стимуляции панкреатической секреции проводят аспирацию желудочного идуоденального содержимого через назогастродуоденальный зонд с приемом дегазированных щелочных минеральных вод. Для создания функционального покоя ПЖ назначают регуляторные пептиды – соматостатин, кальцитонин, даларгин. Соматостатин (сандостатин, октреотид) – выражено подавляет продукцию секретина, панкреозимина, соляной кислоты, пепсина, нервную стимуляцию ПЖ, стимулирует высвобождение кальцитонина, препятствует вхождению кальция в панкреациты и гастриноциты. В результате этого значительно снижается синтез ПЖ ферментов, бикарбонатов, уменьшается объем секрета. При ОП проводят инфузию сандостатина в течение 12 часов со скоростью 3-3,5 мкг/кг массы тела в час, затем 100-200 мкг подкожно 2-3 раза в день 5-14 дней; при ХРП вводят 0,05-0,1 мг подкожно 2 раза в день 5-7 дней. В практику лечения панкреатитов в последние годы входят пролонгированные формы сандостатина – соматулин (ланреотид), эффект которого продолжается 10-14 дней; сандостатин ЛАР, инъекция которого производится один раз в месяц. Даларгин – синтетический аналог лейэнкефалина – снижает желудочную и панкреатическую секрецию, имеет аналгезирующую, антидепрессивную активность. При ОП назначают 1 мл внутримышечно 4-5 раз в день, при ХРП – 2 раза в день. Сходное с даларгином, но более выраженное действие оказывают синтетические пептиды глюдалан и тагефлар. Калицитонин (миакальцик) – снижает продукцию ферментов ПЖ за счет уменьшения уровня кальция в крови (подавляет его выход из костей). Препарат особенно показан при гиперпаратиреозе; не влияет на моторику ЖКТ, обладает анальгетическим эффектом. Назначается в дозе 5 МЕ/кг массы тела внутримышечно 2 раза в день при ХРП или внутривенно при ОП. Блокаторы Н2-гистаминовых рецепторов (циметидин, ранитидин, фамотидин) – снижают желудочную секрецию и, тем самым, уменьшают секретиновую стимуляцию ПЖ. Показано внутривенное введение кваматела по 20 мг 2 раза в день. М-холинолитики (атропин, метацин, платифиллин, бускопан, хлорозил, белластезин, гастроцепин) – издавна применяются при гиперферментных панкреатитах, т.к. ПЖ имеет преимущественно вагусную иннервацию. Препараты уменьшают реакцию на парасимпатическую импульсацию, в результате значительно снижаются желудочная и панкреатическая секреция, развивается спазмолитический эффект, в том числе в отношении сфинктера Одди. В последние годы с успехом назначают бускопан по 10 мг 3 раза в день или по 1 мл подкожно 2-3 раза в день. Гастроцепин при ОП – 20-30 мг в сутки в 2-3 приема внутривенно медленно или капельно, при ХРП – 50 мг 2-3 раза в день внутрь или 10 мг (2 мл) внутримышечно 2 раза в день. М-холинолитики нежелательны при дуоденостазе. Блокаторы протоновой помпы (омепразол, пантопразол, ланзопразол, рабепразол, эзомепразол) – резко подавляют синтез соляной кислоты париетальными клетками слизистой желудка, из-за чего существенно снижают выработку секретина и внешнесекреторную активность ПЖ. В результате препараты оказывают выраженный обезболивающий эффект при панкреатитах у больных, резистентных к блокаторам Н2-гистаминовых рецепторов. Рекомендуемые дозы: омепразол – внутрь по 20 мг однократно или двукратно, ланзопразол – внутрь по 30 мг однократно, пантопразол – внутрь по 40 мг однократно, рабепразол – внутрь по 20 мг дважды в день. Антациды – снижают продукцию секретина под влиянием соляной кислоты, чем способствуют функциональному покою ПЖ. Современным антацидным препаратом является маалокс. Применгяют по 1 п. 3-4 раз в день. Заместительная полиферментная терапия. Показаниями для проведения заместительной ферментной терапии при ХП являются: · стеаторея при условии потери с калом более 15 г жира в сутки; · прогрессирующая трофологическая недостаточность при адекватности калоража ежедневного рациона; · стойкий диарейный синдром и диспептические жалобы. Основой большинства ферментных препаратов являются амилаза,протеазы, липаза животного происхождения, содержащиеся в панкреатине из ПЖ свиней. Липаза гидролизует нейтральный жир, амилаза расщепляет внеклеточные полисахариды – крахмал, гликоген – но не участвует в переваривании растительных оболочек. Протеазы, основным из которых является трипсин, расщепляют белки. Применяются следующие группы ферментных препаратов: I. Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин (абомин, ацидин-пепсин, пепсидил, пепсин К). II. Препараты панкреатина, основными ферментами которых являются липаза, амилаза, протеазы (панкреатин, мезим-форте, ликреаз, трифермент, панцитрат и др.). III. Комбинация панкреатина с дополнительными компонентами: 1. С компонентами желчи, гемицеллюлазой (фестал, дигестал, энзистал и др.). 2. С диметиконом, симетиконом (пепфиз, панкреофлат, энзимтал, юнэнзим). 3. С пепсином, аминокислотами, HCL, холевой кислоты (панзинорм-форте). IV. Препараты на основе растительных (или фунгальных) ферментов (энзимтал, пепфиз, ораза, солизим и др.). V. Препараты-комбинации панкреатина с растительными (или фунгальными) ферментами: 1. Панкреаль Киршнера. 2. Комбинации (панкреатин и экстракт рисового грибка). VI. Препараты на основе лактазы (лактраза, тилактраза). Основная цель заместительной терапии панкреатическими ферментами заключается в обеспечении достаточной активности липазы в ДПК. Известно, что воздействие соляной кислоты на панкреатические ферменты приводит к разрушению до 90% их количества, поэтому путем преодоления кислотного желудочного барьера явилось создание полиферментных препаратов в кислотоустойчивой оболочке. Использование кислотоустойчивых форм панкреатических ферментов ставит два существенных условия: 1. Интрагастральные значения рН не должны превышать 5, так как в этом случае ферменты будут освобождаться от энтеросолюбильной оболочки уже в желудке. В этом случае часть ферментов будет необратимо разрушена при реацидификации. 2. Интрадуоденальные значения рН должны быть не ниже 5,5 для адекватного высвобождения ферментов в ДПК. Большинство ферментных препаратов выпускается в виде драже или таблеток в кишечно-растворимых оболочках, размер большинства таблеток или драже составляет 5 мм и более. Тем не менее, известно, что из желудка одновременно с пищей могут эвакуироваться твердые частицы, диаметр которых составляет не более 2 мм при оптимальном размере 1,4 мм. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в межпищеварительный период, когда пищевой химус отсутствует в ДПК. В результате препараты не смешиваются с пищей и недостаточно активно участвуют в процессах пищеварения. В то же время, если таблетка или драже длительное время находятся в желудке, энтеросолюбильная оболочка разрушается, а находящиеся внутри ферменты инактивируются. Для обеспечения быстрого и гомогенного смешивания ферментов с пищевым химусом, предотвращения внутрижелудочной инактивации и адекватного пассажа из желудка в ДПК были созданы ферментные препараты панкреатина нового поколения в виде микросфер, диаметр которых не превышает 2 мм. Препараты покрыты энтеросолюбильными оболочками и заключены в желатиновые капсулы. При попадании в желудок желатиновые капсулы быстро растворяются, микросферы смешиваются с пищей и постепенно поступают в ДПК. При рН дуоденального содержимого выше 5,5 оболочки растворяются, и ферменты начинают действовать на большой поверхности. При этом практически воспроизводятся физиологические процессы пищеварения, когда панкреатический сок выделяется порциями в ответ на периодическое поступление пищи из желудка. Таким образом, именно микросферические препараты можно отнести к самым современным полиферментным средствам для заместительной ферментной терапии, в том числе отвечающим современным требованиям: · препараты должны быть животного, преимущественно свиного происхождения; · содержание достаточного количества ферментов, обеспечивающих полный гидролиз нутриентов в полости ДПК; · наличие оболочки, защищающих ферменты от переваривания желудочным соком; · равномерное и быстрое перемешивание с пищей; · одновременный пассаж ферментов с пищей; · быстрое освобождение ферментов в верхних отделах тонкой кишки; · отсутствие желчных кислот в составе препарата; · безопасность, отсутствие токсичности. Лекарственным средством, полностью удовлетворяющим вышеуказанным требованиям и используемым в последнее время, является полиферментный препарат в виде микросфер (Креон 10000 и Креон 25000), покрытых энтеросолюбильной оболочкой. К редким возможным побочным эффектам, возникающим при приеме полиферментных препаратов, следует отнести: болезненные ощущения в ротовой полости; раздражение кожи в перианальной области; дискомфорт в животе; гиперурикемию; аллергические реакции; нарушение всасывания фолиевой кислоты. Наиболее тяжелое осложнение, возникающее при длительном приеме очень высоких доз полиферментных препаратов – фиброз терминальной части подвздошной кишки и правых отделов ободочной кишки, или фиброзная колопатия. Причины неэффективности заместительной ферментной терапии могут быть следующими: · неправильно установленный диагноз; · наличие сопутствующей ХП патологии, утяжеляющей синдром мальабсорбции и требующий специфического лечения (глютеновая энтеропатия, воспалительные заболевания кишечника, тиреотоксикоз, глистные инвазии и т.д.); · назначение препаратов панкреатина, не имеющих кислотозащитной оболочки (панкреаль Киршнера) без блокаторов желудочной секреции; · назначение таблетированных препаратов панкреатина в энтеросолюбильной оболочке (асинхронный гастродуоденальный транспорт); · назначение желчьсодержащих препаратов, усиливающих перистальтику и вызывающих осмотическую диарею; · назначение неадекватно низких доз ферментов для снижения общей стоимости лечения; · недоучет возможных механизмов, приводящих к вторичной панкреатической недостаточности (желудочная гиперсекреция с ацидификацией ДПК, цирроз печени, синдром избыточного бактериального роста и т.д.). Влияние на следствия ферментно-ингибиторного дисбаланса (ФИД). Важнейшее следствие ФИД в ткани ПЖ – активация калликреин-кининовой системы, приводящая к нарушению микроциркуляции, усугублению отека органа, нарушению соотношения между коагуляцией и фибринолизом, гипергистаминемии и гиперсеротонинемии. Традиционными средствами торможения активности калликреин-кининовой системы являются антиферментные препараты или ингибиторы протеаз, которые делятся на две группы: естественные (апротинин, пантрипин и их аналоги – контрикал, гордокс, трасилол, цалол) и искусственные (ε-аминокапроновая кислота, метилурацил, пентоксил). Естественные ингибиторы изготавливают из ПЖ, слюнных желез, легких животных. Препараты снижают активность в крови калликреина, вследствие чего замедляется синтез брадикинина, и уменьшается отек ПЖ, интенсивность боли. Антиферментные препараты быстро выводятся из кровеносного русла, практически не проникают в ткань ПЖ и поэтому не могут подавлять тканевой ФИД и ограничивать очаг аутолиза. Кроме того, вышеперечисленные средства не влияют на активность фосфолипазы А2, которая играет важную роль в патогенезе заболевания. Все это указывает на необходимость сочетания в лечении гиперферментных панкреатитов препаратов, обеспечивающих функциональный покой ПЖ с ингибиторами протеаз. Назначение лишь одних ингибиторов можно сравнить с лечением ожога, на который продолжает действовать покой. Но это не значит, что от ингибиторов протеаз следует отказаться. Они оказывают выраженный противоотечный эффект в отношении ПЖ в условиях «кининового взрыва», поэтому уменьшают боль. Кроме того, апротинин временно угнетает внутриклеточный синтез белка, а значит и экзокринную функцию ПЖ, уменьшает дисфункцию тромбоцитов, является одним из основных средств купирования геморрагических проявлений ДВС-синдрома, когда скорость фибринолиза выше скорости свертывания. Контрикал назначают в дозе 20-100 тысяч аТрЕ, трасилол – 50-200 тысяч КИЕ, гордокс -100-200 тысяч КИЕ в сутки внутривенно капельно в 2-3 приема. Предпочтение среди естественных ингибиторов в настоящее время отдают низкомолекулярному препарату FOY (габексат), который назначают по 0,1 г (растворяют в 500 мл 5% глюкозы) внутривенно капельно 7-10 дней. Доказано, что FOY проникает в панкреациты, уменьшает выраженность спазма сфинктера Одди. Эффект искусственных ингибиторов уступает влиянию естественных препаратов, поэтому как самостоятельное средство их применяют при легких формах ХРП. Рекомендуемые дозы ε-аминокапроновой кислоты – 5% раствор 150,0-200,0 внутривенно капельно 1-2 раза в день 10-12 дней, а затем внутрь по 1 г 3 раза в день. Положительным свойством аминокапроновой кислоты является ее неспецифический десенсибилизирующий эффект. Показанием для ингибиторов протеаз является феномен «уклонения» ферментов в кровь. При ОП, тяжелых атаках ХРП применяют свежезамороженную плазму (500-1000 мл/сут), альбумин, содержащие естественные ингибиторы протеолитических ферментов. Рекомендуют переливать 200 мл альбумина ежедневно первые 4-5 дней от начала ОП. Для решения вопроса о лечении конкретного больного ОП или ХРП предлагают ступенчатую схему коррекции ФИД. Такой подход предусматривает переход на более высокую ступень на любом этапе при неудовлетворительных результатах лечения и постепенный переход вниз при достижении хорошего эффекта. Каждая ступень представляет собой базисную терапию в сочетании с другими медикаментами. Базисная терапия – это коррекция оттока панкреатического секрета, возможные этиотропные мероприятия, антибактериальные препараты и цитопротекторы. I ступень – базис + гастроцепин per os + Н2-блокатор per os + ФП. II ступень – базис + гастроцепин парентерально + блокатор протоновой помпы per os или Н2-блокатор парентерально + ФП + ε-аминокапроновая кислота. III ступень – базис + атропин парентерально + блокатор протоновой помпы желательно парентерально + естественный ингибитор. IV ступень – III ступень + 5-фторурацил или рибонуклеаза, или сандостатин, или гемосорбция, или их сочетание. Коррекция нарушений микроциркуляции проводится гепарином до 50 тыс ЕД в сутки, ноотропилом, тренталом, курантилом, реополиглюкином. Для предупреждения и лечения ДВС-синдрома рекомендуют внутривенные инфузии никотиновой кислоты 3 мг/кг, эуфиллина 10 мг/кг, реополиглюкина 15 мг/кг, контрикала 100 ЕД/кг, гепарина 50 тыся ч ЕД в сутки. Контроль уровня электролитов и рН – при алкалозе проводят инфузии 7,4% раствора хлористого калия, а при ацидозе – 5% раствора соды. При электролитных нарушениях вводят гипертонические растворы солей калия, натрия, кальция. К этим инфузиям целесообразно добавлять внутримышечное введение анаболических стероидов, аскорбиновой кислоты, витаминов В1 и В6. Они способствуют уменьшению проницаемости капилляров, усиливают антибактериальный эффект антибиотиков. Для снижения выраженности аутолитических процессов ПЖ применяют антиоксиданты, адаптогены – кавинтон, рибоксин, метионин, аскорбиновую кислоту, витамины РР, К, аевит, токоферола ацетат, мексидол, унитиол, Эссенциале Н, липоевую кислоту, цернитин, селен Иммуномодуляция особенно важна при гиперферментных панкреатитах, так как трипсин, антиметаболиты и антиферментные препараты обладают иммунодепрессивными свойствами. Выбор иммуномодулирующего препарата зависит от варианта иммунограммы больного. Могут быть назначены тималин, Т-активин, спленин, пентаглобин в обычных дозах. При ОП в случае лимфопении в сочетании с подавлением клеточного иммунитета применяют антилимфон однократно 0,8 мг/кг массы тела на растворе Рингера. При дефиците и клеточного, и гуморального звена назначают диуцифон – 4 мл 5% раствора внутримышечно 1 раз в день 3-4 дня. Коррекция гемодинамических нарушений, борьба с эндотоксикозом. Рекомендуют проводить инфузионную терапию неогемодезом, полидезом, желатинолем, мафусолом (последний уменьшает выраженность и повышает переносимость гипоксии). Традиционным и эффективным способом дезинтоксикации является форсированный диурез. Хорошие результаты дает назначение лактулозы (дюфалака). Препарат уменьшает интоксикацию, корригируя кишечную микрофлору (подавляет протеолитическую и стимулирует рост полезной сахаролитической флоры). Возможно удаление эндогенных токсических веществ с частью компонентов внутренней среды – замещение крови, плазмаферез, наружное отведение лимфы. Разработаны методы, моделирующие экскреторные механизмы детоксикации (перитонеальный диализ, гемо- или ультрафильтрация крови). Лечение пареза кишечника при ОП состоит прежде всего в купировании болевого синдрома и гиперсимпатикотонии. Для этого применяют новокаиновые блокады (эпидуральную, забрюшинную и др.), назначают ганглиоблокаторы, аминазин, бутироксан, пирроксан. Необходимо также проводить аспирацию желудочного содержимого, назначать антихолинэстеразные средства (прозеринин, калимин, убретид и др.). При неэффективности этих мероприятий показана электростимуляция кишечной моторики с помощью желудочных зондов-электродов или прямого электродействия на водитель ритма кишечной моторики. Основной задачей врача при лечении больных гипоферментными панкреатитами является уменьшение проявлений функциональной недостаточности ПЖ. Назначают стимуляторы продукции собственных ферментов ПЖ - эуфиллин или глюконат кальция вначале внутривенно один раз в день в течение 10-14 дней, а затем внутрь в течение трех-четырех недель. Повышение внешнесекреторной активности ПЖ можно достичь через стимуляцию желудочной секреции. Это особенно целесообразно при гастрогенном панкреатите, развившемся на фоне гипо- или анацидного гастрита. Таким больным в терапию включают плантаглюцид, ацидин-пепсин, пепсидил в обычных дозах. Способность стимулировать внешнюю секрецию ПЖ присуща желчным кислотам, а значит и желчегонным препаратам. Однако, их назначение возможно при отсутствии конкрементов в желчном пузыре и только вне обострения ХРП из-за возможности усиления боли и других проявлений заболевания. При неэффективности вышеперечисленных средств показаны ферментные препараты, замещающие и дополняющие продукцию собственных ферментов ПЖ. При гипотрофии необходимы анаболические стероиды (ретаболил, неробол и др.) в обычных дозах, коррекция анемии. При гипоферментных панкреатитах показаны витамины, рибоксин, липоевая кислота, трентал, курантил, гепарин, антиоксиданты и адаптогены (токоферола ацетат, витамин А). Для торможения пролиферации соединительной ткани назначают делагил по 1 таблетке (0,25) утром и вечером в течение месяца, а затем 1 таблетка на ночь длительно. Так как при гипоферментных панкреатитах часто развивается дисбиоз кишечника, то больным проводят терапию кишечными антисептиками с переходом на прием бактисубтила, коли-бактерина, бификола, линекса и других препаратов. Целессобразен длительный прием хилака-форте у больных с низкой желудочной секрецией и отсутствием признаков обострения ХРП. Ферментативная недостаточность ПЖ закономерно сопровождается метеоризмом и учащением стула. Для купирования этих проявлений целесообразно назначать смекту, которая обладает обволакивающим, закрепляющим эффектами, адсорбирует продукты гниения и брожения, токсины патогенных и условно патогенных бактерий, поселяющихся в тонкой и толстой кишке при энтеропанкреатическом синдроме и дисбиозе. Особенно обосновано применение смекты у больных, имеющих повышенную кислотообразующую функцию желудка, сопутствующие язвенную болезнь или эрозивный гастродуоденит, рефлюкс-эзофагит, так как смекта адсорбирует хлористоводородную кислоту, пепсин, H.pylori. Выраженный положительный эффект при метеоризме оказывает эспумизан по 1-2 капсулы или 1-2 чайные ложки эмульсии 3-5 раз в день. Действующее вещество эспумизана – симетикон – действует как пеногаситель, уменьшая поверхностное натяжение газовых пузырьков. При панкреатогенном сахарном диабете проводится коррекция углеводного обмена сахароснижающими препаратами.
Дата добавления: 2015-11-26 | Просмотры: 765 | Нарушение авторских прав |