 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИОННЫЕ КАНАЛЫЛогическим продолжением изучения ионных механизмов возбуждения нервных и мышечных клеток явилась разработка методики для регистрации токов через одиночные каналы. В 1980 г. немецкие ученые Ф. Сигворс и Э. Неер с помощью метода локальной фиксации смогли зарегистрировать ток через одиночный натриевый канал, открытый (активированный) с помощью деполяризации мембраны. Для этого они использовали стеклянную микропипетку (внешний диаметр кончика 2 мкм, внутренний около 0,5 мкм), в которую втягивали с помощью небольшого вакуума участок мембраны нервной клетки (рис. 2.11, А, Б). Клеточная мембрана плотно контактировала с кончиком пипетки, что препятствовало утечке тока. На ограниченном микропипеткой пространстве клеточной мембраны могли оказаться 1...2 отдельных канала. Ток, протекающий через открытый канал, подавался на вход усилителя, с помощью которого напряжение на данном участке мембраны фиксировалось по тому же принципу, как и в методике фиксации напряжения на всем участке мембраны нервного волокна или клетки. Оказалось,что токи через одиноч-
Мс Рис. 2.11. Ионные токи одиночных ионных каналов: А - схематическое изображение экспериментальной установки: 1- нервная клетка; 2- микропипетка; 3 - усилитель; стрелкой показано подведение небольшого вакуума для присасывания кончика микропипетки к участку мембраны нервной клетки; Б - в увеличенном масштабе показано прикрепление с помощью небольшого вакуума кончика микропипетки к участку мембраны нервной клетки: 2- кончик микропипетки; 4-высокоомный контакт между стенками пипетки и мембраной; 5- ионные каналы; 6- клеточная мембрана; стрелкой показано направление тока через открытый канал; В - электрические ответы одиночных каналов (а): вверху - ступенчатообразный деполяризационный сдвиг мембранного потенциала; Г. вверху-суммарный ионный ток из 144 ответов одиночных ионных каналов; внизу — калибровка времени 60 мс ные каналы подчиняются закону «все или ничего», имеют ступен-чатообразную форму с быстрым фронтом нарастания и спада, также одинаковы по амплитуде для разных каналов (рис. 2.11, В). Интересно отметить, что длительность пребывания каналов в откры-
На рисунке 2.11, Г представлен суммарный ток, полученный в результате сложения 144 ответов одного и того же участка мембраны. Динамика этого тока отражает распределение во времени открывания одиночных каналов на деполяризацию. Хорошо видно, что она сходна с временным ходом общего, макроскопического натриевого тока через мембрану в режиме фиксации напряжения при деполяризации мембраны (см. рис.2.10). Таким образом, функционирование ионных каналов, обеспечивающих генерацию потенциалов действия, зависит от величины напряжения на мембране; данный тип каналов получил название потенциалзависимых или потенциалуправляемых. Потенциалза-висимый канал представляет собой гликопротеид, находящийся в липидном бислое мембраны (рис. 2.12). Канал структурно связан с другими мембранными белками и элементами цитоскелета клетки. Макромолекула натриевого канала включает 1800...4000 аминокислот, организованных в одну или несколько полипептидных цепей с сотнями ковалентно связанных полисахаридных остатков на наружной поверхности. Гидрофильные аминокислоты выстилают стенки поры, а гидрофобные контактируют с липидами би-слоя. В канале выделяют внутреннее и наружное устья, пору, которая с помощью специального механизма может открываться и закрываться, и селективный фильтр, являющийся самой узкой частью поры для прохода ионов. Механизм, ответственный за открывание канала, получил название воротного и представляет собой некую заряженную структуру. Вероятно, в покое потен-циалзависимый канал (например, натриевый канал) механически закрыт этой заряженной структурой. При деполяризации мембраны размеры или расположение этой структуры изменяются так, что Рис. 2.12. Схематическое изображе- /
А — наружная среда; Б — внутриклеточная среда; 1 — липидный бислой; 2,3 — воротный механизм (2 — сенсор напряжения, 3 — «ворота»); 4 — белковая макромолекула; 5 — якорный белок; б—углеводная цепочка; 7—селективный фильтр; 8— пора для прохода ионов канал открывается. В пользу того, что в канале происходят подобного вида перестройки, указывает регист- g рация так называемых «воротных токов», возникающих при движении участков молекул, имеющих заряженные группы. Изменения потенциала на мебране на сотые доли вольта могут существенно повлиять на расположение участков молекул, имеющих заряженные группы. В частности, деполяризация на 40...50 мВ обычно приводит к открыванию большей части каналов в мембране. Толщина бислоя мембраны, в котором находятся каналы, составляет около 10 нм (Ю-8 см). Значит, при деполяризации на 50 мВ через этот бислой возникает изменение напряжения, равное 5 • 10~2 В на Ю-6 см, или 50000 В/см. Несомненно, что заряженные группы белков — каналов будут реагировать на такие изменения напряжения и отвечать на них пространственными перестройками каких-то участков белковых молекул. Существенный вклад в изучение природы токов через возбудимые мембраны внесли фармакологические исследования. Были найдены химические вещества (химические инструменты), которые избирательно (селективно) могли блокировать натриевый и калиевый ток — натриевые и калиевые каналы. Так, тетродоток-син — вещество, выделенное из внутренних органов рыбы иглобрюха (рыбы, обитающей у берегов Японии), способен входить в натриевые каналы и блокировать их. Опыты, проведенные на раз-ничных видах нервных клеток, показали, что тетродотоксин пол-i юстью подавляет потенциалзависимую натриевую проводимость, возникшую в норме при деполяризации; в то же время задержанный калиевый ток оставался неизменным. Кинетические особенности блокирования натриевых каналов свидетельствуют о том, что каждая молекула тетродотоксина связывается с одним кана-юм. Для калиевых каналов также был найден селективный бло-катор — им оказался тетраэтиламмоний. Действие ионов тетра- этиламмония при генерации потенциалов действия проявлялось в замедлении спада нисходящей части потенциала действия и увеличении его длительности. На функционирование натриевых каналов тетраэтиламмоний не оказывал влияния. Следует отметить, что с тех пор как Ходжкин и Хаксли выдвинули свою ионную гипотезу возбуждения, согласно которой в аксоне кальмара существуют каналы, избирательно пропускающие ионы натрия и калия, в многочисленных опытах на нервных клетках беспозвоночных и позвоночных животных были найдены другие типы электровозбудимых каналов для натриевых и калиевых ионов, а также для ионов кальция и хлора. Кроме того, была обнаружена большая группа каналов, работа которых управляется различными химическими веществами. Экспериментальные данные о прохождении ионных токов через электровозбудимую мембрану позволяют проследить последовательность возникновения потенциала действия. Первым этапом является деполяризация мембраны (снижение потенциала покоя) с помощью раздражителя. По мере того как мембранный потенциал приближается к пороговому уровню, начинают открываться натриевые каналы и возникает входящий ток, переносимый ионами натрия. В том случае, если мембранный потенциал ниже порогового, выход ионов калия через калиевые каналы, которые в большом количестве открыты в состоянии покоя, компенсирует вход положительных зарядов, обусловленных натриевым током, и потенциалы действия не возникают. Пороговое же значение мембранного потенциала заключается в том, что вход ионов натрия начинает преобладать над выходом ионов калия. Достигнув порогового значения, входящий ток вызывает еще большую деполяризацию мембраны. Эта деполяризация приобретает самоускоряющийся регенеративный характер: вход в клетку положительных зарядов приводит к сдвигу внутриклеточного потенциала в положительную сторону, при этом открываются новые натриевые каналы, вход ионов натрия усиливается и внутренняя поверхность клеточной мембраны становится еще более положительной. Эти процессы обусловливают фазу нарастания потенциала действия. По мере того как мембранный потенциал приближается к равновесному потенциалу для ионов натрия, ЭДС, действующая на ионы натрия и равная разности между значением мембранного потенциала и равновесным натриевым потенциалом, все более снижается. Вследствие этого скорость изменения потенциала действия начинает снижаться, и так до тех пор, пока амплитуда потенциала действия не достигнет максимального значения, равного равновесному потенциалу для ионов натрия. Максимальное значение потенциала действия примерно на 120 мВ положительнее, чем потенциала покоя. Следовательно, в результате самоускоряющейся деполяризации мембраны первичная пороговая деполяри- зация (составляющая около 20 мВ), названная пассивной деполяризацией, усиливается в 5...6 раз. При достижении максимального значения потенциала действия начинается закрывание (инактивация) натриевых каналов. Казалось бы, этого процесса было достаточно для постепенного уменьшения потенциала действия и восстановления исходного мембранного потенциала. Однако процесс ускоряется благодаря дополнительному открыванию потенциал-зависимых калиевых каналов. Увеличение числа открытых калиевых каналов способствует выходу ионов калия из клетки и соответственно удалению положительных зарядов. Происходит более быстрое возвращение (реполяризация) мембранного потенциала к исходному уровню. Повышенная проводимость для ионов калия сохраняется еще некоторое время (мс), поэтому мембранный потенциал становится в этот период более электроотрицательным, чем в исходном состоянии (следовая гиперполяризация). После окончания потенциала действия Na+ — K+ насос восстанавливает исходную внутриклеточную концентрацию ионов калия и натрия. Дата добавления: 2015-12-15 | Просмотры: 1036 | Нарушение авторских прав |
 том состоянии варьирует случайным образом и в довольно широких пределах. Среднее время нахождения канала в открытом состоянии составляет менее 1 мс и зависит от величины мембранного потенциала. Вместе с тем проводимость каналов практически не зависит от напряжения на мембране и имеет чрезвычайно низкое значение (н10 пкСм, т. е. 10 • 10 12 См). Поскольку проводимость — величина, обратная сопротивлению, то соответственно сопротивление одного ионного канала будет иметь огромную величину— 10й Ом. Расчеты показывают, что в начале развития потенциала действия открытые натриевые каналы пропускают примерно 6000 ионов натрия за 1 мс. Общий натриевый ток, который отвечает за восходящую фазу потенциала действия, равен сумме тысяч очень слабых импульсных токов, обусловленных открытием отдельных натриевых каналов. На рис. 2.11, В продемонстрированы ответы одиночного натриевого канала при деполяризации мембраны мышечной клетки. Срабатывание каналов проявляется в виде «всплесков» тока различной длительности и разным временем открывания от начала деполяризации.
том состоянии варьирует случайным образом и в довольно широких пределах. Среднее время нахождения канала в открытом состоянии составляет менее 1 мс и зависит от величины мембранного потенциала. Вместе с тем проводимость каналов практически не зависит от напряжения на мембране и имеет чрезвычайно низкое значение (н10 пкСм, т. е. 10 • 10 12 См). Поскольку проводимость — величина, обратная сопротивлению, то соответственно сопротивление одного ионного канала будет иметь огромную величину— 10й Ом. Расчеты показывают, что в начале развития потенциала действия открытые натриевые каналы пропускают примерно 6000 ионов натрия за 1 мс. Общий натриевый ток, который отвечает за восходящую фазу потенциала действия, равен сумме тысяч очень слабых импульсных токов, обусловленных открытием отдельных натриевых каналов. На рис. 2.11, В продемонстрированы ответы одиночного натриевого канала при деполяризации мембраны мышечной клетки. Срабатывание каналов проявляется в виде «всплесков» тока различной длительности и разным временем открывания от начала деполяризации.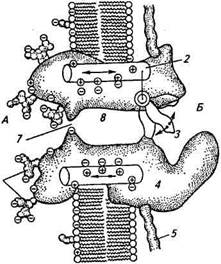 ние потенциалактивируемого ионного канала:
ние потенциалактивируемого ионного канала: