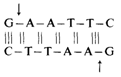|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Рестрикционные эндонуклеазыПервые наблюдения. Заражая фагом X различные штаммы Е. coli, Арбер [296] обнаружил, что ДНК этого фага при пассаже через бактерию разрезается и теряет свою инфекционность. Оказалось, что ни классические рекомбинационные процессы, ни мутации в этом не участвуют. Более того, такая судьба постигала не только фаговую, но и любую чужеродную ДНК, попадающую в бактерию. Такое разрезание (рестрикцию) следует рассматривать как защитный механизм клетки. Как было показано в дальнейшем, рестрикция чужеродной ДНК осуществляется ферментами, называемыми рестрикционными эндонуклеазами (рестриктазами). Встает вопрос, почему рестриктазы не разрезают ДНК собственной клетки. Ответ был найден Арбером и состоял в следующем. Эти ферменты вступают в реакцию с определенными участками в ДНК, так называемыми сайтами узнавания, которые в клетке защищены метальными группами (метилированы). Правда, первые из открытых эндонуклеаз не были специфическими, а действовали случайным образом. Первой рестриктазой, которая расщепляла ДНК в строго определенном месте, была Hind, открытая Смитом в конце 60-х гг. [496]. Этот фермент впервые использован Натансом и соавт. для создания рестрикционной карты генома вируса SU4o [457]. Берг уловил особое свойство двухцепочечной ДНК формировать при обработке рестриктазами так называемые «липкие концы». После разрезания одна из цепей оказывается длиннее другой на несколько нуклеотидов. Эти нуклеотиды могут свободно спариваться с другими, например с комплементарными нуклеотидами другого фрагмента ДНК с липкими концами [299]. Благодаря этому ДНК из различных источников может объединяться, образуя рекомбинантные молекулы. Принципы технологии рекомбинантных ДНК [2397; 60; 493]. Было выделено много рестриктаз (более 150), расщепляющих ДНК в специфических сайтах [117]. Например, эндонуклеаза RI рестрицирует двухцепочечную ДНК по двум сайтам таким образом, что образуются два липких конца:
Липкие концы различных молекул ДНК, расщепленных этим ферментом, могут вступать в комплементарное взаимодействие по четырем А—Т-парам. Рестрикционные эндонуклеазы различаются по тем сайтам в ДНК, которые они распознают и разрезают. Их можно использовать для различных целей. Однако наиболее распространенным этапом является их применение для амплификации специфической ДНК, что необходимо для определения нуклеотидных последовательностей фрагментов ДНК или для изучения механизмов 124 2. Хромосомы человека
экспрессии генов. Последняя проблема наиболее важна в практическом аспекте: гены, контролирующие образование функционально активных белков, теперь можно вводить в бактерии и размножать (амплифицировать). Эта процедура называется клонированием генов. Благодаря ей появилась возможность нарабатывать в больших количествах белки, которые раньше удавалось получить ничтожно мало. Эта технология основана на следующем принципе: помимо своей собственной кольцевой хромосомы бактерии часто содержат дополнительные, маленькие кольцевые молекулы двухцепочечной ДНК, называемые плазмидами. Плазмиды реплицируются автономно и сами могут содержать гены, определяющие устойчивость бактерий к антибиотикам и/или контролирующие синтез веществ, например, колицинов, убивающих другие бактерии (рис. 2.83). Плазмидную ДНК можно выделить и расщепить подходящей рестриктазой только в одном сайте, превратив кольцевую молекулу в линейную с липкими концами. Фрагменты любой чужеродной ДНК с такими же липкими концами (полученными после разрезания аналогичной рестриктазой) можно сшить с плазмидной ДНК с помощью лигазы. Рекомбинантную конструкцию вводят затем в бактерию, где она реплицируется (рис. 2.84). Источник экзогенной ДНК не имеет значения. ДНК может быть получена, например, из клеток человека, но можно сшивать и искусственно синтезированные 1ены. Кроме бактериальных плазмид в качестве векторов (носителей) ДНК используют фаги λ (объект исследований Арбера). Часть генома этого фага не обязательна для его размножения в бактерии. Вместо нею можно ввести чужеродную ДНК, которая будет размножаться вместе с фаговой после инфицирования бактерий. Добиться репликации и амплификации в составе плазмидной (или фаговой) ДНК после трансформации (или соответственно трансфекции) бактериальной клетки еще не значит решить все проблемы. Прежде всего возникают два вопроса: 1. Как распознать клоны, содержащие гибридную ДНК, среди потомства трансформированных клеток или живых бактериофагов? 2. Как идентифицировать необходимые фрагменты ДНК среди многих клонированных неизвестных фрагментов? Например, можно отбирать бактериальные клетки, если они несут плазмиду с фактором устойчивости к антибиотику, выращивая их на среде, содержащей этот антибиотик. Нетрансформированные клетки без плазмид (и, следовательно, без гена устойчивости к антибиотику) просто не будут расти на такой среде. В последние годы разработано много специальных методов селекции, которые позволяют отби- 2. Хромосомы человека 125
126 2. Хромосомы человека
рать только рекомбинантные клетки, но мы пока не будем их здесь подробно описывать. Для генной инженерии белков недостаточно отобрать и размножить определенные фрагменты ДНК, необходимо еще индуцировать их экспрессию в клетке. Для этого необходимо «подключить» рекомбинантную молекулу к «машине», которая обеспечивает транскрипцию ДНК, последующую трансляцию матричной РНК и процессинг как на транскрипционном, так и на трансляционных уровнях. Идентификация и анализ генов. Еще одна область применения рестриктаз - идентификация и определение числа генов [332]. Эти задачи решаются с помощью метода, разработанного Саузерном (1975; [492]). Тотальную ДНК из клеток человека гидролизуют эндонуклеазой примерно на 500000 фрагментов длиной от 102 до 105 нуклеотидных пар. Затем фрагменты разделяют по молекулярной массе с помощью гель-электрофореза в агарозе, после чего ДНК денатурируют щелочью прямо в геле, чтобы получить одноцепочечные фрагменты. Их переносят на нитроцеллюлозный фильтр и фиксируют высушиванием при 80°С. В результате получается отпечаток (реплика) картины разделения фрагментов ДНК по их размеру. Эти фрагменты можно идентифицировать методом гибридизации с радиоактивными ДНК-зондами, специфичными для определенных генов или хромосом. Любой фрагмент, содержащий всю последовательность зондируемого гена или его часть, будет выглядеть на радиоавтографе в виде темной полосы (рис. 4.60).
Зонды и генные библиотеки. Главное условие такого анализа - наличие подходящего геноспецифического радиоактивного ДНКзонда, который можно использовать для гибридизации (табл. 2.13). В тех случаях, когда имеется в распоряжении матричная РНК, например для р-глобина, специфический зонд можно получить при помощи фермента обратной транскриптазы. Этот фермент катализирует считывание нуклеотидной последовательности мРНК в комплементарную последовательность ДНК, так называемую кДНК (сама мРНК для гибридизации обычно не используется, поскольку трудно получить ее препараты с достаточно высокой радиоактивной меткой). Для создания библиотеки кДНК может быть использована мРНК из разных источников. Такие библиотеки содержат в основном уникальные нуклеотидные последовательности активно транскрибирующихся структурных генов или их частей, а также последовательности ДНК из их ближайшего окружения. Эти библиотеки используют в основном для обнаружения и характеристики таких генов. Находят свое применение и геномные библиотеки. Их получают путем фрагментирования ДНК рестрикционными эндонуклеазами и последующего клонирования отдельных рестриктов в векторах. Такие библиотеки удобно использовать, например, для обнаружения 2. Хромосомы человека 127 в геноме комплементарных участков. Нередко в пределах определенной последовательности ДНК обнаруживается рестрикционный полиморфизм. Это значит, что сайты рестрикции могут варьировать у разных индивидов (разд. 2.3.2.7). В таких случаях зонды можно использовать для классических исследований сцепления в семьях с помощью методов, описанных в разд. 3.4.2. Работа с геномной библиотекой весьма трудоемка, учитывая размеры генома человека и количество фрагментов, из которых необходимо отобрать один-единственный, «интересующий» исследователя. Для решения многих вопросов предпочтительнее располагать хромосомо-специфической библиотекой. Её создание требует выделения отдельных хромосом. В настоящее время это стало возможным благодаря сортировке хромосом цитофлуорометрическим методом (разд. 2.3.2.5). Для синтеза кДНК используется также такое мощное средство, как синтетические олигонуклеотиды, особенно в тех случаях, когда мРНК недоступна [390; 476; 527; 539]. Зная генетический код, можно сконструировать, например, кДНК структурного гена определенного белка, аминокислотная последовательность которого известна. В настоящее время существуют автоматические устройства для синтеза любых нуклеотидных последовательностей желаемой длины. Если ген идентифицирован и особенно если доступен его первичный продукт в ^иде мРНК, то анализ тонкой структуры гена можно осуществить на основе комплекса методов, часть из которых описана ниже более детально. Конечной целью таких исследований являются расшифровка полной нуклеотидной последовательности определенного генетического района и установление присущих конкретным группам нуклеотидов специфических функций в транскрипции и ее контроле. Дата добавления: 2015-12-16 | Просмотры: 985 | Нарушение авторских прав |