|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Гибридизация нуклеиновых кислотПринцип. В разд. 2.3.1.1 мы уже упоминали метод идентификации ДНК-повторов, основанный на разделении двойных цепей при повышении температуры и их реассоциации при быстром снижении температуры. Таким образом, в этом методе используется способность комплементарных цепей нуклеиновых кислот гибридизоваться одна с другой и образовывать двойную спираль. То же свойство используется для идентификации разделенных гель-электрофорезом фрагментов ДНК в методе Саузерна (Southern blotting, разд. 2.3.2.2). Способность к гибридизации цепей ДНК лежит в основе многих методических приемов молекулярной биологии, поэтому более подробное описание принципа гибридизации будет полезным. Большинство природных ДНК встречается в виде двухцепочечных молекул. Их устойчивость поддерживается благодаря тому, что пиримидиновое основание цитозин (С) спаривается с пуриновым основанием гуанином (G), в то время как пиримидиновое основание тимин (Т) спаривается с пуриновым основанием аденином (А). Эти комплементарные пары оснований удерживаются водородными связями (тремя в паре G-C и двумя в паре А-Т), которые относительно легко разрываются, но и быстро восстанавливаются, при этом одноцепочечные фрагменты ДНК, присутствующие в растворе, снова формируют двойную спираль. Для реассоциации не имеет значения происхождение одноцепочечной ДНК, не требуется даже полной комплементарности отдельных цепей. Реассоциация происходит даже тогда, когда какая-то часть оснований в каждой цепи не комплементарна (рис. 2.85). Одноцепочечная ДНК может спариваться (гибридизоваться) даже с РНК, если у них есть комплементарные основания. «Прогулка по хромосоме». Метод гибридизации полезно использовать, например, для анализа очень протяженного гена. При этом с помощью подходящего зонда из геномной библиотеки ДНК извлекается первоначально какая-то часть такого гена. Нуклеотидная последовательность этой части гена будет, как правило, длиннее зонда, и ее концы будут перекрываться с другими фрагментами данного гена в этой библиотеке, т. е. будут по крайней мере частично гибридизоваться с ними. Свободные концы этих фрагментов будут гибридизоваться со следующими и т.д., пока весь структурный ген не будет полностью идентифицирован серией перекрываю- 128 2. Хромосомы человека
щихея фрагментов. Именно таким образом был реконструирован структурный ген фактора свертывания крови VIII человека, необычно длинный, состоящий из 180000 пар нуклеотидов. Реконструкцию начинали с олигонуклеотидного зонда длиной всего в 36 нуклеотидов. Описанный ранее метод, когда сначала выделяется специфическая мРНК, а затем с помощью обратной транскрип газы на ней синтезируется кДНК, в данном случае оказался непригоден из-за низкой концентрации мРНК. Олигонуклеотидный зонд был синтезирован на основе аминокислотной последовательности фрагмента белка фактора VIII, и ее комплементарность оказалась достаточной для эффективной гибридизации. Полный анализ гена фактора VIII описан в разд. 2.3.7. Гибридизация in situ. Метод гибридизации in situ особенно удобен для анализа эукариотических геномов методами молекулярной цитогенетики. Препарат метафазных хромосом обрабатывают радиоактивным ДНК-зондом в условиях, позволяющих этому зонду гибридизоваться с хромосомной ДНК. Таким образом исследуемый ген можно локализовать в специфическом хромосомном сегменте. На первых этапах применение этого метода ограничивалось идентификацией в хромосомах только высокоповторяющихся нуклеотидных последовательностей, в частности сателлитной ДНК. Но даже только эти данные позволили сделать важные выводы относительно эволюции человека (разд. 7.2.2). Позже метод гибридизации in situ был усовершенствован настолько, что теперь с его помощью можно локализовать в хромосомах даже уникальные гены, такие, например, как ген
130 2. Хромосомы человека
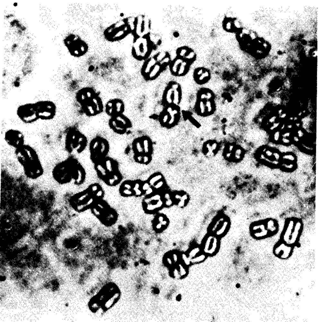
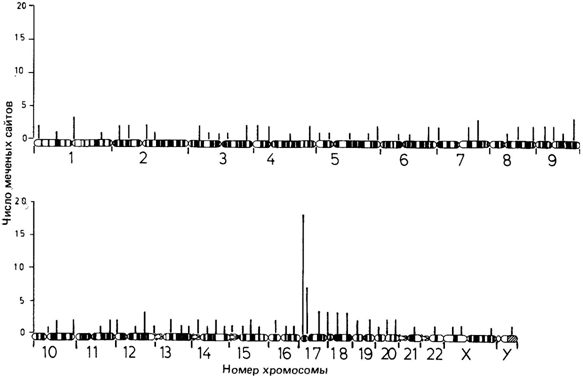
инсулина ([377] гл. 3). Для этого используют статистический анализ распределения радиоактивной метки по длине отдельных хромосом во многих метафазных препаратах. В качестве примера рассмотрим теперь основные этапы анализа гена тяжелой цепи миозина [482]. Вначале был получен кДНК-зонд для гена тяжелой цепи миозина кролика. Поскольку гомологичные гены различных млекопитающих в общем сходны, их гибридизация проходит без затруднений. Зонд клонировали в плазмиде и выделенную затем ДНК метили тритием (3Н) с помощью ник-трансляции (nick translation). Для этого ДНК инкубировали с небольшим количеством ДНКазы-1, которая вносит несколько одноцепочечных разрывов в двухцепочечную ДНК. Затем добавляли радиоактивно меченные нуклеотиды и ДНК-полимеразу, при этом меченые нуклеотиды встраивались в ДНКзонд. Препараты митотических хромосом получали из культуры лимфоцитов, подвергали специальной обработке с целью денатурации хромосомной ДНК и затем проводили гибридизацию с меченным тритием ДНК-зондом в течение 16-18 ч при 40°С. После отмывания препаратов с целью удаления несвязавшейся или неспецифически адсорбированной ДНК их экспонировали в течение 3 недель для получения радиоавтографов. После окрашивания акрихинипритом (Q-метод) препараты сфотографировали. На рис. 2.86 показана типичная метафазная пластинка, а на рис. 2.87-распределение метки по отдельным сегментам всех хромосом человека. Как видно, основная масса метки обнаруживается на коротком плече хромосомы 17 в сегменте 17pl.2 ® pter. На основании этого был сделан вывод, что ген тяжелой цепи миозина расположен в хромосоме 17. Поскольку данный эксперимент был проведен с зондом кДНК, мы не вправе утверждать, что идентифицированный миозиновый ген является действительно активным. Он может быть и «псевдогеном», т.е. такой последовательностью ДНК, которая структурно гомологична активному гену миозина, но сама не транскрибируется, т. е. не детерминирует синтез миозина, поскольку лишена каких-то важных фланкирующих последовательностей вне транскрибируемой части. Такие псевдогены были обнаружены, например, в пределах кластеров α- и β-глобиновых генов (разд. 4.3). Все большее число генов человека успешно локализуется в хромосомах с помощью этого метода (разд. 3.4, табл. 2.14) 2. Хромосомы человека 131 2.3.3.4. Секвенирование ДНК [117; 122; 381] Последовательность нуклеотидов и генетический код. Методы определения последовательности аминокислот в полипептидной цепи были известны еще в 50-х гг. Теоретически это относительно легкая проблема, поскольку все 20 аминокислот, встречающиеся в природных белках, имеют разные свойства. С другой стороны, нуклеотидная последовательность ДНК относительно однородна по составу элементарных звеньев, так как содержит только четыре типа азотистых оснований-гуанин, цитозин, аденин и тимин. Когда еще в 60-х г. был расшифрован генетический код, появилась возможность восстанавливать (дедуцировать) нуклеотидную последовательность транскрибируемой ДНК по аминокислотной последовательности соответствующего белка. Однако генетический код является вырожденным, то есть одной и той же аминокислоте соответствуют несколько разных нуклеотидных триплетов. Следовательно, суждения о нуклеотидной последовательности, основанные на последовательности аминокислот в белке, не однозначны. Кроме того, последовательности аминокислот не содержат никакой информации о последовательности некодирующих участков ДНК. В настоящее время разработаны методы непосредственного секвенирования ДНК [117]. Принцип состоит в следующем: длинную молекулу ДНК фрагментируют при помощи агентов, расщепляющих ее в специфических сайтах. Затем определяют последовательность нуклеотидов в каждом из этих фрагментов. Очередность фрагментов в целой молекуле восстанавливают, используя перекрывающиеся концы: идентичные цепи разрезают повторно другой рестриктазой, а затем последовательности перекрывающихся фрагментов, образующихся при обработке двумя рестриктазами разной специфичности, сравнивают. Так может быть реконструирована полная последовательность. В пределах отдельных фрагментов порядок нуклеотидов определяют с помощью специальных методов. Раньше секвенирование ДНК было весьма трудным делом, теперь же оно осуществляется довольно легко и быстро. Для этого необходимо длинную молекулу ДНК с помощью рестриктазы разделить на фрагменты удобного размера, а затем, если нужно, размножить их путем клонирования (разд. 2.3.2.2). В настоящее время секвенируют очень длинные молекулы ДНК. Например, определены уже последовательности всей митохондриальной ДНК человека (разд. 2.3.5) и семейства)3-глобиновых генов (разд. 4.3). С помощью секвенирования ДНК можно получить более точные сведения и о нетранскрибируемых участках ДНК, важных для контроля транскрипции (так называемые операторы и промоторы). Дата добавления: 2015-12-16 | Просмотры: 1183 | Нарушение авторских прав |