 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Заболевания со сложным типом наследованияОбсуждавшиеся до сих пор методы применялись в основном при анализе признаков, наследующихся в соответствии с простыми менделевскими правилами. Однако для многих заболеваний, особенно для широко распространенных и достаточно тяжелых (например, шизофрения, гипертония, диабет), имеется ряд проблем. 1. Трудно поставить диагноз. Часто встречаются пограничные случаи. Если подойти более формально, распределение пораженных и непораженных в популяции не является точно биномиальным. 2. Данные различных исследований, в том числе близнецов, указывают на то, что проявление заболевания зависит не только от генетических, но и от средовых факторов (например, снижение частоты диабета в европейских странах во время второй мировой войны). 3. Заболевание встречается настолько часто, что его накопление в семье может оказаться случайным (например, многие типы рака). 4. Существующие представления о патогенетических механизмах позволяют предполагать, что признак является не единым заболеванием, а совокупностью синдромов, общих для многих разных причин (например, эпилепсия). Фактически становится очевидным, что такие диагнозы, как гипертония или диабет, объединяют гетерогенные группы самостоятельных клинико-генетических вариантов и форм патологии. Не следует ожидать, что во всех таких случаях генетический анализ обобщенного фенотипа может обнаружить простой тип наследования (подробнее эта проблема обсуждается в разд. 3.6). Вместе с тем для многих заболеваний такого рода оправданны два практически важных вопроса. 1. Каков риск для родственников разной степени родства быть пораженными? Выше ли он, чем средний риск в популяции? 2. Каков вклад генетических факторов в заболевание? При каких условиях болезнь будет проявляться? Семейное накопление можно оценить с помощью величин эмпирического риска. Чтобы ответить на некоторые вопросы, обсуждаемые в разд. 3.6.2, требуются близнецовые исследования и сравнения частот пораженных среди близких родственников пробандов с популяционными частотами. Здесь мы сделаем несколько замечаний относительно значений риска. Величины эмпирического риска. Выражение «эмпирический риск» используется в противоположность «теоретическому риску», ожидаемому исходя из менделевских правил для заболеваний с простым типом наследования. Методология была разработана в 20-х гг. мюнхенской школой генетиков-психиатров с целью получения величин риска при психических заболеваниях. Основу методологии составляет исследование достаточно большой выборки пораженных и их близких родственников. На основе этого материала вычисляются несмещенные значения риска для определенных классов родственников. При таком подходе делается неявное предположение, что, как правило, значения риска постоянны «в пространстве и во времени», т. е. в разных популяциях и при меняющихся условиях внутри одной популяции. Имеющиеся факты влияния условий среды на проявление таких заболеваний, как диабет, показывают, что хотя это предположение и не обязательно справедливо, но в первом приближении полезно. Этот подход можно использовать и для решения такой проблемы: имеют ли два 188 3. Формальная генетика человека
заболевания А и В общую генетическую компоненту, увеличивающую долю больных с заболеванием А среди близких родственников пробандов с заболеванием В. Отбор и обследование пробандов и их семей. Для заболеваний с простым типом наследования обычно осуществляется прямой отбор пробандов. Типы регистрации обсуждались в разд. 3.3.5. Для изучения эмпирического риска применяют те же правила. В случае широко распространенных заболеваний полная регистрация семей в популяции редко осуществима, а кроме того, она и не является необходимой для целей этих исследований. В большинстве случаев может быть использована определенная выборка пробандов, например все пораженные в определенной больнице в конкретный период времени. Тип регистрации будет единичным или очень близким к нему. Этот подход упрощает коррекцию смещений вследствие регистрации среди сибсов пробандов. Величины эмпирического риска можно вычислить путем подсчета пораженных и непораженных среди сибсов, исключая пробанда. Величины риска среди детей, зарегистрированных по поколению родителей, не смещены и в коррекции не нуждаются. В тех случаях, когда диагностические критерии очерчены нечетко, критерии квалификации индивида в качестве пробанда должны быть однозначно описаны заранее, так же как и все возможные смещения вследствие отбора семей. Отобраны ли для исследования наиболее тяжелые случаи, обычно встречающиеся в больнице? Выбраны ли больные из конкретной социальной или этнической группы? Имеются ли другие смещения, которые могут повлиять на результат? На практике очень трудно, а может быть, и невозможно получить несмещенную выборку, однако о всех смещениях необходимо знать. Самое важное, что такие смещения должны быть независимы от решаемой задачи. Например, было бы ошибкой рассматривать только те случаи, которые характеризуются явным семейным отягощением той же патологией. Основная цель исследований заключается в получении максимально возможной и наиболее достоверной информации о пробандах и их родственниках, а способы достижения этой цели могут быть разными. Полезны клинические исследования и изучение публикаций по сходной тематике. Если уж пробанд и его семья зарегистрированы, то информация о состоянии здоровья остальных его родственников обязательно должна быть собрана. Здесь очень важен личный осмотр исследователем, но во многих случаях помимо этого необходимы истории болезни пробанда и его родственников. Осмотр и история болезни должны быть подкреплены объективными данными, такими, как больничные записи и различные лабораторные и рентгенологические исследования. Даже к результатам клинических осмотров нужно относиться с некоторой долей скептицизма, поскольку не все врачи обладают одинаковыми знаниями и в равной степени внимательны, а официальные документы, такие, как свидетельства о смерти, в отношении диагноза причин смерти часто весьма ненадежны. На основе полученных величин генетического риска в большинстве случаев дается ответ на вопрос, превышает ли риск для данного индивида среднепопуляционный или нет. Иногда имеются адекватные данные о частоте всех (или только новых случаев) в популяции, в которой проводится исследование, или сходной с ней. Однако скорее чаще, чем реже приходится исследовать контрольные выборки по тем же критериям, которые используются для «тестируемой» группы. Конечно, следует использовать соответствующие друг другу контрольные группы, т. е. для каждого больного исследовать контрольного индивида (matched controls) аналогично больному по многим «формальным» характеристикам, таким, как возраст, пол, этническое происхождение и т. п., кроме самого изучаемого признака. Статистическая оценка, коррекция на возраст. Для признаков, которые проявляются сразу, таких, как врожденные пороки развития внешних частей тела, вычисления производятся непосредственно. Эмпирический риск для детей равен доле пораженных в выборке. Однако во многих случаях заболевание начинается позже и время 3. Формальная генетика человека 189
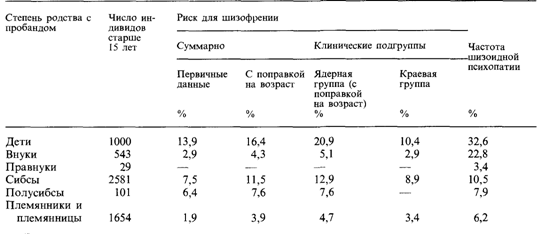
начала может сильно варьировать, например, для шизофрении между 15 и 45 годами. Здесь уместен вопрос: «Каков риск индивиду заболеть, если он (или она) моложе возраста проявления. Соответствующие методы коррекции на возраст широко обсуждались в старой литературе [744], наиболее употребимым является «сокращенный метод» Вайнберга. Сначала период полного проявления определяется на основе достаточно большой выборки больных (обычно большей, чем выборка исследуемых семей). Затем все родственники, которые не попадают в группу исследуемых как недостигшие еще возраста проявления, исключаются. В эту категорию могут попасть и те, которые по разным причинам выбывают из исследования: смерть, потеря контакта вследствие перемены места жительства или завершение исследования. С другой стороны, здоровые родственники, которые еще находятся в том возрасте, когда болезнь может проявиться, считаются за половину, а все, которые пережили этот возраст, подсчитываются полностью. Пример. Среди детей в семьях, где один из родителей поражен шизофренией, имеется 50 пораженных и 200 непораженных. Причем 100 непораженных уже достигли возраста 45 лет, а 100 находятся в возрасте между 15 и 45 годами. Таким образом, поправленное число непораженных равно 200 — 1/2·100= 150 и эмпирический риск составляет 50/(150 + 50) = 25%. Вычисление величин риска для шизофрении. Описанная выше процедура будет продемонстрирована с использованием данных Кальмана (1938) [731] по генетике шизофрении. Это заболевание имеет ряд особенностей, неблагоприятных для генетического анализа. Диагностические критерии различны в разных психиатрических школах. Кроме того, отсутствие стопроцентной конкордантности в парах монозиготных близнецов свидетельствует о том, что подверженность не ограничивается только генетической компонентой (разд. 8.2.3.7). Пробандами были все больные шизофренией, находившиеся в Берлинской государственной психиатрической больнице с 1893 по 1902 г. Единственным условием включения в выборку было наличие диагноза шизофрении по критериям, разработанным Крепелином. Эти критерии более жесткие, чем широко используемые в американской психиатрии. Диагноз был подтвержден самим исследователем на основе всех имеющихся данных. Зарегистрировано 1087 случаев: 647 женщин и 440 мужчин. Семьи (дети, внуки, правнуки) сначала обследовались ассистентом, а затем врачом либо в больнице, либо на дому. Для диагностической квалификации использовали все имеющиеся типы объективных данных. Всего обследовали 13851 лиц, что в докомпьютерные времена вылилось в огромную работу. В табл. 3.7 представлены величины риска для шизофрении и шизоидной психопатии у родственников всех степеней родства. Они были вычислены с помощью обсуждавшегося выше сокращенного метода Вайнберга. Использовались также более точные методы коррекции, но результаты практически не отличались. Затем данные были подразделены в соответствии с клиническими характеристиками заболевания у супругов, родителей и сибсов. Полученные результаты позволили авторам сделать следующие выводы. 1. Клиническая картина заболевания может быть разной. Это дает возможность провести подразделение шизофрении на ядерную группу (кататонии и гебефрении) и краевую группу (параноидные и простые формы). Риск выше для родственников больных ядерными формами. 2. В одной семье могут оказаться больные разными формами. Это означает, что существует общая генетическая основа для всех типов шизофрении. Однако имеется также внутрисемейная корреляция среди отдельных форм, которая показывает, что, несмотря на общую подверженность, имеются также и специфические компоненты наследственного предрасположения. 3. Риск для детей родителей-шизофреников стать пораженными в 19 раз выше среднепопуляционного, для внуков и двоюродных сибсов - примерно в пять раз выше. Кальман не исследовал контрольную группу, поскольку ранее Пэнс (1935) собрал контрольный материал из той же самой популяции и определил популяционную частоту шизофрении: она составила 0,89%. 190 3. Формальная генетика человека
4. Дети пробандов с пораженными сибсами имели примерно такой же риск, как и дети пробандов без пораженных сибсов. Эти данные указывают на то, что в материале нет примеси ненаследственных случаев. 5. Риск для детей, оба родителя которых страдали шизофренией, стать пораженными составлял 68%. 6. Кальман исследовал также, встречаются ли какие-либо другие признаки чаще у близких родственников больных шизофренией. Он обнаружил, что чаще, чем в общей популяции, встречается туберкулез, т. е. подверженность туберкулезу как будто бы коррелирует с подверженностью шизофрении. 7. Репродуктивная способность родителей и их близких родственников была ниже, чем в популяции. Впоследствии были проведены другие исследования в разных популяциях, и в настоящее время имеется значительное количество данных о величинах эмпирического риска при шизофрении. К этой теме мы снова вернемся в разд. 8.2.3.7.
Величины теоретического риска, получаемые из оценок наследуемости. Высказываются предположения [803], что величины эмпирического риска следует заменить величинами теоретического риска. Эти величины получают из оценок наследуемости в мультифакториальной модели (разд. 3.6.2) после установления соответствия имеющихся данных ожидаемым значениям на основе этой модели (как при простой диаллельной модели). Такие оценки наследуемости можно получить с помощью сравнения частоты признака в популяции с частотами в определенных группах родственников, например среди сибсов или, с ограничениями (разд. 3.8.4), у близнецов. Величины теоретического риска были рассчитаны для пилоростеноза [752]. Указанный метод допускает включение средовых (материнских) эффектов. Он может помочь в вычислении риска для тех категорий родственников, для которых нет достаточного количества данных, чтобы рассчитать эмпирический риск. Слабой стороной этого подхода является то, что он существенно зависит от предположения о достаточно хорошем соответствии генетической моде- 3. Формальная генетика человека 191
Дата добавления: 2015-12-16 | Просмотры: 566 | Нарушение авторских прав |
 ли реальной ситуации. Выбранная генетическая модель может оказаться неприменимой к имеющейся совокупности данных, а усложненный статистический подход создаст иллюзию достоверности получаемых результатов. Полезно, хотя это и не всегда практически выполнимо, проводить эмпирическую проверку величин риска, предсказываемых с помощью таких методов.
ли реальной ситуации. Выбранная генетическая модель может оказаться неприменимой к имеющейся совокупности данных, а усложненный статистический подход создаст иллюзию достоверности получаемых результатов. Полезно, хотя это и не всегда практически выполнимо, проводить эмпирическую проверку величин риска, предсказываемых с помощью таких методов.