|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Группы крови: Rh-комплекс, неравновесие по сцеплениюИстория. В 1939 г. Левин и Стетсон [762] исследовали сыворотку крови женщины, которая родила мертвый плод и в анамнезе которой имело место переливание крови мужа, совместимой по АВО группе. 210 3. Формальная генетика человека
При этом ими были обнаружены особые антитела. Позже Левин и Стетсон показали, что из 1010 образцов крови только 21 дал отрицательную реакцию с этими антителами. Выявленные антитела никакой связи с системами групп крови ABO, MN и Р не имели. В 1940 г. Ландштейнер и Винер [753] при иммунизации кроликов эритроцитами макака-резуса получили сыворотку, которая агглютинировала эритроциты 39 из 45 особей. При сравнении этих антител с антителами, обнаруженными Левином и Стетсоном, авторы пришли к выводу, что в обоих случаях реакция происходит с одним и тем же антигеном. В дальнейшем оказалось, что это не совсем так. В настоящее время антиген, открытый с помощью истинного анти-резус-антитела, называется LW-в честь Ландштейнера и Винера, а Rh-типирование у человека всегда проводится с сывороткой человеческого происхождения, как это было сделано в работе Левина и Стетсона. Последующее изложение вопроса относится только к реакциям с этими антителами человека. Огромная практическая важность системы Rh стала очевидной, когда была установлена связь между этими антителами и несчастными случаями при переливании крови. Кроме того, стало понятным, что именно резус-несовместимость матери и плода является причиной эритробластоза плода и гемолитической болезни новорожденных. Оказалось, что эритроциты примерно 85% всех представителей белой расы дают положительные реакции с анти-Rhсыворотками. Семейными исследованиями было установлено, что Rh-положительные индивиды являются гомозиготами Rh/Rh или гетерозиготами Rh/rh, тогда как rh-отрицательные индивиды - это гомозиготы rh/rh. В 1941 г. Винер открыл другие антитела, которые реагировали с эритроцитами 70% всех индивидов и отличались от основного фактора Rh (Rh' по Винеру). Третий родственный фактор был открыт в 1943 г. В семейно-популяционных исследованиях выявлены все возможные комбинации этих трех факторов, причем наследовались совместно именно комбинации. Винер выдвинул гипотезу, согласно которой эти серологические «факторы» являются «агглютиногенами» и что каждый из них детерминируется одним аллелем из серии множественных аллелей одного гена. Эта описательная гипотеза настолько неконкретна, что на ее основе можно было объяснить все, в том числе и позже открытые факты. Для того чтобы судить о внутренней структуре Rh-локуса, по мнению большинства исследователей, необходимо было провести биохимический анализ. Гипотеза Фишера о тесно сцепленных локусах. В 1943 г. Фишер сформулировал более конкретную гипотезу. В то время удалось выявить еще одно антитело, антиHr, и Фишер, анализируя подготовленные Рейсом полные таблицы серологических данных, обнаружил, что Rh'- и Hr-факторы комплементарны. У каждого человека в крови присутствуют либо антиген Rh', либо Hr, либо оба антигена. Индивид, имеющий оба антигена, никогда не передает их вместе одному потомку, т. е. ребенок всегда получает только один антиген из двух. Для объяснения этих фактов Фишер предложил модель, согласно которой пара аллелей определяет один из двух антигенов. Эта пара была названа С/с. Аналогично была постулирована дополнительная пара аллелей D/d для исходных антигенов Rh + и rh —, а также третья пара аллелей для уже открытого тогда третьего серологического фактора. Кроме того, чтобы согласовать генетические данные о наследовании всех трех факторов, постулировалось наличие тесного сцепления между этими тремя локусами. Гипотеза Фишера предполагала открытие двух недостающих (комплементарных D и Е) антигенов d и е. Это предсказание подтвердилось для антигена е, но не для d. По-видимому, этот хромосомный район не содержит то «нечто», что приводит к образованию антител. В развитии данной гипотезы Фишер сделал важный шаг вперед. В британской популяции наиболее частыми были три класса комплексов Rh-генов (рис. 3.32, 3.33). По мнению Фишера, редкие комбинации появляются вследствие изредка происходящего кроссинговера.
3. Формальная генетика человека 211
Действительно, все четыре комбинации, относящиеся к редким классам, могут возникнуть в результате кроссинговера между более частыми комбинациями, но для CdE это не так. Для появления этой комбинации необходим двойной кроссинговер. Следовательно, гипотеза объясняет, почему комбинация CdE так редка. Возможно и другое объяснение. При каждом кроссинговере, приводящем к возникновению Cde, CDE или cdE, должна возникать также и комбинация cDe. Отсюда следует, что суммарная частота первых трех комбинаций должна быть равна частоте cDe. Действительно, найденные частоты были такими: cDe-0,0257 и Cde + cdE + CDE - 0,0241 (среди негров, однако, частота cDe была выше). Кроме того, Фишер предположил, что три указанных локуса расположены в последовательности D-C-E, поскольку комбинация cdE, которая возникает вследствие кроссинговера между локусами D и Е в генотипе cDE/cde, встречается намного чаще относительно этого генотипа, чем комбинация CDE относительно генотипа CDe/cDE (кроссинговер между С и Е). Подтверждение и предварительная интерпретация порядка расположения генов. За 30 лет, прошедших с тех пор, как Фишер выдвинул свою гипотезу, было сделано много новых наблюдений. Наиболее важным для решения вопроса о порядке расположения генов было выявление комбинированных антигенов, например се. Существование этого составного антигена, повидимому, не противоречит последовательности D-C-E, тогда как составные антигены, предполагающие тесное сцепление между D/d и Е/е, не были обнаружены. Гипотеза Фишера поставила два вопроса. 1. Если вследствие кроссинговера формируются иногда редкие комбинации из более частых, то в семейных исследованиях
212 3. Формальная генетика человека
должны обнаруживаться случаи кроссинговера. Действительно, имелось сообщение об одной такой семье [896]: у отца с генотипом CDe/cde и матери с генотипом cde/cde было четверо детей cde/cde и троеCDe/cde, что находится в полном соответствии с генетической теорией. Однако шестой (в порядке рождения) ребенок имел генотип Cde/cde. Этот факт можно было бы объяснить тем, что ребенок внебрачный. Однако такое объяснение кажется малоправдоподобным, если исходить из данных по другим группам крови и сывороточным факторам, а также учитывая принадлежность этой семьи к секте с особо строгими нравами. Однако других семей, подобных этой, обнаружено не было. Вполне вероятно, что многие исследователи просто не станут учитывать такой атипичный случай, поскольку заподозрят здесь методическую ошибку. 2. Какова должна быть структура Rhлокуса(ов) в свете достижений молекулярной генетики? Имеются две принципиальные возможности: а) Rh-комплекс - это один цистрон с многими мутационными сайтами. Мутационные изменения выражаются в антигенных различиях; б) Rh-комплекс состоит из нескольких тесно сцепленных цистронов (возможно, трех), и основные антигены отражают генетическую изменчивость по этим цистронам. В отсутствие каких-либо неопровержимых биохимических данных этот вопрос остается неразрешенным. Определенные выводы можно сделать на основании цис-транс- теста. Поскольку составной антиген се обнаруживается только в цис- положении СЕ/се, но не в транс -положении Се/сЕ, Рейс и Сэнгер (1969) [846] высказали гипотезу, согласно которой С/с и Е/е относятся к одному функциональному гену. За последние десятилетия накоплено множество фактов, которые свидетельствуют о том, что не только в структурном, но и в количественном отношении экспрессия Rh-фактора находится под строгим генетическим контролем. Розенфельд и соавт. (1973) [860] попытались обобщить все имеющиеся данные на основе новой модели структуры Rh-локуса. Согласно этой модели, Rh-локус состоит из нескольких областей (структурных генов), несущих информацию о мембранных полипептидах. Эти области находятся под контролем общего оператора или промотора, который регулирует количественную экспрессию, возможно, благодаря нескольким операторным районам, приближенным к единственному структурному гену. Эта модель объединяет фишеровскую концепцию с более поздними результатами молекулярной биологии. Однако биохимические доказательства модели пока отсутствуют. Неравновесие по сцеплению. В процессе обоснования гипотезы о наследовании Rhкомплекса Фишер разработал еще одну концепцию: неравновесие по сцеплению. Обычно сцепление не приводит к ассоциации признаков в популяции (разд. 3.4.1). Даже если в начальной популяции фазы сцепления распределены не случайно, то многократно повторяющийся кроссинговер будет рандомизировать комбинации аллелей в группе сцепления, и в конце концов фазы притяжения и отталкивания для двух сцепленных локусов будут встречаться в популяции с одинаковой частотой. Это случай равновесия по сцеплению. Однако если в начальной популяции существует отклонение от равновесия, то время, за которое оно будет достигнуто, зависит от степени сцепления: чем теснее сцепление, тем больше требуется времени для достижения равновесия. И оно никогда не будет достигнуто, если определенные комбинации аллелей определяют сниженную приспособленность. Правда, селективный недостаток некоторых аллельных комбинаций Rh-комплекса, способных обусловить снижение их частоты, до сих пор еще не продемонстрирован: отбор работает против гетерозигот (разд. 6.2), но это не означает, что общее снижение приспособленности никогда не существовало или никогда впредь не будет иметь убедительного объяснения в терминах истории популяции. Отвечая на некоторые вопросы, гипотеза Фишера в свою очередь поставила ряд других. Сама по себе концепция неравновесия по сцеплению остается важной в генетическом ана- 3. Формальная генетика человека 213 лизе полиморфизма ДНК (разд. 6.1) и главного комплекса гистосовместимости. 3.5.5. Главный комплекс гистосовместимости (МНС) [193; 188] История. Давно известно, что кожа, пересаженная от одного индивида другому (аллотрансплантация), через короткое время отторгается. В 1927 г. Бауэр [562] установил, что при пересадке кожи от монозиготного близнеца его партнеру (изотрансплантация) отторжения не происходит. Такая пересадка воспринимается организмом как пересадка собственной кожи (аутотрансплантация). Таким образом, было доказано, что реакция отторжения детерминирована генетически. В последующие годы изредка появлялись сообщения о пересадках кожи (а позже и о пересадках почки) между монозиготными близнецами. Но исследования по антигенам гистосовместимости у человека начались только тогда, когда выяснилось, что полезными для таких исследований могут быть лейкоциты. Доссэ (1954) обнаружил, что сыворотки некоторых больных, которым много раз делали переливание крови, содержали агглютинины против лейкоцитов. Впоследствии было установлено, что сыворотки семи таких больных агглютинировали лейкоциты 60% индивидов французской популяции, но не агглютинировали лейкоциты самих больных. Вскоре с помощью близнецовых и семейных исследований удалось показать, что эти изоантигены детерминированы генетически. Другие изоантигены были открыты ван Родом. Еще одним важным достижением можно назвать разработку теста микролимфоцитарной токсичности [911]. И в настоящее время этот метод используется наиболее часто (рис. 3.34, 3.35). В последующем количество вновь открываемых лейкоцитарных антигенов быстро росло, и в 1965 г. было выдвинуто предположение, что большинство из них принадлежит одной генетической системе. На рабочем совещании по гистосовместимости в 1967 г. 16 разных делегаций типировали идентичные пробы, взятые в итальянских семьях. Таким образом, были
214 3. Формальная генетика человека
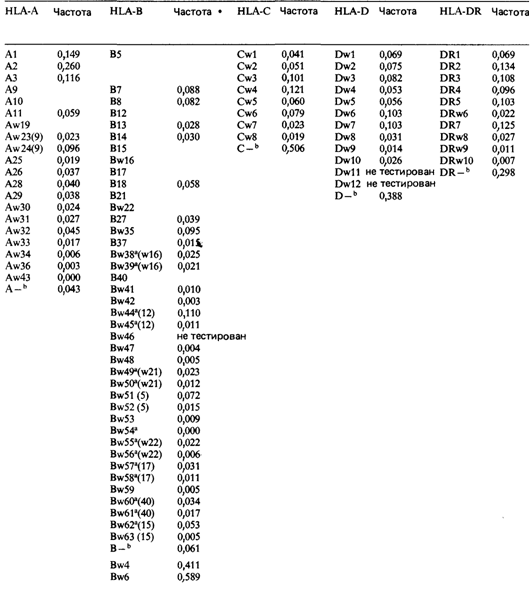
установлены основные соотношения между различными антигенами. И наконец, Киссмейер-Нильсен [739] выдвинул гипотезу о двух тесно сцепленных локусах (А и В), каждый из которых содержит серию множественных аллелей. Феномен формирования передовой группы исследователей. Тем временем в исследованиях по гистосовместимости стал проявляться тот же феномен, который имел место при изучении сцепления методом гибридизации клеток. Сформировалась группа ученых, которые поддерживали между собой тесные контакты, созывали специальные международные совещания, наладили прямой обмен информацией, основали собственный журнал. В этом процессе важную роль сыграло Третье рабочее совещание по гистосовместимости, организованное в 1967 г. Контакты между членами группы были особенно интенсивными, поскольку типирование HLA существенно зависит от обмена антисывороточным материалом. Изучение работы этой группы в конце 60-х-начале 70-х гг. и той роли, которая принадлежала в ней Бодмеру, Доссэ, Цеппеллини, КиссмейеруНильсену, ван Роду и Терасаки, представляет большой интерес для истории и социологии современных биологических исследований. Быстрый прогресс в этой области стимулировался не только чисто научным интересом, но и надеждой на то, что полученные результаты будут способствовать успешной трансплантации органов. Основные компоненты МНС на хромосоме 6. Группа сцепления МНС представлена на рис. 3.36. В настоящее время известны четыре локуса основной системы HLA, расположенные в таком порядке: А, С, В, D (локус D будет обсуждаться дальше). Для каждого из них известно много аллелей, которые идентифицируются специальными антисыворотками. Их список вместе с частотами аллелей приведен в табл. 3.8. Частоты аллелей в других популяциях можно найти у Терасаки [910] и Алберта [553]. Частоты генов в сумме не составляют 100%, поскольку некоторые антигены до сих пор неизвестны (пробелы). Концепция четырех полиаллельных серий основывается на следующих фактах. 1. Нет индивидов, которые были бы носителями более двух антигенов из каждого среди четырех наборов. 2. Между этими наборами наблюдается рекомбинация (например, между локусами А и В). К 1975 г. было выявлено 40 кроссоверов на 4614 мейотических делений, таким образом, суммарная частота рекомбинации составила 40/4614 = 0,0087 = 0,87 сМ. Имеются данные о десяти А—В-рекомбинантах, информативных с точки зрения расположения локуса С: в восьми случаях локус С следовал за В, в двух - за А. Следовательно, локус С расположен между А и В и, вероятно, немного ближе к В. Когда у одного из родителей присутствуют два антигена из одного набора, то он всегда 3. Формальная генетика человека 215 передает ребенку один из этих антигенов, а не оба вместе или ни одного. Сегрегационное отношение составляет 0,5 и соответствует простому кодоминантному типу наследования. 3. Соответствие закону Харди—Вайнберга установлено для каждого из трех наборов аллелей в довольно больших популяционных выборках. 4. Перекрестные серологические реакции характерны для антигенов из одного набора, а не из разных. Это указывает на тесное биохимическое родство антигенов внутри одного набора. На рис. 3.37 на примере одной семьи показано наследование целиком всего комплекса четырьмя из пяти обследованных детей; пятый был кроссовером (рекомбинация между локусами А и С). Смешанные культуры лимфоцитов (CKJI): типирование аллелей локуса HLA-D. Если лимфоциты двух индивидов совместно культивируются in vitro, то, как правило, они стимулируют друг друга к делению. Эта реакция происходит благодаря тому, что на поверхности лимфоцитов имеются и антигены, и рецепторы к другим антигенам. В одностороннем тесте СЛК деление самих стимулирующих лимфоцитов подавлено предварительным воздействием радиации или обработкой митомицином С (рис. 3.38). Фенотип клеток-«ответчиков» (респондеров) можно установить, используя разные линии клеток «стимуляторов» с известным генотипом. Типирование антигенов локуса HLA-D осуществляли с помощью смешанной культуры лимфоцитов. Были разработаны также и новые методы, использующие феномен иммунологической памяти, которая формируется in vitro с помощью смешанной культуры лимфоцитов. Тест на наличие антигенов HLA-Dоснован на быстром и
216 3. Формальная генетика человека
3. Формальная генетика человека 217
сильном ответе на рестимуляцию антигеном, который использовался для иммунизации in vivo. Этот тест был назван «первичным типированием лимфоцитов» (ПТЛ). Независимо от этих методов антигены HLA-D можно типировать стандартным лимфотоксическим тестом, проводимым на обогащенных В-лимфоцитами клеточных суспензиях. В противоположность антигенам HLA-A, HLA-B и HLA-C, которые экспрессируются на поверхности Т- и Вклеток, антигены HLA-D обнаруживаются преимущественно на В-клетках и макрофагах. Впрочем, пока еще остается открытым вопрос, полностью ли идентичны HLA-D-антигены, выявляемые СКЛ-типированием и серологическими реакциями. На рис. 3.39 представлены биохимическая модель белков HLA и их топография на клеточной мембране. HLA-район анализировали также на молекулярном уровне с помощью методов рекомбинантных ДНК (разд. 2.3). Были идентифицированы и секвенированы нуклеотидные последовательности генов основных классов HLA-антигенов и родственных им генов и псевдогенов, кроме того, обнаружен полиморфизм по сайтам рестрикции [621; 652; 839].
Компоненты комплемента. Комплемент представляет собой набор по крайней мере десяти белковых факторов, присутствующих в свежей (неконсервированной) сыворотке крови. Их обозначают Cl, C2, СЗ и т.д. Первый из них активируется антителами к соответствующим антигенам, а С1 активирует затем С4. Этот последний активирует С2 и так далее. Конечным результатом этого «каскада активаций комплемента» является повреждение клеточной мембраны, несущей антиген, а часто и лизис клетки. Кроме того, активированные компоненты комплемента обладают рядом других биологических свойств, таких, как хемотаксис или высвобождение гистамина. Они играют важную роль медиаторов имунного ответа организма на микробную инфекцию. Система комплемента активируется не только фактором С1 (классический путь), но также и фактором С3 – альтернативный путь, использующий «пропердиновые факторы», в частности фактор В (BF), который действует как «проактиватор» компонента СЗ. Для некоторых компонентов комплемента известны случаи наследственного дефицита функции и, кроме того, выявлен 218 3. Формальная генетика человека
полиморфизм. Полиморфными являются компоненты С2, СЗ, С4 и, возможно, С6. Локусы факторов С2 и С4 принадлежат к одной группе сцепления вместе с локусами главного комплекса гистосовместимости, как и локус пропердинового фактора В (с основными аллелями BFF и BFS). С другой стороны, локус С3 (с аллелями C3F и C3S) расположен в другом районе генома. Антигены, ассоциированные с локусом HLA. В разд. 3.7.3 будут обсуждаться факты наличия таких антигенов у мыши и их возможная роль в ассоциациях комплекса HLA и заболеваний у человека. Эксперименты свидетельствуют о расположении таких генов в непосредственной близости к локусу HLA-D/DR. Сцепление с другими маркерами. В 1971 г. было установлено, что локусы МНС сцеплены с геном PGM3 (фосфоглюкомутаза-3). Расстояние по карте от HLA составляет примерно 15 сМ у мужчин и 3045 сМ у женщин. Локус PGM3 расположен в длинном плече хромосомы 6 (рис. 3.36) и, по-видимому, находится ближе к локусу В, чем к А. Локус другого фермента, гидроксилазы-1, расположен между PGM3 и HLA, но уже в коротком плече этой хромосомы. Сцепление с PGM3 дает возможность отнести всю группу сцепления к хромосоме 6 с помощью метода гибридизации клеток и расположить ее, с большей долей вероятности, на расстоянии 75 сМ от центромеры. Свейгард и соавт. (1975) [193] высказали интересную мысль о возможном параллелизме между PGM и Rh-системой: расстояние между комплексом Rh и локусом PGM-1 в хромосоме 1 составляет 35 сМ (у мужчин). Возможно, что эти две группы сцепления имеют общее происхождение. В таком случае комплекс Rh эволюционировал в систему поверхностных антигенов, специфичных к эритроцитам, а комплекс HLA - в сходную систему, но специфичную не к эритроцитам, а ко многим другим типам клеток. У человека и крупного рогатого скота имеются обе эти системы. С другой стороны, у мыши и курицы имеется только одна комплексная система групп крови, которая контролирует антигены как на эритроцитах, так и на лейкоцитах. 3. Формальная генетика человека 219
Значение HLA для трансплантации органов. Один из основных стимулов быстрого прогресса наших знаний о HLA-антигенах связан с надеждой повысить эффективность трансплантации органов, в первую очередь почек. Действительно, почки от HLA-идентичных и АВО-совместимых сибсов приживаются почти с такой же частотой, как при пересадках у монозиготных близнецов. Частота приживаемости ниже в случае пересадок к неродственным реципиентам, даже если соответствие HLA-систем настолько хорошее, насколько это только возможно, и обеспечена совместимость по системе АВО. Это говорит о том, что помимо главного комплекса гистосовместимости, системы HLA, должны существовать и другие системы, важные для пересадки органов. В этом нет ничего неожиданного. У мыши известно большое количество таких систем. Почти при всех пересадках эти системы приводят к реакциям отторжения типа «организм хозяина против пересаженного органа» (рис. 3.40). Однако часто этими реакциями можно управлять с помощью иммуносупрессивной терапии. В настоящее время шансы на приживаемость и длительность нормального функционирования пересаженных почек существенно увеличены (табл. 3.9). Учитывая высокую степень полиморфизма и низкие частоты аллелей системы HLA, успешный подбор подходящего реципиента (не сибса) для пересадки почек требует широкомасштабных международных мероприятий. В настоящее время результаты по трансплантации органов нельзя назвать очень успешными, по-видимому, дальнейшие исследования механизмов гистосовместимости приведут к их улучшению. Неравновесие по сцеплению. Одна из наиболее важных характеристик системы HLA - свойство некоторых HLA-аллелей встречаться вместе чаще, чем это можно было бы ожидать при случайном комбинировании. В табл. 3.10 приведены некоторые примеры. Например, гаплотип (А1, В8) встречается примерно в пять раз чаще, чем ожидается. Рассмотрим два аллеля двух сцепленных локусов с частотами р 1и р 2. При свободной рекомбинации между ними их совместная частота h, т.е. частота гаплотипа, должна составлять р1 · р2. Если получен такой результат, то говорят, что эти два локуса находятся в равновесии по сцеплению. Если частота гаплотипа h выше, чем ожидается при свободной рекомбинации,
220 3. Формальная генетика человека
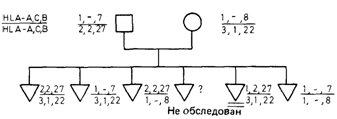
то существует неравновесие по сцеплению (А), которое часто полагают равным А = h — p 1 p 2. Частоты гаплотипов и генов можно оценить из семейных и популяционных данных. В семьях гаплотипы родителей в большинстве случаев могут быть восстановлены по гаплотипам детей. Например, в семье, показанной на рис. 3.37, один из гаплотипов матери должен быть (3, 1, 22), поскольку она передала его трем своим детям. О частоте единичных аллелей можно судить по данным о той же самой выборке неродственных индивидов, а затем можно вычислить величину неравновесия по сцеплению А. В выборке из случайно скрещивающейся популяции отклонение от равновесия по сцеплению оценивают с помощью критерия хи-квадрат (таблица сопряженности 2 х 2), как показано в табл. 3.11 для выборки из датской популяции (данные и расчеты взяты из работы [193]). В системе HLA отклонения от равновесия по сцеплению выражены довольно отчетливо. Эта ситуация сходна с той, которая была описана выше для системы Rh (разд. 3.5.4), но имеется одно важное отличие. В системе Rh обнаружен только один случай рекомбинации, тогда как для HLA-системы известно много таких случаев. Следовательно, сцепление в Rh-системе намного сильнее, чем в системе HLA. Если один случай кроссинговера в Rh-системе можно не принять во внимание или объяснить внутрицистронным обменом, то существует возможность рассматривать Rh-локусы в качестве истинных аллелей; D, С, с, Е и е могут быть в этом случае характеристическими сайтами внутри одного полипептида. Для HLA-локусов такая гипотеза не подходит: расстояния между ними намного больше и об аллельных взаимодействиях говорить не приходится. Как упоминалось выше, факты неравновесия по сцеплению, как и собственно идентификация генов иммунного ответа (Ir) у мыши, стимулировали в последние годы многочисленные попытки поиска ассоциаций HLA-системы с заболеваниями, которые оказались в ряде случаев успешными (разд. 3.7.3). Неравновесие по сцеплению может быть вызвано двумя причинами. 3. Формальная генетика человека 221
1. Какие-либо две популяции, гомозиготные по разным гаплотипам, смешались относительно недавно, и происходящий с низкой частотой кроссинговер еще не обеспечил случайное распределение аллелей. 2. Определенные комбинации аллелей тесно сцепленных локусов дают селективные преимущества их носителям и, следовательно, сохраняются при отборе.
Чтобы решить, какую из этих двух возможностей выбрать, Бодмер (1972) [581] вычислил, как долго будет сохраняться неравновесие в случайно скрещивающейся популяции. Для этих вычислений он использовал результат Дженнингса (1917), в соответствии с которым величина показателя А стремится к нулю со скоростью 1 — θ за поколение, где θ-частота рекомбинаций между двумя локусами. Между локусами HLA-A и HLA-B величина θ составляет примерно 0,008. Если взять в качестве примера неравновесие по сцеплению между HLA-A1 и В8, то для европейских популяций значения А будут равны примерно 0,06-0,1. С другой стороны, для разумных размеров выборок значения Δ в пределах 0,01-0,02 оказываются статистически незначимыми. Следовательно, можно определить, сколько нужно поколений, чтобы уменьшить Δ в 5 раз с 0,1 до 0,02. Используя вышеупомянутый принцип Дженнингса, получаем (1 - θ)n = (1 - 0,008)n = 1/5; n ≈ 200. Это означает, что Δ должно уменьшиться до незначимого уровня примерно за 200 поколений или 5000 лет, если смена поколений происходит приблизительно через 25 лет. С точки зрения эволюции человеческого вида 5000 лет - ничтожный срок. Тот факт, что величина Δ может сойти на нет за такое короткое время при отсутствии отбора, предполагает, что по крайней мере для этого конкретного гаплотипа (HLA-A1, В8) его частота поддерживается на сравнительно высоком уровне действием отбора определенного типа [581]. Мы считаем весьма вероятным, что отбором можно объяснить также некоторые другие распространенные случаи неравновесия по сцеплению и что влияние недавно произошедшего слияния популяций не имеет большого значения. Определенные гаплотипы обладают, по-видимому, селективным преимуществом, и это поддерживает более высокую их частоту в популяции по сравнению с другими. Вместе с тем это 222 3. Формальная генетика человека
селективное преимущество не может быть прямо связано с теми заболеваниями, для которых в настоящее время обнаружены ассоциации, поскольку заболевания эти слишком редкие. Кроме того, для большинства из них характерно позднее начало. Следовательно, необходимо искать факторы, которые в прошлом могли влиять на выживаемость до репродуктивного возраста. Эта тема будет обсуждаться в разд. 6.2.1. Нормальная функция HLA-системы. Антигены этой системы локализованы на поверхности клетки и относятся к так называемым сильным антигенам; они высокополиморфны, и неравновесие по сцеплению существует не только между самими локусами HLA, но, вероятно, также между ними и тесно сцепленными генами иммунного ответа. Ассоциации обнаружены между HLA-антигенами и теми заболеваниями, для которых ранее предполагался аутоиммунный механизм. Кроме того, подобные системы выявлены у всех исследовавшихся до сих пор млекопитающих. Наконец, обнаружено тесное сцепление с другими локусами, имеющими отношение к иммунному ответу. Все эти факты вместе наводят на мысль о существовании сложной целостной системы, регулирующей контакт клеток со средой. В последние годы выяснены многие детали этой функции. Для кооперации различных клеток на разных стадиях имунного ответа требуется индентичность в отношении HLA-антигенов. Такая кооперация имеет место, например, когда макрофаги, будучи первыми антигенсвязывающими клетками, переносят этот антиген к Т-лимфоцитам, а затем Т- и В-лимфоциты совместно инициируют формирование антител (разд. 4.4). Было показано in vitro, что разные гаплотипы различаются по эффективности иммунного ответа, например индукцией пролиферации Т-клеток [623; 942]. Следовательно, поверхностные структуры этих клеток служат важными медиаторами иммунной реакции. Некоторые исследователи полагают, что механизмы распознавания клеток играют важную роль в эмбриональном развитии и дифференцировке, особенно когда они действуют в клетках только определенного типа. Например, la-антигены присутствуют у мыши на В-лимфоцитах, макрофагах и других определенных клетках, но не (или редко) на Т-лимфоцитах или тромбоцитах. Ir-гены первично действуют на совокупность В- и Т-лимфоцитов. С другой стороны, антигены HLA-A, HLA-B и HLA-C присутствуют во всех клетках, кроме эритроцитов. Более конкретная версия состоит в том, что эти антигены важны для развития разных клонов иммунокомпетентных клеток во время эмбрионального развития. Однако гипотеза антигенов дифференцировки не объясняет селективное значение высокой степени полиморфизма этой системы. Другая возможная функция - это защита от вирусной или бактериальной инфекции. Антигенный материал человеческого происхождения может быть включен во внешнюю мембрану вируса, в результате чего этот вирус труднее распознается организмом другого человеческого индивида. Однако, если вирус содержит МНС-материал от генетического отличного индивида, он может быть намного легче инактивирован иммунной системой. Такой механизм объясняет, почему высокий полиморфизм МНСсистемы имеет селективное преимущество. Другая возможная функция МНС-районазащита от «заражения» опухолевыми клетками других особей того же вида. С таким объяснением хорошо согласуются наши представления о важной роли МНС-системы при трансплантации, а также высокая степень ее полиморфизма. Дальнейшее выяснение свойств и функций главного комплекса гистосовместимости поможет нам решить многие проблемы, например: как организм управляет своим взаимодействием со средой и как недавние изменения в окружающей среде могут повлиять на генетическую конституцию в будущем. Полезно задать следующие вопросы: существуют ли в природе другие примеры таких генных кластеров с родственными функциями? Может ли их анализ изменить что-то в наших представлениях о кластере МНС? На самом деле, один такой пример, уже очень тщательно проанализированный, существует - это мимикрия у бабочек. 3. Формальная генетика человека 223
Дата добавления: 2015-12-16 | Просмотры: 734 | Нарушение авторских прав |