|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Анализ сцепления у человека: гибридизация клеток и ДНК-технологияСлияние клеток: первые наблюдения. История открытия этого феномена описана Харрисом [702; 692]. Еще в 1838 г. Мюллер наблюдал двухъядерные клетки в опухолях, впоследствии Робин обнаружил их в костном мозге, Рокитански - при туберкулезной инфекции, а Вирхов-как в нормальных, так и в опухолевых тканях. Вывод о том, что двухъядерные клетки образуются в результате слияния одноядерных, был сделан в работе де Бари (1859). Он обнаружил, что в жизненном цикле определенных мик- 200 3. Формальная генетика человека
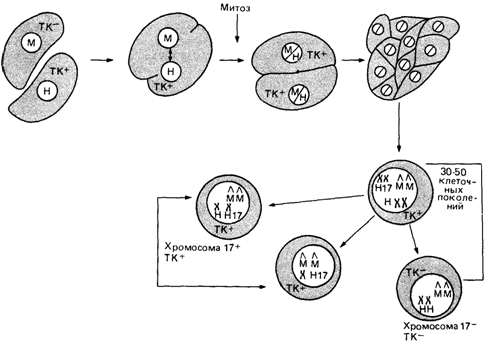
сомицетов происходит слияние отдельных клеток и формирование многоядерных структур. Самые ранние сообщения о многоядерных клетках в поврежденных тканях, появление которых можно было бы определенно приписать действию вируса, принадлежали Лугинбюлю (1873) и Вейгерту (1874), наблюдавшим такие клетки на поверхности оспенных гнойничков. Разработка методов культивирования тканей in vitro дала возможность часто наблюдать феномен слияния и уже к 1927 г. в 21-ой работе имелись ссылки на такие наблюдения. Было обнаружено (Enders, Peebles, 1954), что слияние клеток в культуре ткани и формирование многоклеточных синцитиев может индуцировать вирус кори. В 1958 г. Окада показал, что опухолевые клетки животных быстро сливаются и формируют многоядерные гигантские клетки при культивировании в жидкой среде в присутствии высоких концентраций вируса HVJ (из группы параинфлюэнцы). В 1960 г. Барски с сотр. в смешанной культуре опухолевых клеток двух разных, но родственных линий мышей идентифицировали клетки, возникшие в результате спонтанного слияния. Эти клетки содержали внутри единственного ядра хромосомные наборы обеих родительских линий. Позже группа исследователей во главе с Эфрусси пришла к выводу, что гибридизоваться могут не только клетки близкородственных линий мышей, но и линий с более выраженными генетическими различиями. Однако выяснилось, что частота спонтанного слияния клеток очень низка, а клетки многих типов спонтанно вообще никогда не сливаются и этот процесс необходимо индуцировать. Кроме того, для накопления гибридных клеток при культивировании они должны обладать селективным преимуществом. Вскоре обе проблемы были решены. В 1964 г. Литтлфилду удалось выделить из смешанных культур встречающиеся с очень низкой частотой продукты спонтанного слияния. Для этого он воспользовался методикой, широко применяемой в генетике микроорганизмов. При слиянии двух клеток, характеризующихся недостаточностью по двум разным ферментам, возникали гибриды, обладающие полным набором ферментов и способные расти на среде, лишенной соответствующих пищевых добавок. Харрис и Воткинс (1965) [254] повысили частоту слияния различных клеток путем воздействия вирусом Сендай, предварительно инактивированным ультрафиолетом. С помощью этого метода им удалось показать, что слиться могут клетки самых разных видов организмов и что слившиеся клетки жизнеспособны. С этой работы началось широкое использование метода гибридизации клеток в различных областях клеточной биологии. Утрата хромосом в гибридных клетках человек-мышь и отнесение гена к определенной хромосоме. Вейс и Грин (1967) [938] гибридизовали анеуплоидную мышиную линию клеток (подлинию мышиных L-клеток) с диплоидной линией человеческих эмбриональных фибробластов. Клетки мыши были мутантны по локусу тимидинкиназы (ТК) и не росли на среде HAT. Таким образом, среда HAT была селективной, на ней отбирались клетки, содержащие ТКлокус человека (18830). Два типа клеток смешивали и выращивали в стандартной среде. Через четыре дня культуры помещали в селективную среду HAT. При этом мышиные клетки дегенерировали, и в культуре оставались только клетки человека. Через 14-21 день на монослое человеческих клеток можно было выявить гибридные колонии. Несколько таких колоний изолировали и выращивали более продолжительное время. Их клетки в основном сохранили хромосомный набор мыши, а 75-95% человеческих хромосом были утрачены. Однако почти во всех клетках, выращенных в среде HAT, присутствовала одна человеческая хромосома. Была выдвинута гипотеза, что ген тимидинкиназы расположен именно в ней. Для проверки этой гипотезы контрольные эксперименты проводили на среде, содержащей BrdU (бромдезоксиуридин) - аналог тимина, распознаваемый тимидинкиназой и способный поэтому включаться в ДНК вместо тимина, что приводит к отбору против клеток, содержащих этот фермент. Ту хромосому, которую по харак- 3. Формальная генетика человека 201
терной морфологии выявляли почти во всех НАТ-культурах, ни в одной из BrdUкультур обнаружить не удалось. Авторы сделали вывод о том, что ген ТК действительно расположен в этой хромосоме. Позже было установлено, что хромосома, несущая локус ТК, относится к 17-й паре ([788], рис. 3.26). В результате этой работы были сформулированы два основополагающих принципа. 1. Гибриды клеток мыши и человека имеют тенденцию к утрате многих хромосом человека. Показано, что утрата носит случайный характер, и поэтому среди большого числа гибридов всегда можно найти клетку, сохранившую какую-нибудь одну конкретную хромосому человека. 2. Используя подходящую селективную систему, можно отобрать клетки с определенной ферментативной активностью и локализовать ген этого фермента на конкретной хромосоме. Метод гибридизации клеток позволяет изучать и локализовать гены, продукты которых можно идентифицировать как в клетках человека, так и в клетках животных. Один из путей идентификации - использование селективной системы. С 1967 г. были созданы селективные системы для нескольких ферментов. В одной из них используется локус HPRT Х-хромосомы (раз. 4.2.2.6). Эту систему применяют для идентификации не только Х-сцепленных локусов, но и тех аутосомных, которые транслоцированы на Х-хро- 202 3. Формальная генетика человека
мосому. Существует возможность локализовать и такие гены, для которых селективная система не разработана. В этом случае необходимо, чтобы генные продукты - ферменты, принадлежащие двум видам, имели четкие различия, например, по электрофоретической подвижности. Однако этот метод более громоздкий и основан на детальном биохимическом и цитогенетическом анализе большого количества клеточных клонов. Локализация генов оказалась бы неразрешимой задачей, если бы со временем не были разработаны методы идентификации хромосом с помощью дифференциального окрашивания. Метод окрашивания и идентификация хромосом. Дальнейшие успехи в картировании связаны с появлением новых методов идентификации индивидуальных хромосом, основанных на их дифференциальном окрашивании. Благодаря этим методам можно идентифицировать не только целые хромосомы, но и отдельные их части. В гибридных культурах довольно часто возникают хромосомные разрывы и перестройки. Это создает предпосылки для подходящей селекции гибридных клонов, содержащих интересующие нас части хромосом. Именно так некоторые локусы были отнесены к определенным хромосомным сегментам (или группе соседних сегментов). Другие источники информации о локализации генов. Другим методом, используемым для локализации генов, является ДНК-РНК-гибридизация in situ. В этом методе меченая информационная РНК искомого гена (или кДНК, получаемая из мРНК с помощью фермента обратной транскриптазы) гибридизуется с предварительно денатурированной хромосомной ДНК. Последовательности кДНК или иРНК, гибридизуясь со своими ДНК-копиями в хромосомах, будут обнаруживаться в конкретных участках определенных хромосом. В настоящее время этот метод используют для изучения распределения в хромосомах высокоповторяющихся последовательностей ДНК, а также для локализации уникальных нуклеотидных последовательностей, для которых существуют подходящие ДНК-зонды. Если мы имеем дело с повторяющейся ДНК, удельной радиоактивности зонда вполне достаточно для визуализации участков гибридизации даже в одной метафазе (разд. 7.2.2). В случае же уникальных последовательностей ДНК, соответствующих, например, генам заболеваний с простым типом наследования, анализ одной метафазы явно недостаточен (ввиду наличия на радиоавтографе фоновых сигналов). Тогда используется статистический подход, т. е. анализируют суммарные распределения радиоавтографического сигнала (зерен метки) по многим метафазам. Полиморфизм ДНК и картирование. В последние годы выявляется все больше случаев полиморфизма ДНК по сайтам рестрикции (разд. 2.3.2.7, 6.1.2). Это обстоятельство раскрыло новые дополнительные возможности картирования генома человека. Установление тесного сцепления с рестрикционным маркером ДНК позволило локализовать гены многих важных наследственных болезней в конкретных хромосомных сегментах. На рис. 3.24, А представлена большая родословная с хореей Гентингтона. ДНК-маркер и, следовательно, ген хореи расположены на хромосоме 4. Модельные расчеты [584; 754; 887] показали, что для картирования всего генома необходимо лишь несколько сотен рестрикционных маркеров ДНК, случайным образом распределенных по геному человека. Для целей медико-генетического консультирования и пренатальной диагностики (разд. 9.1) достаточен по крайней мере один маркер, тесно сцепленный с геном данного наследственного заболевания. Недавно для изучения новых маркеров использовали линии лимфобластов от индивидов из больших семей, в трех поколениях которых известны генотипы по многим локусам RFLP (от англ. restriction fragment length polymorphism - полиморфизм по длине рестрикционных фрагментов) [944]. С увеличением количества известных локусов рестрикционного полиморфизма становится все более важным анализ сцепления не только между двумя генами (например, один из них – ген заболевания, а другой – рестрикционный маркер), но также между 3. Формальная генетика человека 203
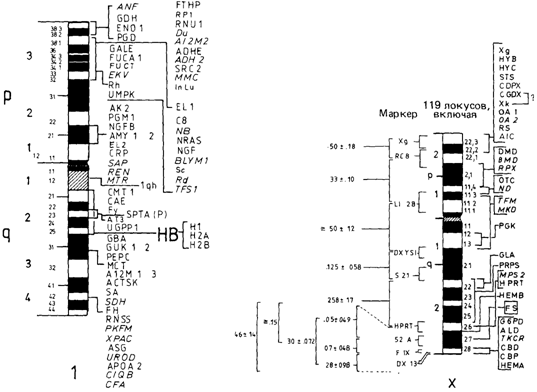
геном заболевания и набором (более или менее тесно сцепленных) маркеров - гаплотипом. Такие гаплотипы широко применяются в генетическом консультировании и пренатальной диагностике талассемии (разд. 4.3). Используя наборы маркеров, можно существенно увеличить число родственников, генотипы которых оказываются информативными для анализа сцепления и, следовательно, для постановки диагноза (разд. 3.4.2). В последние годы достигнуты большие успехи в выявлении сцепления и в локализации локусов в определенных хромосомах. Каждые два года собираются международные конференции, которые публикуют итоговые материалы своей работы. Ученые, работающие в этой быстро развивающейся области науки, создали свою собственную независимую от официальных каналов систему научного взаимодействия. Современное состояние проблемы локализации генов в аутосомах. Представленная выше информация суммирована на рис. 3.27 и 3.28, а также в табл. П.9.5, в которой представлены методы картирования. Х-сцепленные гены. Отнесение локусов к Х-хромосоме не вызывает затруднений, если родословные обнаруживают типичную 204 3. Формальная генетика человека
картину Х-сцепленного наследования. Приписывание же локусов конкретным сегментам Х-хромосомы требует помимо семейных исследований применения новейших методик. Почти все Х-сцепленные локусы (а их больше чем 115) отнесены к этой хромосоме на основе анализа родословных (и для многих из них это подтверждено методами гибридизации соматических клеток). Лишь небольшая часть генов локализована с помощью методов гибридизации соматических клеток. Многие локусы посредством этих методик можно приписать определенным участкам Х-хромосомы. Такие исследования дополнялись и часто подтверждались анализом сцепления в семьях. Были идентифицированы два генных кластера: Xg-кластер, охватывающий гены, сцепленные с геном группы крови Xg (31470), и G6PD-кластер. Ген Xg расположен близко от конца короткого плеча (сегмент Хр 22.3) и тесно сцеплен с локусом ихтиоза (стероидная сульфатаза, 30810). Локус G6PD (30590) расположен в сегменте Xq28 недалеко от конца длинного плеча. К этому кластеру принадлежат гены гемофилии А (30670) и В (30690), гены, детерминирующие умственную отсталость с ломкой Х-хромосомой (30955; разд. 8.2. 1.2), и ген HPRT (30800, разд. 4.2.2.6). В него входят также гены протанопии (30390) и дейтеранопии (30380)-цветовой слепоты. На рис. 3.28 показаны сайты локализации генов. Локусы вблизи теломерного конца короткого плеча (Xg, Х-сцепленный ихтиоз) не вовлекаются в инактивацию (разд. 2.2. 3.3). Этот сегмент Х-хромосомы во время мейоза конъюгирует с Y-хромосомой (разд. 2.1.2.4). В генных банках Х-хромосом уже изолированы и идентифицированы многие ДНК-зонды (разд. 2.3.2.5) [624; 750]. В опытах по гибридизации с такими ДНКзондами показано, что Х-хромосома имеет гомологию с Y-хромосомой не только по районам короткого плеча (с которыми она обычно конъюгирует), но и по другим областям [848]. Эти результаты важны для нашего понимания эволюции половых хромосом и механизмов генотипической детерминации пола (разд. 7.2.1). На рис. 3.28 в качестве примера показано маркирование сегментов Х-хромосомы на основе полиморфизма по длине рестриктов. В последнее время обнаружено много случаев рестрикционного полиморфизма. Делается попытка использовать этот феномен для пренатальной диагностики Х-сцепленных заболеваний (разд. 9.1). Неравномерное распределение рекомбинационных событий по длине хромосомы 1. Огромный поток новой информации ставит и новые задачи. Наиболее важен вопрос о том, существует ли для генов с родственными функциями тенденция к тесной кластеризации на одних и тех же хромосомах? Мы обсудим эту проблему в разд. 3.5 более подробно. Другой важный вопрос заключается в том, совпадают ли генетические расстояния, оцениваемые в ходе семейного анализа сцепления, с расстояниями, получаемыми на основе картирования с помощью клеточных гибридов человек—мышь, в которых сохранились частично делетированные хромосомы человека? Имеющиеся на сегодняшний день данные, касающиеся хромосомы 1, свидетельствуют о хорошем, хотя и не абсолютном соответствии между сайтами локализации (и расстояниями), полученными по физическим данным, и теми, которые базируются на семейных данных [736]. Анализ сцепления количественных признаков. В ранних исследованиях по сцеплению иногда изучали и количественные признаки с мультифакториальным наследованием. При этом рассчитывали, что анализ сцепления позволит выявить главные гены, оказывающие влияние на эти фенотипы. Теоретически такой подход вполне корректен. Если измеряемый признак обнаруживает очень тесное сцепление с генетическим маркером, это на самом деле указывает на главный ген, тесно сцепленный с геном-маркером. Если удается обнаружить сцепление для двух измеряемых признаков, то оба они могут быть связаны с влиянием двух главных генов. Однако к выводам следует относится с большой осторожностью. Следует всегда помнить, что 1) если одновременно анализируют много количественных признаков, то наличие сцепления можно зафиксировать за счет чисто случайных флуктуации критериев значимости; 2) сцепление приводит к наличию корреляций в семьях, но не в популяции. Ассортативное 3. Формальная генетика человека 205
скрещивание может иногда обусловливать ассоциацию измеряемых градуированных признаков. Достигнутые до сих пор результаты по количественным признакам не воодушевляют. С появлением множества новых рестрикционных ДНК-маркеров возможности анализа этих признаков возросли, но интерпретация данных, получаемых в ходе таких исследований, по-прежнему очень трудна. ДНК-варианты в анализе сцепления. Большое количество полиморфных локусов ДНК дает в руки исследователей много новых маркеров. Когда имеют дело с ген-специфическими ДНК-зондами (табл. 2.13), такими, как, например, в β-глобиновом локусе, физическое расстояние от сайта полиморфизма до сайта β-гемоглобинопатии настолько мало, что возможностью рекомбинации между ними можно пренебречь. С другой стороны, сцепление между локусом генетического заболевания и «анонимным» ДНК-зондом вряд ли будет очень тесным. То же самое рассуждение применимо для сцепления, установленного между ген-специфическим зондом и локусом заболевания, которое биохимически не связано с этим зондом. При таких обстоятельствах обычно будут обнаруживаться кроссоверы между ДНК-маркером и геном заболевания. Примерами могут служить маркеры болезни Гентингтона (маркер G8, 5сМ) и мышечной дистрофии Дюшенна (Х-сцепленные маркеры, 15 сМ) [369; 667, 2306]. Между RFLP-сайтами данного локуса часто обнаруживают неравновесие по сцеплению. Поскольку эти сайты очень тесно сцеплены, кроссинговер между ними очень редок, и пройдет немало поколений, прежде чем будет достигнуто равновесие по сцеплению. Кроме того, современные данные свидетельствуют о том, что уровни рекомбинации в пределах тесно сцепленных RFLP-маркеров могут сильно варьировать, т.е., по-видимому, существуют «горячие» и «холодные» сайты рекомбинации [1097, 1959]. Практическое применение результатов исследований по сцеплению. До недавнего времени исследования по сцеплению представляли в основном теоретический интерес. Теперь появилась возможность практически применять полученные знания. Например, если ген А вызывает редкое наследственное заболевание, проявляющиеся в позднем возрасте, а ген В является генетическим маркером, тесно сцепленным с А и сегрегирующим в той же семье, то заболевание можно предсказать еще в раннем возрасте. Например, локусы гемофилии А и маркера G6PD тесно сцеплены. Следовательно, информация о типе G6PD необходима для вычисления риска быть гетерозиготной по гену гемофилии А для сестры больного гемофилией. Предположим, что мать – гетерозигота G6PD А/В, а пробанд-гемизигота А. Если его сестра - гомозигота В, то она должна была унаследовать аллель В от матери. Следовательно, она унаследовала Х-хромосому, несущую аллель В и, весьма вероятно (при отсутствии кроссинговера), нормальный аллель для продукции фактора VIII. В этом случае существует маленький (или вовсе не существует) риск для ее сыновей унаследовать ген гемофилии А. В пренатальной диагностике гемофилии А руководствуются теми же принципами. Поскольку миотоническая дистрофия и ген секретора сцеплены, типирование секретора используется для выявления эмбрионов с миотонической дистрофией при внутриутробной диагностике [895а]. Пренатальная диагностика β-талассемии осуществляется посредством идентификации в ДНК клеток амниотической жидкости сайтов RFLP, тесно сцепленных с Нbβ-геном [1253]. Этот подход имеет несколько ограничений, которые не всегда учитывают. Во-первых, должна существовать гетерозиготность по ДНК-маркеру. Если в данной семье не наблюдается вариация подходящего локуса ДНК, то диагностика становится невозможной. К счастью, достижения в этой области растут, идентифицируется все больше вариантов ДНК. Если гетерозиготность по маркерному локусу ДНК существует, семья должна быть достаточно большой, чтобы провести необходимые исследования на нескольких членах семьи и сделать соответствующий вывод о сцеплении маркерного гена с геном заболевания. 206 3. Формальная генетика человека Особенно удобны большие группы родственников, но на практике они редко встречаются. Х-сцепленные заболевания более предпочтительны для анализа, чем аутосомные, поскольку мужчины имеют только одну Х-хромосому, что упрощает точное приписывание сцепленного маркера гену заболевания (рис. 3.28). При Х-сцепленных летальных болезнях, таких, как мышечная дистрофия Дюшенна, и в меньшей степени при гемофилии (разд. 9.1) имеется много новых мутаций. Часто невозможно определить, где появились новые мутации: в зародышевых клетках родительского или прародительского поколения. Если мутация произошла у родителей, то сестра больного не рискует оказаться носительницей, однако риск будет составлять 50%, если мутация произошла в прародительском поколении. Решение этой проблемы может оказаться трудным, поскольку биохимически тестируемый носитель часто не является достаточно информативным по ДНК-маркерам (приложение 8, разд. 4.2. 2.8). При анализе британских семей с болезнью Гентингтона было показано, что только 15% из них имели структуру, подходящую для идентификации гена болезни Гентингтона у взрослых, которые имели 50%-ный риск, хотя все семьи были информативными по ДНК-маркеру [2307]. Этот результат объяснялся отсутствием живых прародителей и наличием малого числа пораженных сибсов. В противоположность этому практически полезный диагноз в отношении плода (или уже родившегося ребенка) в семьях, где прародитель имел болезнь Гентингтона, был возможен в 90% случаев. Примерно в половине таких случаев болезнь можно было вполне определенно исключить, тогда как в другой половине случаев имелся 50%-ный риск заболевания. Точная дородовая диагностика осуществима только тогда, когда возможно определенное предсказание в отношении родителей (т.е. в 15% семей, как это было выше).
Дата добавления: 2015-12-16 | Просмотры: 1703 | Нарушение авторских прав |