|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Приложение 8. 239 1 страница
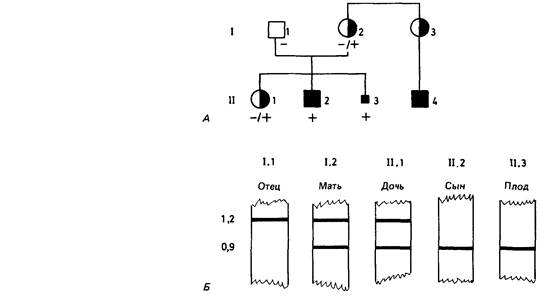
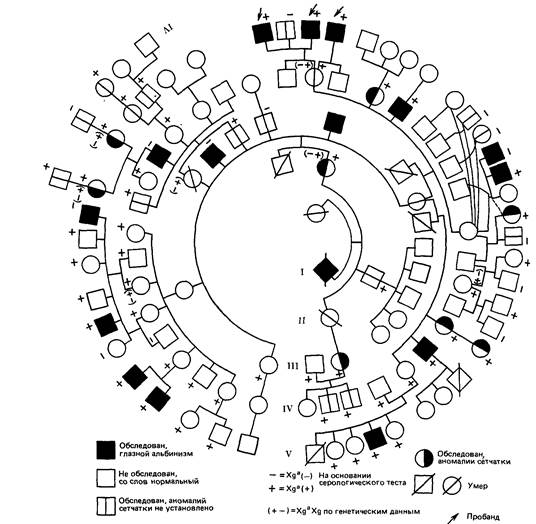
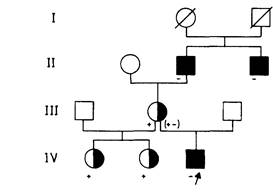
Приложение 8 Данные о ПДРФ ее семьи (рис. П.8.7). свидетельствуют о том, что эта женщина (III, 2) унаследовала нормальную Х-хромосому (В2) от матери, хотя наблюдаемая картина могла быть следствием кроссинговера. С учетом расстояния между маркером и соответствующим геном ее шанс быть носителем (если основываться лишь на информации о ПДРФ) составляет 15%, т.е. шанс кроссовера. Объединение всей информации снижает риск носительства для нее до 1,4%, а риск иметь пораженного сына до 0,7%. Появляется все больше данных о ПДРФ для гемофилии А и В. Оказалось, что практически все женщины гетерозиготны по пробе (специфической к гену или сегменту Х-хромосомы) для гемофилии А. Если по структуре родословной мы не можем сделать какого-либо вывода, вполне корректна постановка диагноза носительства гемофилии А с помощью ПДРФ (рис. П.8.8, П.8.9). Повторный риск для детей непораженных носителей гена при аутосомно-доминантном наследовании. Иногда клинически непораженный индивид, у которого есть родственники с аутосомно-доминантным заболеванием со сниженной пенетрантностью, хочет получить совет относительно риска заболевания для своих детей. Независимо от точного значения пенетрантности было показано, что риск для детей индивида с 50%-ным риском никогда не превысит 9% [2366]. Причина этого заключается в том, что непораженный родитель вряд ли является носителем гена заболевания с высокой пенетрантностью. Наоборот, для болезней с низкой пенетрантностью, даже если родитель является носителем гена, вероятность для ребенка быть клинически пораженным мала. Приложение 9 Примеры расчета сцепления
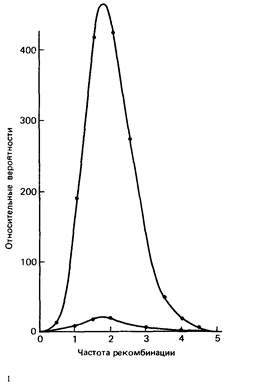
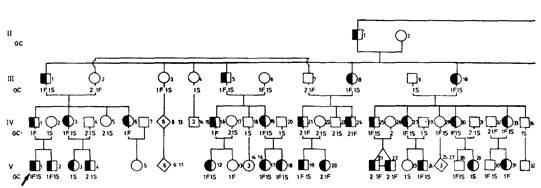
Приложение 9 245 мацию для отбора тестовых локусов, а уже затем проводить более детальный анализ. Если известно, что два тестовых локуса относительно тесно сцеплены, то следует изучать только один из них. Например, HLA-тестирование требует много времени и средств. Между тем локус Bf тесно сцеплен с HLA, но его протестировать намного легче. Следовательно, для скринирования следует использовать именно этот локус. При увеличении числа локусов, которые можно включить в анализ сцепления, шансы установления сцепления возрастают. Например, если локусы равномерно распределены по геному и если анализ сцепления указывает на θ = 0,4 как на максимальное значение частоты рекомбинации, вероятность выявления по крайней мере одного сцепления равна 0,35 при 20 маркерах и 0,5 при 30 маркерах. Дополнительную информацию дает знание о принадлежности маркеров конкретным хромосомам. Например, обнаружение сцепления с редкой кожной аномалией (акрокератоэластоидоз) дает положительные, но статистические незначимые логарифмические шансы для двух маркеров; остальные маркеры дают отрицательные шансы. Обычно больше никаких выводов сделать нельзя. Однако, поскольку ранее для этих двух локусов была установлена принадлежность хромосоме 2, то главный локус также можно приписать этой хромосоме и предположить сцепление с маркерным локусом [688 а]. Как упоминалось в разд. 3.4.2, реальное расстояние по карте между двумя локусами можно получить на основе оценки θ по рис. 3.26. С увеличением плотности генетической карты человека все чаще будет устанавливаться сцепление трех и более локусов. Для оптимального картирования целого района следует объединить оценки частот рекомбинации между парами таких локусов. Правила и формулы для такого многоточечного картирования можно найти в работе [612 а]. В последние годы в анализ сцепления вовлекается все большее количество полиморфных систем по сайтам рестрикции (разд. 2.3.3.9). Этот анализ приобретает поэтому все большую ценность в медицинской генетике. При использовании полиморфных сайтов многоточечное картирование станет скорее правилом, чем исключением. На рис. П.9.6 приведена большая родословная, в которой аутосомно-доминантное заболевание-несовершенный дентиногенез (12550)сегрегирует вместе с GC-типами белка [559] Имеются три аллеля GC1S, GC1F и GC2. Полный анализ родословной подразумевает вычисление вероятностей генотипов индивидов, которые не могли быть типированы по маркеру (I.1,2; II. 1,2). Тогда можно подсчитать шансы всей родословной Этот подсчет труден, но, к счастью, имеется компьютерная программа (LIPED), и детальное описание ее работы можно получить у автора, д-ра Отта [831].
246 Приложение 9 В табл. П.9.3 приведены логарифмические шансы для θΜ (частота рекомбинации у мужчин) и θρ (частота рекомбинации у женщин). Максимальный логарифмический шанс составляет 7,9238 при θΜ = 0,05 для мужчин и θF = 0,25 для женщин. В табл. П.9.4 представлены более подробные расчеты для «критической» области табл. П.9.3: наилучшие оценки θΜ = 0,05 и θF = = 0,24, логарифмический шанс z = 7,9277.
Приложение 9 247 Продолжение табл. П.9.5 7. HS ДНК/кДНК гибридизация в растворе («кот-анализ»), например, картирование бета-глоби- нового гена в хромосоме 11 на основе анализа ДНК, выделенной из клонированных гибридных клеток. 8. RE - рестрикционный анализ и реконструирование физической карты района, например, в случае кластера бета-глобиновых генов (НВВС) в хромосоме 11р или в участке физического сцепления трех фибриногеновых генов в 4q или в случае кластера аполипопротеиновых генов АРОА1, АРОС3 и АРОА4 в 11 q: а) в комбинации с методом гибридизации соматических клеток, например, в случае НВВС в 11р; б) в комбинации с сортировкой изолированных хромосом, например, в случае картирования гена инсулина в районе lip; (включая методику LEBO с использованием двулучевого лазерного сортера хромосом и дот-блот-гибридизации как при картировании гена М-фосфорилазы гликогена (PYGM) в llq). 9. D - картирование с помощью делений (сочетание хромосомной делении и фенотипических признаков гемизиготности), с помощью трисомий (наличие трех аллелей высокополиморфного локуса) и эффекта дозы гена (корреляция трипликации части или всей хромосомы с 50%-ным или большим увеличением активности генного продукта); примеры картирования: кислая фосфатаза-1 (ACP1) в 2р; глутатион-редуктаза (GSR) в 8р. (Метод включает также анализ копийности ДНК как, например, в случае фибриногеновых генов, картированных в сегменте 4q2.) 10. AAS- на основе сравнения аминокислотных последовательностей белков; например, пред- положение о сцеплении дельта- и бета-глобиновых генов следует из данных по аминокислотной последовательности гемоглобина Лепоре (Lepore), содержащего фрагменты обоих полипептидов; (метод может включать также анализ «гибридной» структуры белка с помощью моноклональных антител; так, вывод о тесном сцеплении локусов MN и Ss был сделан также и на основе изучения лепоре-подобного варианта антигенов группы крови MNSs). 11. LD - установление факта неравновесия по сцеплению, например, в случае бета- и дельта-глобиновых генов (НВВ, HBD). 12. V - индукция аденовирусом визуально явного изменения морфологии определенного участка хромосомы (изменения, вероятно сходного по феноменологии с «пуффингом» в политенных хромосомах у насекомых и сопровождаемого активацией киназ); таковы примеры сайтов модификации на хромосомах! и 17 аденовирусом 12. 13. СН - изменение морфологии хромосомного участка в сочетании с характерным фенотипом, но при неустановленном сцеплении (метод FC) или невыявленных делениях (D) и вирусных модификациях (V); например, отсутствие сегмента 13ql4 в некоторых случаях ретинобластомы. К этой группе методов относится и анализ «ломких» (фрагильных) сайтов в хромосомах. Например, фрагильный сайт в сегменте Xq27 является специфическим маркером одной из форм Х-сцепленной умственной отсталости. Фрагильные сайты полезны как маркеры в семейных исследованиях сцепления, например, FS16q22 и гаптоглобина. 14. ОТ - центромерное картирование, например, по данным о сцеплении фосфоглюкомутазы-3 (PGM3) с центромерой хромосомы 6. 15. ЕМ - исключающее картирование, т.е. сужение возможной области локализации генов путем исключения районов генома, покрываемых картированными делециями. Исключить какие-то районы можно и на основе данных об отрицательных величинах лод-баллов, полученных при анализе сцепления в семьях с маркерными хромосомами и другими картированными локусами; так, например, были получены данные в пользу локализации генов MNSs в районе 4q. 16. H - на основе установленной гомологии (или эволюционной консервативности) групп генной синтении; правда, в ряде случаев это может привести к ошибочным предположениям как, например, в случае вывода о локализации гена С-полипептида лактатдегидрогеназы (LDHC) в 12р, позже картированного в 11-й хромосоме. Степень надежности установленной региональной локализации генов в хромосомах или сцепления между двумя локусами оценивается по четырем градациям: С - (confirmed) «подтверждено»: т.е. наблюдалось по крайней мере в двух лабораториях или в нескольких семьях из разных источников; P - (provisional) «предварительно» («пока условно»): т.е. установлено по данным из одной лаборатории или об одной семье; I - (inconsistent) «противоречиво»: т.е. результаты разных лабораторий не согласуются; T,L- и т.п. - (tentative, in limbo) «сомнительно», «в архив»: т.е. установлено менее надежно, чем в случае (Р), но регистрируется по эвристическим соображениям. Литература 1. Hirschhorn K. (ed.) 1970-1986. Advances in human genetics, Vol. 1-15, Harris H., New York, Plenum. 2. Alberts В., Bray D., Lewis J., Raff M., Roberts K., Watson J.D. (1983). Molecular biology of the cell, Garland Publ., New York, London. 3. Anastasi A. (1958). Differential psychology, 3rd ed. McMillan, New York. 4. Anderson T. W. (1958). An introduction to multivariate stastistical analysis, Wiley, New York, London, Sindey. 5. Applebaum E. G., Firestein S. K. (1983). A genetic counseling casebook, The Free Press, New York. 6. Baraitser M. (1982). The genetics of neurological disorders, Oxford Univ. Press, Oxford etc. 7. Barthelmess A. (1952). Vererbungswissenschaft, Alber, Freiburg, München. Дата добавления: 2015-12-16 | Просмотры: 630 | Нарушение авторских прав |