|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
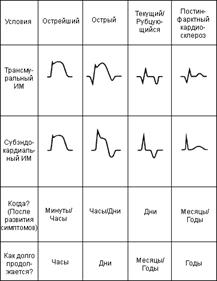
Изменения ЭКГ при инфаркте миокарда с течением времени
Помимо клинических данных и ЭКГ, в диагностике инфаркта миокарда существенное значение имеет резорбционно-некротический синдром — неспецифическая реакция миокарда, возникающая вследствие асептического некроза, всасывания продуктов некроза и эндогенной интоксикации. Его критерии: лихорадка, гиперферментемия (ферменты выходят из погибших миоцитов при разрушении их мембран) и изменения общего анализа крови. Верификация инфаркта миокарда базируется на существенном росте уровня кардиоспецифических ферментов в плазме. Весьма важны сроки определения уровня ферментов у больного ИМ. Ферменты «быстрого реагирования», которые выходят в периферический кровоток из зоны некроза: • тропонин-Т (специфический миокардиальный белок, отсутствующий в скелетных мышцах) имеет первый пик роста через 2—3 ч с максимумом через 8—10 ч, и высокий уровень сохраняется на протяжении 4-7 дней. Однократное измерение этого теста через 72 ч может быть показателем распространенности ИМ. Тропониновый тест имеет прогностическое значение: если у больного с НСт нет повышения тропонина (в начале ангинозного приступа и через 12 ч), то у него отсутствует свежий инфаркт миокарда. Обычно для верификации диагноза ИМ достаточно двух исследований тропонина-Т (в отличие от необходимости многократных исследований МВ-КФК и КФК). При мелкоочаговом инфаркте миокарда тропонин начинает повышаться с такой же скоростью, как и МВ-КФК, но возвращается к норме более длительно (до 7—14 дней начального периода). • изофермент МВ-КФК более специфичен (в высоких концентрациях отмечен только в сердце, но в небольших концентрациях содержится в скелетных мышцах). Уровень менее 10 мкг/л указывает на мелкоочаговый ИМ, а более 10 мкг/л — на крупноочаговый. Чтобы исключить ИМ, МВ-КФК регистрируют каждые 8 ч (нужны минимум 3 отрицательных результата). Оценка МВ-КФК весьма полезна, когда имеется сопутствующее поражение мышц или мозга (в них есть КФК, но нет МВ-КФК); • суммарная КФК (норма - 20-80 усл. ед., или до 1,2 ммоль/л, в СИ) повышается через 4—6 ч (пик через 1—2 суток), а нормализуется на 4-й день. КФК содержится не только в сердце, но и в скелете, мышцах, мозге, потому рост ее может быть обусловлен травмами или болезнями мышц (полимиозит, миопатия); катетеризацией сердца; ИЭ и миокардитом (при которых интервал ST может повышаться во многих отведениях); ЭИТ; длительной иммобилизацией; шоком или алкогольной интоксикацией. Необходимо определять КФК в динамике (3-4 раза). Уровень КФК ее возрастает в ходе первых, суток, сохраняется стабильным в течение 3—4 суток и снижается к 6-7-м суткам. Пиковый уровень КФК (и МВ-КФК) на 2-е сутки после ИМ в большей мере, чем другие сывороточные маркеры, указывает на размер некроза. Ранняя диагностика инфаркта миокарда (6—8 ч от начала) с помощью этих кардиоспецифических тестов важна для «сортировки» больных с наличием боли в грудной клетке, для определения соответствующего лечения вследствие объективных трудностей разграничения кардиальной ишемии от ИМ на основе клинических данных. В целом, исследование биохимических специфических маркеров некроза миокарда весьма важно (особенно, если данные ЭКГ позволяют сомневаться в диагнозе инфаркта миокарда). На основе их величин выделяют ОКС с некрозом (ИМ) и без некроза (НСт). Диагностика кардиоспецифических сывороточных ферментов (находившихся в миокардиоцитах и при их разрушении оказавшихся в кровяном русле) имеет большое значение для верификации ИМ без Q. Сроки увеличения активности кардиоселективных ферментов при ИМ различны:
В настоящее время имеются поликомпонентные наборы для определения всех трех кардиоспецифических ферментов некроза миокарда, что оптимально для неотложной кардиологии. Относительно изменений формулы крови, то они не всегда специфичны и могут быть при других заболеваниях. При допплеровском исследовании определяют особенности нарушенной внутрисердечной гемодинамики. Эхокардиография является методом выбора (золотым стандартом) в диагностике таких осложнений ИМ как перикардит, разрывы миокарда, острая митральная недостаточность при отрыве сосочковой мышцы, острая аневризма желудочка, внутрисердечный тромбоз, а также при осложненном течении ИМ, когда нет возможности осуществить мониторинг давления заклинивания легочной артерии для оценки состояния центральной гемодинамики. В большинстве случаев, при необходимости мониторинга функции левого желудочка на фоне лечения, данному методу ввиду его простоты и неинвазивности следует отдать предпочтение. Сцинтиграфия миокарда с технецием-99т пирофосфатом используется для диагностики ИМ в некоторых затруднительных случаях, например, при блокаде левой ножки пучка Гиса, неоднозначных результатах ферментативного анализа, в частности, при поздней госпитализации больного, когда активность ферментов снижается, а также в других ситуациях, если для подтверждения ИМ после проведения стандартных исследований, включая двухмерную эхокардиографию, требуются дополнительные данные. Накопление пирофосфата в зоне острой ишемии начинается через 12–36 час от начала заболевания. Рубцовая ткань после перенесенного ИМ не накапливает пирофосфат. Оптимальные сроки для проведения сцинтиграфии с пирофосфатом – 2–7 сутки от начала ИМ. Сцинтиграфия миокарда с таллием-201, накапливающемся в перфузируемых тканях (с образованием «холодных очагов»), наиболее информативна при остром ИМ, если она проводится вскоре после ангинозного приступа. Применение компьютерной трансмиссионной томографии для оценки очаговой ишемии миокарда и величины некроза имеет ряд ограничений. Однофотонная эмиссионная компьютерная томография позволяет осуществить пространственную визуализацию зоны ишемии с помощью множественных томографических срезов. Перспективы использования метода для оценки размеров некроза пока не ясны. Эхокардиография" (Эхо-КГ) Экстренная коронарная ангиография 8. Тромболитическая терапия при инфаркте миокарда: методика проведения, показания и противопоказания, оценка эффективности, осложнения. Понятие о реперфузионном синдроме. Наиболее оправдана рано начатая тромболитическая терапия. При этом идеальной является ситуация, когда такая терапия начинается еще на догоспитальном этапе врачом кардиологической бригады скорой помощи. Введение тромболитических препаратов в 1-й час заболевания снижает 35-дневную летальность в среднем на 27 %, а через 7–12 ч – только на 13 %. После применения тромболизиса через 13–24 ч от развития ангинозного приступа влияние на показатели смертности такого лечения не наблюдается. На практике тромболитическая терапия проводится в сроки до 6 час от начала ИМ. Может быть использовано 2 способа введения тромболитического препарата: внутривенно и внутрикоронарно. Внутрикоронарный тромболизис, хотя и представляется на первый взгляд предпочтительнее, всегда проигрывает во времени и по сложности. На его организацию требуется время, поскольку необходимо предварительно провести коронарографию, не исключено, что именно из-за потери времени результаты внутривенного и внутрикоронарного тромболизиса существенно не различаются. Однако при внутрикоронарном введении значительно уменьшается доза тромболитика, что позволяет резко снизить опасность геморрагии. Но в клинической практике, как правило, используется внутривенный системный тромболизис. Показания к проведению тромболитической терапии: 1. Вероятный ИМ в первые 4–6 час при наличии длительного приступа ангинозной боли (30 мин и более), не купирующегося приемом нитроглицерина (при отсутствии других причин боли) и сопровождающегося «свежими» изменениями на ЭКГ (подъем сегмента ST более 1 мм, блокада левой ножки пучка Гиса). 2. Определенный ИМ с патологическими зубцами Q в первые 4–6 (до 12) часов от начала болезни (длительного приступа ангинозной боли). 3. Рецидивирующее течение ИМ. 4. Тромбоз и эмболия магистральных и периферических сосудов. Противопоказания к проведению тромболитической терапии:
Тромболизис не показан, если не известно точно время начала ИМ или если тромболизис не может быть проведен в первые 12-24 ч. При состоявшейся диагностике инфаркта миокарда больному в течение первых 6 ч целесообразно назначить тромболизис, так как ИМ любого типа в большинстве случаев обусловлен развитием тромбоза. Развивающийся некроз миокарда сопровождается большим выходом факторов (адреналина, АДФ, кусков базальной мембраны), вызывающих начало свертывания Обычно для тромболизиса применяют проактиваторы фибринолизина стрептокиназу, урокиназу, образующие комплекс с плазминогеном и переводящие его в активную форму - плазмин — с последующим расщеплением фибринового компонента тромба Современная тромболитическая терапия при ИМ базируется на применении высоко активных и сравнительно безопасных средств, котрые переводят эндогенный плазминоген из неактивного состояния в активное – плазмин. Последний разрушает фибрин. Наиболее часто в настоящее время при ИМ используются следующие тромболитические средства. Стрептокиназа (стрептаза, авелазин, цепиаза) – белок, продуцируемый гемолитическим стрептококком. Вводится внутривенно капельно на 50–100 мл изотонического раствора хлорида натрия в течение 30–60 мин 1–15 000 000 ME препарата (или предварительно болюсом 250 000 ЕД, а потом остальная доза). Возможны аллергические реакции, снижение АД при быстром введении. Рекомендуется предварительно до введения стрептокиназы – в/в струйно 30 мг. преднизолона. Анизоилированный плазминоген – стрептокиназный активированный комплекс (АПСАК, анистреплаза) – анизоилированное производное комплекса лизин-плазминоген-стрептокиназа. Вводится внутривенно струйно в течение 5 мин в дозе 30 ЕД. Для предотвращения аллергических реакций рекомендуется предварительная внутривенная инъекция 30 мг преднизолона. Тканевой активатор плазминогена (ТАП, алтепаза) – сериновая протеаза, обладающая высоким сродством к фибрину. Вводят внутривенно струйно 10 мг, затем капельно 50 мг в течение 1 ч, затем еще 40 мг со скоростью 20 мг/ч (всего 100 м г). О достижении системного тромболитического действия судят по уменьшению концентрации фибриногена в 2–3 раза, увеличению протромбинового времени и возникновению структурной гипокоагуляции по данным тромбоэластограммы. Тромболитические препараты назначаются одновременно с назначением аспирина и гепарина. Признаками эффективности тромболитической терапии являются: купирование болей, быстрая положительная динамика ЭКГ в виде возвращения сегмента ST к изолинии, перфузионные аритмии, ранний массивный выброс в кровь ферментов. Методика Желательно, чтобы промежуток от поступления больного в стационар до начала тромболитической терапии не превышал 30 мин. Осложнения Тромболитическая терапия может сопровождаться нежелательными реакциями. Несмотря на достигнутые успехи в лечении Q-образующего инфаркта миокарда (Q-ИМ), остается нерешенной проблема профилактики реперфузионного синдрома (РПС), развивающегося вследствие открытия коронарной артерии при тромболитической терапии (ТЛТ). Реперфузионный синдром (РС) развивается после системного тромболизиса (ТЛ) как у больных острым инфарктом миокарда (ОИМ), так и у пациентов с массивной тромбоэмболией легочной артерии (ТЭЛА). РС стал поистине камнем преткновения на пути уже 30-летнего применения этой прогрессивной методики медикаментозной реканализации. Свойственные РС нарушения сердечного ритма, нестабильность гемодинамики, проявления эндогенной интоксикации омрачают и без того серьезный прогноз таких пациентов, а у больных в кардиогенном шоке (тотальная ишемия) по существу лишают возможности использовать тромболитик. Реперфузионный синдром (РПС) можно характеризовать как острый полиэтиологичньш токсикоз, связанный с внезапным выбросом в кровоток продуктов дефектного анаэробного метаболизма и деструкции пораженных тканей иреакцией иммунной системы организма в ответ на этот выброс. Причиной развития РПС является восстановление магистрального кровотока в конечности или ее сегменте, ранее пребывавшем в состоянии критической ишемии вследствие закупорки магистральной артерии или травматической ампутации. 9. Осложнения острого инфаркта миокарда: нарушение сердечного ритма и проводимости, острая сердечная недостаточность, кардиогенный шок, синдром Дресслера, тромбоэмболические осложнения. Клиника, диагностика, лечение. Осложнения инфаркта миокарда преимущественно возникают при обширном и глубоком (трансмуральном) повреждении сердечной мышцы. Известно, что инфаркт представляет собой некроз (омертвление) определенной зоны миокарда. При этом мышечная ткань, со всеми присущими ей свойствами (сократимость, возбудимость, проводимость и пр.), преобразуется в соединительную ткань, которая может выполнять только роль «каркаса». В результате толщина стенки сердца уменьшается, а размеры полости левого желудочка сердца растут, что сопровождается снижением его сократительной способности. Основными осложнениями инфаркта миокарда являются: · аритмия является самым частым осложнением инфаркта миокарда. Наибольшую опасность представляют собой желудочковая тахикардия (вид аритмии при котором роль водителя ритма берут на себя желудочки серда) и фибрилляция желудочков (хаотичное сокращение стенок желудочков). Однако необходими помнить, любая гемодинамически значимая аритмия требует лечения. · сердечная недостаточность (снижение сократительной способности сердца) бывает при инфаркте миокарда довольно часто. Снижение сократительной функции происходит пропорционально размеру инфаркта. · артериальная гипертония за счет увеличения потребности в кислороде сердцем и напряжения в стенке левого желудочка ведет к увеличению зоны инфаркта, и к ее растяжению. · механические осложнения (аневризма сердца, разрыв межжелудочковой перегородки) обычно развиваются в первую неделю инфаркта миокарда и клинически проявляются внезапным ухудшением гемодинамики. Смертность у таких больных высокая, и часто только срочная операция может спасти им жизнь. · рецидивирующий (постоянно повторяющийся) болевой синдром встречается у примерно у 1/3 пациентов с инфарктом миокарда, расстворение тромба не влияет не ее распространенность. · синдром Дресслера - постинфарктный симптомокомплекс, проявляющийся воспалением сердечной сумки, сумки легких и воспалительными измениями в самих легких. Возникновение этого синдрома связано с образованием антител. Дата добавления: 2015-12-16 | Просмотры: 986 | Нарушение авторских прав |