|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
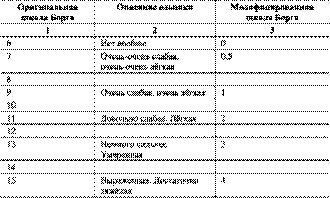
ФАЗА РЕАБИЛИТАЦИИНачинается после выписки из стационара и включает в себя рекомендации по физической активности, здоровому образу жизни и решению психологических проблем. Что касается физической реабилитации, необходимо четко определить следующие вопросы: ■Тип нагрузки — аэробная. ■Интенсивность нагрузки — за исходный уровень берется мощность нагрузки, отработанная на 2-й фазе реабилитации. ■Целевая ЧСС — определяется во 2 фазе реабилитации. Расчет производится по формуле: (220 — возраст)Ч65%. Расчетный показатель не применим к пациентам, получающих β-адреноблокаторы. ■Субъективное ощущение нагрузки — оценивается по шкале Борга, целевые показатели в пределах 11–14 баллов оригинальной шкалы Борга (табл. 1-12). Таблица 1-12. Шкала Борга для оценки субъективного ощущения нагрузки
■Продолжительность нагрузки — на начальном этапе не более 10 мин (можно несколько раз в течение дня), затем в течение первых 2–6 нед продолжительность постепенно увеличивается до 30–45 мин. ■Частота нагрузки — 3–5 раз в неделю. ПРОГНОЗ Естественное течение заболевания характеризуется значительным разнообразием. При своевременной диагностике и правильном лечении у 80–90% пациентов с нестабильной стенокардией болевой синдром купируется в течение 48 ч. Частота развития серьёзных осложнений (смерть, ИМ, необходимость экстренной реваскуляризации) у госпитализированных больных с нестабильной стенокардией составляет 5–7% в первые 7 дней и до 15% в первые 30 дней. От 5 до 15% пациентов с нестабильной стенокардией умирают в течение первого года после развития клинических проявлений. Реваскуляризация существенно улучшает прогноз больных с нестабильной стенокардией. 6. Стратегия лечения больных с Острым коронарным синдромом (ОКС): первичная оценка больного, больные с признаками острой окклюзии крупной КА, больные с высоким непосредственным риском смерти или развития ИМ, больные с низким риском смерти или развития ИМ в ближайшее время, ведение больных после стабилизации состояния. 7. Инфаркт миокарда: определение, этиология, патогенез. Классификация. Клиническая картина. Лабораторные и инструментальные методы диагностики. Доказанная диагностическая значимость тестов по определению биомаркеров инфаркта миокарда. Инфаркт миокарда — острое заболевание, обусловленное развитием очага или очагов ишемического некроза в сердечной мышце, проявляющееся в большинстве случаев характерной болью, нарушением сократительной и других функций сердца, нередко с формированием клинических синдромов острой сердечной и сосудистой недостаточности и других осложнений, угрожающих жизни больного. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ Развитие И. м. всегда связано с тяжелой и длительной ишемией участка сердечной мышцы вследствие острой закупорки или внезапно возникшего критического сужения венечной артерии сердца. Причиной закупорки чаще всего служит тромб, иногда кровоизлияние в основание атеросклеротической бляшки или эмболия. К внезапному сужению артерии может вести ее длительный и выраженный спазм, развивающийся, как правило, на участке артерии, пораженном атеросклерозом. Эти факторы могут сочетаться: тромб образуется в области спастического сужения артерии или выпячивания атеросклеротической бляшки, в основание которой произошло кровоизлияние. Предпосылки к развитию И. м. чаще возникают при атеросклерозе венечных артерий сердца; более чем в 90% случаев острый И. м. бывает проявлением ишемической болезни сердца. Исключительно редко причиной И. м. является эмболия коронарной артерии (например, при подостром септическом эндокардите) или внутрикоронарный тромбоз как следствие воспалительного процесса в эндотелии сосуда (при коронаритах различного генеза). Большинство исследователей считают, что поражение венечных артерий является необходимой предпосылкой к развитию острого И. м. Как показывают многочисленные данные коронароангиографии, во всех случаях крупноочагового И. м. в остром периоде выявляется окклюзия магистральных венечных артерий сердца. Эти наблюдения подтверждаются и патолого-анатомическими данными, выявляющими острую закупорку венечных артерий в 90—100% случаев крупноочагового И. м. Отсутствие стопроцентного совпадения объясняют возможностью самопроизвольного лизиса коронарного тромба (спонтанная реперфузия миокарда), которая доказана ангиографически. Атеросклеротическое или иное поражение коронарных артерий при И. м. подтверждается практически во всех случаях. Вместе с тем отсутствует строгое соответствие между степенью поражения коронарных артерий сердца и вероятностью развития И. м. Иногда очаговые изменения не развиваются при тяжелейшем распространенном коронарном атеросклерозе и даже при ангиографически выявляемой окклюзии крупной коронарной артерии, и, напротив, довольно часто И. м. возникает у больных с единичной нестенозирующей бляшкой коронарной артерии, подчас с трудом выявляемой ангиографически. Отсутствие строгого параллелизма между степенью поражения коронарных артерий сердца и вероятностью развития И. м. объясняется влиянием на состояние коронарного кровотока ряда дополнительных, условий, включая развитие сети коллатералей в системе коронарных артерий и факторы, определяющие склонность к тромбозу (активность свертывающей и противосвертывающей систем крови), артериальному ангиоспазму, повышенную потребность миокарда в питании (активность симпатоадреналовой системы) и т.п. Поскольку атеросклероз является основой изменений, приводящих к инфаркту миокарда, факторы риска возникновения И. м. во многом совпадают с факторами риска развития атеросклероза. Частота И. м. достоверно возрастает при сочетании двух и особенно нескольких «больших» факторов риска. Описано более 200 «малых» факторов риска (подагра, употребление мягкой питьевой воды, псориаз, определенные особенности личности и др.), этиологическое и патогенетическое значение которых не вполне ясно. В патогенезе тромбоза коронарных артерий, приводящего к развитию И. м., выделяют роль местных и общих факторов. Из местных факторов наибольшее значение имеет нарушение целости эндотелия сосудистой стенки в области атеросклеротической бляшки, а также локальное снижение активности тканевой противосвертывающей системы и повышение коагулирующих свойств крови в зоне сосудистого повреждения. Наиболее важные общие нарушения — снижение функциональных возможностей противосвертывающей системы в целом, в частности увеличение содержания в крови ингибиторов гепарина и фибринолизина. В начальной стадии развития И. м. антикоагулянтные и фибринолитические свойства крови на очень непродолжительное время реактивно повышаются (подобная реакция вообще характерна для состояний, угрожающих возникновением внутрисосудистого тромбоза), после чего резко увеличивается активность прокоагулянтных и антифибринолитических факторов (эта форма реагирования типична для атеросклероза). Большое значение в развитии тромбоза коронарных артерий придают при атеросклерозе повышению склонности тромбоцитов к агрегации. Патогенез клинических проявлений в острейшем и остром периодах И. м. в своих начальных звеньях непосредственно связан с ишемией и некрозом миокарда, а также с обусловленным некрозом дефектом структуры и функции сердца как целостного органа. Возникновение характерной сегментарной боли и развитие стрессовых реакций обусловлены перераздражением интерорецепторов миокарда, эндокарда и эпикарда в зоне ишемии и развивающегося некроза, иррадиацией раздражения в соответствующие сегменты спинного мозга, а так же на подкорковые структуры и кору большого мозга. Как и при стрессе любого происхождения, в первой его фазе активируются механизмы неспецифической защиты и адаптации, в частности система гипоталамус — гипофиз — надпочечники, причем в крови повышается содержание катехоламинов,вызывающих присущую острейшему периоду И. м. артериальную гипертензию и тахикардию. Одно из проявлений стрессовой реакции — анэозинофилия. В дальнейшем патологическая импульсация из очага поражения и крайняя интенсивность боли приводят к истощению общих адаптивных реакций и вызывают рефлекторную артериальную гипотензию вплоть до развития тяжелого коллапса. Ряд клинических проявлений патогенетически связан с некрозом миокарда, резорбцией продуктов распада ткани и парабиотическими процессами в зоне, прилежащей к очагу некроза. Некротический распад кардиомиоцитов сопровождается высвобождением миоглобина, креатинфосфокиназы и других ферментов, содержание которых в плазме крови повышается. Резорбция токсических продуктов распада вызывает повышение температуры тела, нейтрофильный лейкоцитоз со сдвигом влево, а в дальнейшем повышение СОЭ. Перераспределение электролитов в области, прилежащей к очагу некроза, характеризуется нарушением равновесия внутри- и внеклеточного содержания ионов калия и натрия, что сопровождается нарушениями проводимости и ведет к электрической нестабильности клеток, обусловливающей развитие различных аритмий вплоть до фибрилляции сердца. По клинико-морфологическим признакам различают крупно- и мелкоочаговый И. м. с указанием зоны поражения: передняя, боковая, нижняя (задняя) стенки левого желудочка, верхушка сердца, межжелудочковая перегородка, правый желудочек и т.д. По глубине поражения стенки сердца выделяют трансмуральный И. м., когда некроз захватывает всю толщу миокарда, эндокард и эпикард; интрамуральный И. м., когда некротический очаг располагается в толще миокарда; субэндокардиальный И. м. (некроз локализуется в слое миокарда, прилежащем к эндокарду) и субэпикардиальный И. м., при котором зона некроза ограничена только слоем миокарда, прилегающим к перикарду. Последняя форма в связи с анатомическими особенностями венечных артерий сердца встречается очень редко. Дата добавления: 2015-12-16 | Просмотры: 728 | Нарушение авторских прав |