|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Векторы для клонирования ДНК
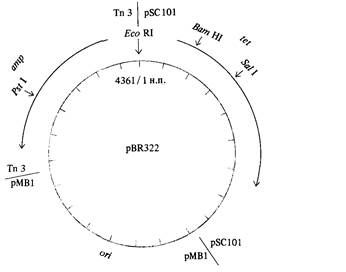
Методы клонирования чужеродной ДНК в клетках Е. coli удобно проиллюстрировать на примере плазмиды pBR 322, специально сконструированной Франциско Болваром и Раймондом Родригесом для клонирования маленьких фрагментов ДНК, состоящих всего из нескольких тысяч пар оснований или еще меньше. Эта плазмида невелика (4362 нуклеотидные пары), несет гены антибиотикоустойчивости amp и tet и в каждой бактериальной клетке может присутствовать во множестве копий. Последовательность нуклеотидов плазмиды известна. Ее физическая карта представлена на рис. 9.11. Обратите внимание на то, что имеется один сайт для рестриктазы Pst I в гене amp и по одному сайту для рестриктаз Bam HI и Sal Iв гене tet. Наличие этих сайтов именно
278 Организация и передача генетического материала
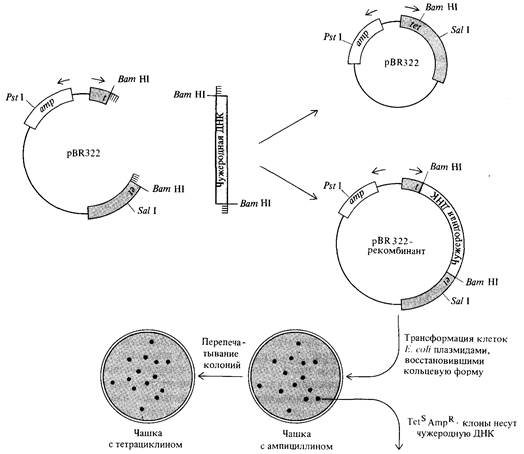
в генах устойчивости к двум антибиотикам дает возможность отбирать плазмиды, несущие чужеродную ДНК (рис. 9.12). Плазмиду рестрицируют Ват HI и образовавшиеся линейные молекулы смешивают с фрагментами чужеродной ДНК, полученными также под действием этой рестриктазы. Одноцепочечные комплементарные концы этих молекул могут соединиться различными способами, прежде чем под действием лигазы возникнут ковалентные связи. Во-первых, концы линейной молекулы ДНК плазмиды могут соединиться друг с другом: при этом восстановится исходная кольцевая плазмида с интактным геном tet. Возможно, однако (именно это и требуется), что перед превращением линейной молекулы ДНК плазмиды в кольцевую, между ее концами встроится фрагмент чужеродной ДНК; при этом целостность гена tet нарушится. Полученной in vitro смесью молекул ДНК трансформируют клетки Е. coli, предварительно обработанные ио-
9. Методы работы с ДНК 279
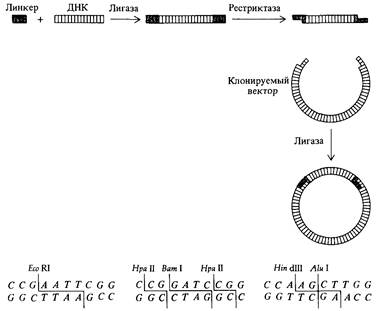
нами Са++ с тем, чтобы сделать эти клетки проницаемыми для ДНК. Затем трансформированные бактерии высевают на среду, содержащую ампициллин. На таком агаре размножаются лишь те клетки, которые обладают фенотипом AmpR и, следовательно, содержат восстановленную плазмиду или плазмиду с встроенным фрагментом чужеродной ДНК. Колонии, выросшие на среде с ампициллином, перепечатывают на чашки с тетрациклином. Клетки с восстановленной кольцевой плазмидой, содержащей неповрежденный ген tet, будут иметь фенотип TetR, тогда как клетки, в плазмиду которых встроен фрагмент чужеродной ДНК, окажутся чувствительными к тетрациклину (TetS). Клоны с фенотипом TetSAmpR можно отобрать для дальнейшего исследования встроенных фрагментов ДНК. Процедуру клонирования можно вести с помощью рестриктазы Sal I, а не Bam HI, и точно так же отбирать колонии трансформантов с фенотипом TetSAmpR; при этом будут клонироваться фрагменты чужеродной ДНК, специфичные именно для Sal Iи отличные от фрагментов, клонируемых Bam HI. Можно также в качестве рестрицирующего фермента при клонировании с помощью вектора pBR322 использовать Pst I; при этом для дальнейших исследований природы встроенных фрагментов следует отбирать колонии с фенотипом TetRAmpS. Химический синтез палиндромных двухцепочечных олигонуклеотидов, получивших наименование «линкеры» (связывающие звенья) дает возможность клонировать любые фрагменты чужеродной ДНК безотносительно к специфичности сайтов рестрикции. Эти короткие «тупоконечные» (т.е. не обладающие одноцепочечными концами) молекулы двухцепочечной ДНК могут ДНК-лигазой фага Т4 ковалентно соединяться с произвольными тупоконечными фрагментами ДНК, которые мы хотим клонировать (рис. 9.13). Эти фрагменты могут «выстригаться»
280 Организация и передача генетического материала
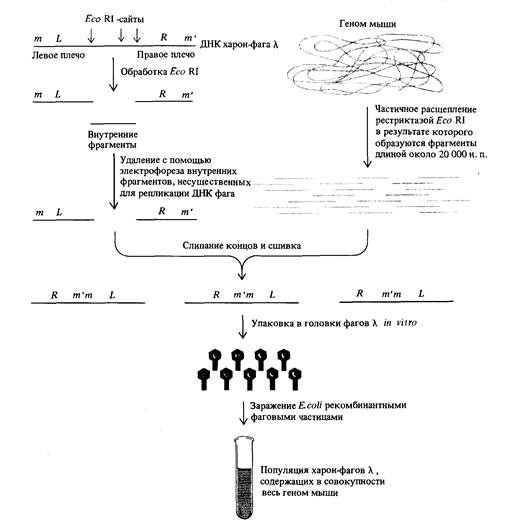
из любых молекул ДНК физическими методами; границы фрагментов при этом не зависят от распределения сайтов рестрикции. Геном бактериофага λ был превращен генными инженерами в наиболее удобный вектор для клонирования крупных фрагментов чужеродной ДНК, В геноме фага λ есть два участка, не содержащие генов, необходимых для литического развития и производства потомства. Эти участки включают, соответственно, 22000 нуклеотидных пар в середине карты и 3000 между генами Ρ и Q (см. рис. 7.7). Таким образом, около
9. Методы работы с ДНК 281 25 000 пар нуклеотидов ДНК фага λ можно заменить чужеродной ДНК, не затрагивая способности этого фага выступать в роли вектора. Нормальный геном фага λ содержит 49000 нуклеотидных пар, однако головка фага может вместить от 38 000 до 53 000 н. п., продолжая при этом функционировать нормально. Можно сконструировать множество различных линий фага λ, предназначенных для клонирования разнообразных фрагментов чужеродной ДНК, подчиняющихся лишь сформулированным выше ограничениям. Примерами таких векторов могут служить так называемые харон-фаги λ (по имени мифического перевозчика в царство мертвых) и λgt-фаги (осуществляющие общую трансдукцию). Они сконструированы таким образом, что гены, ответственные за жизненно важные функции, локализованы на левом и правом концах генома, а середина существенных генов не несет и кроме того ограничена двумя различными сайтами рестрикции. Эта центральная часть генома содержит гены, влияющие на морфологию колоний, так что по их форме можно сразу определить, чужеродная или собственная ДНК включена в головку. Использование харон-фагов λ при клонировании фрагментов чужеродной ДНК схематически изображено на рис. 9.14. Дата добавления: 2015-12-16 | Просмотры: 1134 | Нарушение авторских прав |