|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Библиотеки геномовОдна из основных целей клонирования различных фрагментов ДНК прокариотических и эукариотических организмов состоит в расчленении геномов на участки, достаточно малые для того, чтобы было возможно их детальное исследование. Интуитивно представляется очевидным, что, если накопить достаточно большое количество клонируемых фрагментов ДНК, эта коллекция будет включать по меньшей мере по одному экземпляру каждой последовательности генома. Такую коллекцию клонируемых фрагментов называют библиотекой генома или банком генов. Если клонируют фрагменты генома Drosophila melanogaster средней длины 15-20·103 н. п., то для того, чтобы в коллекции были представлены все участки генома, достаточно около 40000 независимых клонов (общая длина генома составляет около 1,5·108 н. п.). Для полной библиотеки генома человека требуется около 800000 клонов (см. дополнение 9.2). В библиотеке генов содержится вся наследственная информация организма. Однако определение того, какой именно из томов библиотеки (т. е. клонов) содержит необходимую в каждом конкретном случае информацию, представляет очень сложную для генетиков проблему. Если копия соответствующей генетической информации оказывается доступной в форме структуры молекулы РНК или в форме последовательности аминокислот, то это может быть использовано при отыскивании в библиотеке клона, содержащего требуемую информацию. Такой поиск осуществляют следующим образом. Библиотеку фагов λ высевают На большую чашку Петри, так чтобы на чашке было приблизительно 10000 негативных колоний. Например, библиотека генома Drosophila meïanogaster умещается всего на четырех таких чашках. Каждая негативная колония содержит химерные инфекционные фаги и большое количество химерных молекул фаговой ДНК, не уместившихся в головки фагов. Эта свободная ДНК дает возможность определить, какие именно из негативных колоний содержат интересующие нас
282 Организация и передача генетического материала
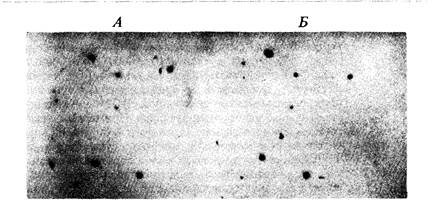
фрагменты ДНК. К поверхности чашки Петри прикладывают специальную пленку, на которой отпечатываются все негативные колонии. Затем пленку снимают и помещают в раствор щелочи, денатурирующий ДНК. Пленку высушивают и выдерживают в вакууме при температуре 80°С, что приводит к установлению ковалентных связей между отпечатанными одноцепочечными молекулами ДНК и пленкой. На следующем этапе работы эту пленку помещают в раствор, содержащий так называемый зонд, т.е. одноцепочечные молекулы нуклеиновой кислоты, комплементарные отыскиваемым в библиотеке и содержащие радиоактивную метку. Таким радиоактивным зондом может служить информационная РНК, выделенная из ткани, в которой наиболее активно функционирует интересующий нас ген; это может быть также искусственный дезоксиолигонуклеотид, синтезированный так, чтобы отвечать известной последовательности аминокислот в том белке, который кодируется разыскиваемым нами геном; наконец, это может быть рестрикт из другого участка клонируемой ДНК. Радиоактивный зонд гибридизирует с комплементарной ДНК на поверхности пленки. Затем с пленки смывают не вступившие в гибридизацию остатки зонда и производят радиавтографию, позволяющую установить, где именно на поверхности пленки, а значит и на поверхности чашки Петри, располагаются негативные колонии, содержащие ДНК, способную гибридизировать с зондом (рис. 9.15). Затем из соответствующих негативных колоний можно выделить фаг, содержащий интересующий нас фрагмент чужеродной ДНК. Труднее выделить из библиотеки клоны, соответствующие генам с известным фенотипическим проявлением, но неизвестным непосред-
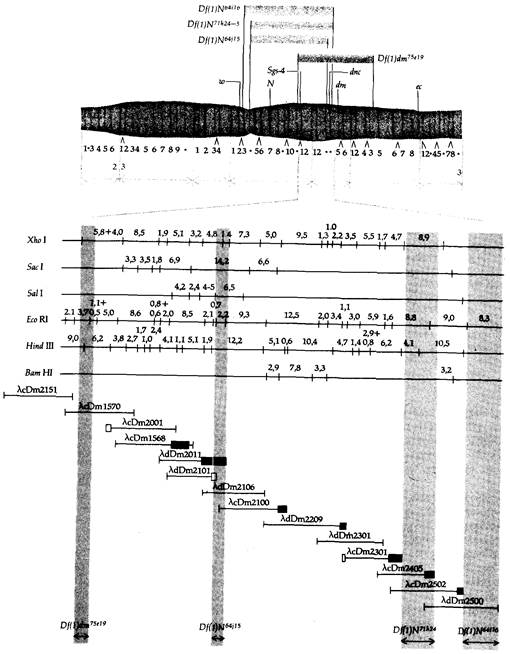
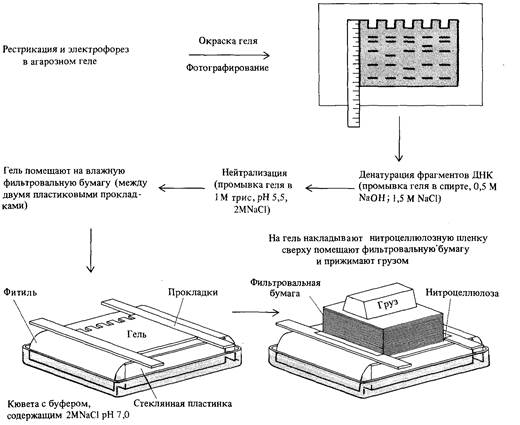
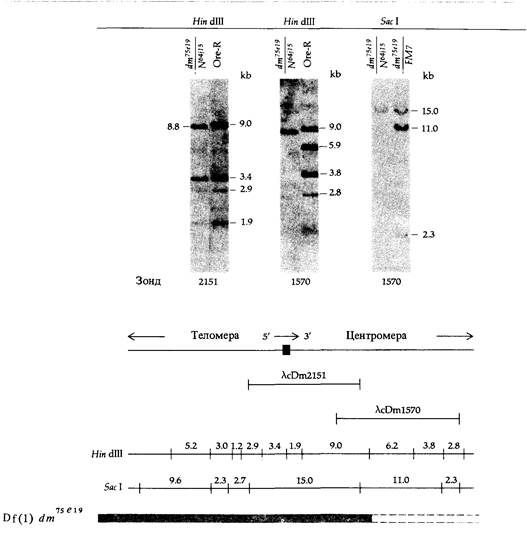
9. Методы работы с ДНК 283 ственно биохимическим продуктом функционирования. Метод, с помощью которого эту задачу можно решить, был впервые предложен применительно к геному дрозофилы Бендером и Хогнессом и получил название «прогулки по хромосоме». Этот метод требует, чтобы, вопервых, была заранее известна локализация интересующего нас гена на генетической карте политенной хромосомы (см. главу 5, например, рис. 5.19) и, во-вторых, чтобы для какого-нибудь гена той же хромосомы существовал зонд. Рассмотрим в качестве примера участок Х-хромосомы, изображенный на рис. 5.19, и будем двигаться по хромосоме, как это изображено на рис. 9.16. Наша цель состоит в том, чтобы отыскать в библиотеке клонируемые фрагменты ДНК, отвечающие гену dunce, локализованному в хромомере 3D4. Этот ген необходим для формирования нормальной памяти у мух; при этом он также кодирует фермент сАМРспецифическую фосфодиэстеразу. Прогулка по хромосоме начинается с рекомбинантного клона λcDm 1570, несущего ДНК из хромомера 3С11-12. Этот химерный фаг извлекается из библиотеки генов дрозофилы посредством гибридизации с информационной РНК, выделенной из слюнных желез личинок. Эта информационная РНК кодирует клейкий белок, обозначаемый символом Sgs-4. Генетическое картирование мутаций, затрагивающих Sgs-4, позволяет локализовать этот ген в полосе 3011-12 политенной хромосомы (рис. 9.16). Клонированная ДНК Sgs-4 гибридизирует с ДНК из полосы ЗС11-12 политенной хромосомы, расположенной непосредственно справа от левого края делеции Df(1)dm 75е19. Это можно показать, используя разработанный Эдвином Саузерном метод перенесения электрофоретических фрагментов ДНК на специальную пленку, связывающую одноцепочечные молекулы ДНК (блотинг по Саузерну; см. рис. 9.6). Затем на эту пленку наносят радиоактивный зонд, что позволяет определить, какие из фрагментов ДНК в геле комплементарны последовательности нуклеотидов зонда. Этот метод схематически изображен на рис. 9.17. Используя метод Саузерна при сравнении нормальных мух и мух, в геноме которых имеются делеции, можно локализовать концы этих делеции, если использовать в качестве зонда клонируемую ДНК. О нарушении нормальной нуклеотидной последовательности в делетированной хромосоме свидетельствует изменение распределения сайтов рестрикции по сравнению с ДНК нормальной хромосомы. Например, если конец делеции находится между двумя сайтами рестрикции нормальной ДНК, то расстояние между оставшимся сайтом и следующим (внутри делеции) изменится, поскольку почти наверняка следующий сайт в делеции окажется на другом расстоянии от сохранившегося, чем был первый. На рис. 9.18 показано использование метода Саузерна для определения нового распределения сайтов рестрикции. На рис. 9.18, А представлены результаты опыта, в котором ДНК мух дикого типа (Oregon-R) и Df(l)dm15el9/Df(l)N64ns подвергали действию Hin dIII, a затем сравнивали методом Саузерна, используя в качестве радиоактивного зонда ДНК дрозофилы из клона λcDm2151. Обратите внимание на то, что распределение сайтов рестрикции в обеих ДНК одинаково, так как ДНК дрозофилы из λcDm2151 комплементарна последовательности и нормальной ДНК, и ДНК из хромосомы с делецией Df(1)dm75e19. (Обратите также внимание на то, что, как это видно на рис. 9.16, в хромосоме с делецией Df(1)N64j15 отсутствует
9. Методы работы с ДНК 285
участок ДНК вокруг полосы ЗС11-12, так что анализируется лишь ДНК из хромосомы Df(l)dm75e19.) Сравним теперь те же фрагменты, используя в качестве радиоактивного зонда ДНК дрозофилы клона λcDm 1570, который имеет общий участок с ДНК клона λcDm2151 (рис. 9.16). Распределение сайтов рестрикции при этом (рис. 9. 18, Б) получается совершенно иным. Фрагменты, образующиеся при рестрикции нормальной ДНК, теперь отсутствуют, и имеется лишь один фрагмент другого размера в ДНК хромосомы Df(l)dm75e19. Внимательное рассмотрение
286 Организация и передача генетического материала
карты рестрикции, изображенной на рис. 9.18, В, показывает, что новый фрагмент, длиной примерно в 8,8 т. п. н., должен представлять собой левую часть фрагмента длиной 9,0 т. п. н., идентифицируемого зондом λcDml570. Следовательно, крайняя точка делеции Df(1)dm75e19 должна располагаться внутри фрагмента λcDml570, причем неподалеку от правого конца участка длиной 9,0 т. п. н. фрагмента Нin dIII. После того как установлено, что λ-вектор, несущий участок ДНК из хромо-
9. Методы работы с ДНК 287 Дата добавления: 2015-12-16 | Просмотры: 758 | Нарушение авторских прав |