|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Кодирующая стратегия вирусов в зависимости от организации генома. Регуляция экспрессии вирусных геномов.Многие методы и подходы, с помощью которых сформировались основные представления о регуляции экспрессии клеточных генов, были заимствованы из области изучения регуляции транскрипции у вирусов. Насколько известно, клетки и ДНК-содержащие вирусы регулируют содержание мРНК главным образом путем изменения частоты и места инициации транскрипции с участием РНК-полимеразы II. Более того, регуляция транскрипции вирусных генов, как и клеточных генов, зависит от специфических взаимодействий между сложно организованными г/ыс-действующими элементами и большим набором /иранс-действующих факторов транскрипции. Некоторые вирусы кодируют также необычные факторы транскрипции, координирующие экспрессию групп вирусных генов или влияющие на транскрипцию отдельных клеточных генов. В действительности взаимодействие вирусных и клеточных транс-действующих факторов может по-разному влиять на транскрипцию клеточных и вирусных генов и даже оказывать положительное влияние на одни и отрицательное-на другие гены. В основе регуляции экспрессии генов вирусов млекопитающих лежат те же принципы, что и в основе регуляции экспрессии клеточных генов. Как и промоторы большей части эукариотических генов класса II, промоторы вирусов состоят из «проксимальных» регуляторных элементов, как правило, входящих в последовательность, непосредственно окружающую точку начала транскрипции и простирающуюся до пары оснований – 100, и «дистальных» регуляторных элементов, чаще всего расположенных между парами оснований —100 и —300, которые обеспечивают экспрессию гена, специфичную для данной ткани или данной стадии развития организма. Регуляторные последовательности, находящиеся внутри единицы транскрипции или за ней, насколько известно, не входят в состав вирусных промоторов. Стратегия ДНК геномных вирусов. Двуцепочечные ДНК вирусы содержат НК линейной (герпес-, адено-и поксвирусы) и кольцевидной (паповавирусы) формы. ДНК-вирусы образуют мРНК, используя стратегии подобные таковым эукариотических клеток (рис)
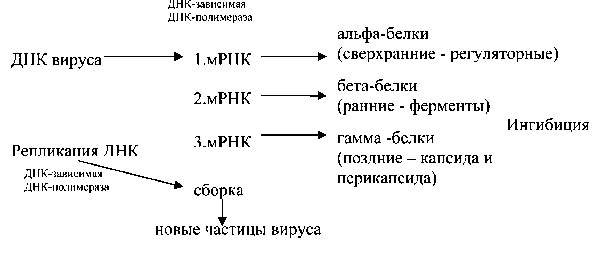
Схема репродукции двуцепочечных ДНК вирусов
После связывания с рецепторами и пенетрации в клетку первым событием репликации является продукция мРНК из геномной ДНК. У папова-, адено-и герпесвирусов транскрипция вирусной ДНК в мРНК происходит в ядре клетки-хозяина клеточной ДНК-зависимой РНК-полимеразой. У паповавирусов (вирус SV-40) различают раннюю и позднюю транскрипцию. В период транскрипции образуются ранние мРНК, кодирующие регуляторные (ранние) белки – альфа (сверхранние) и бета (ранние), а затем образуются поздние мРНК, кодирующие поздние (гамма) белки (структурные). Геном аденовирусов, также характеризуются наличием ранних и поздних генов (рис. 8). Среди продуктов ранних генов имеется тимидинкиназа и вирус-специфическая ДНК-полимераза. Большинство поздних белков, являются структурными. При их продукции ингибируется биосинтез сверхранних и ранних белков. В промежутке между синтезом бета и гамма белков начинается биосинтез новых молекул геномной ДНК вирусов. Индивидуальные мРНК ранних и поздних генов соответствуют сиквенсу вирусной ДНК, т.е. экзонов, которые отделены участками нетранслируемымых последовательностей – интронами. Незрелые молекулы мРНК интенсивно разрезаются и в результате сплайсинга соединяются в одну молекулу. Синтез мРНК начинается с участков перекрывания вирусной ДНК. Этот избыток снижает количество вирусной ДНК необходимой для кодирования некоторых вирусных белков и является механизмом геномной экономии. Однако ДНК полимеразы самостоятельно не способны начать синтез полинуклеотидной цепи. Они могут только наращивать ее в соответствии с инструкцией ДНК-матрицы. Образование новой цепи инициируется специфической РНК полимеразой, названной «альфа-примазой» или «короткой примазой». У вируса SV-40 альфа-примаза вначале синтезирует специальный праймер, инициирующий репликацию, а образовавшаяся репликационная вилка наращивается в двух направлениях. В результате образуются две двуцепочечные кольцевидные молекулы ДНК. У герпесвирусов геном является кольцевидным. Репликационная вилка наращивается только в одном направлении, конечным продуктом является одна молекула циркулярной двуцепочечной ДНК. У аденовирусов, в противоположность этому, геном является линейным. Репликационная вилка также наращивается только в одном направлении, а конечным продуктом является молекула двуцепочечной линейной ДНК. Наиболее сложно организованы поксвирусы. Начальные этапы транскрипции и трансляции происходят в цитоплазме клетки. Они не используют клеточные РНК полимеразы, так как их собственные ДНК-зависимые РНК полимеразы, обеспечивают начальные этапы транскрипции. Продукты ранних генов включают ДНК полимеразы, белки, связывающиеся с началом репликации и инициирующие процесс, а также белки стимулирующие клетку к вхождению в S фазу клеточного цикла и повышающие продукцию материалов необходимых для биосинтеза ДНК, или продуктов необходимых для дальнейшей дезинтеграции субвирионных частиц. Ранние вирусные белки ответственны за вторую фазу депротеинизации. Репликация, транскрипция и этапы поздней сборки происходят в специальных участках цитоплазмы, называемых “фабриками“. Ранние белки включают ферменты (ДНК полимеразы, тимидинкиназы), так же как и некоторые структурные белки. Когда инициируется инфекция клетки, репликация ДНК в клетке начинается, синтез ранних неструктурных белков прекращается, а синтез поздних белков еще продолжается. Поздние белки являются структурными, но иные из них также являются ферментами или белками, участвующими в сборке вирионов.
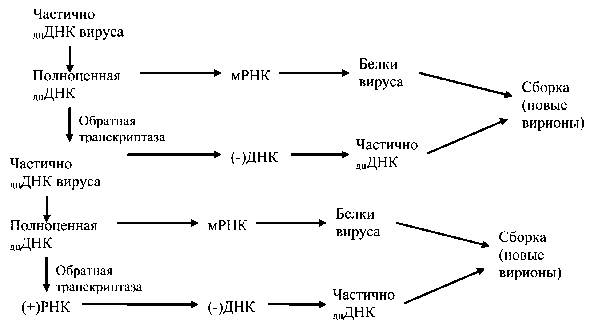
Стратегия ДНК геномных вирусов с обратной транскрипцией (гепаднавирусов). Гепаднавирусы являются уникальными оболочечными ДНК вирусами животных c обратной транскрипцией (рис.7). После внедрения в клетку ДНК вируса транспортируется в ядро, где превращается в ковалентно закрытую, полностью кольцевидную двуцепочечную ДНК (кдцДНК)
Рис.7. Схема репродукции ДНК вирусов с обратной транскрипцией.
В отличие от ретровирусов ДНК вируса не интегрируется в геном клетки, а персистирует в ядре в виде нереплицирующейся эписомы. Она транскрибируется клеточными РНК полимеразами, используя несколько разных промоторов кдцДНК для образования серии разных типов РНК. Молекулы этих РНК транспортируются в цитоплазму, где и сохраняются в качестве мРНК. Одна из этих РНК, называемая РНК-предшественником несколько длиннее и выполняет функцию матрицы для обратной транскрипции в ДНК.
Обратная транскрипция осуществляется ферментом ОТ с участнием РНК-азы Н, транслируемыми из соответствующих вирусных мРНК. Самой первой в результате обратной транскрипции синтезируется полная минус-смысловая ДНК. Синтез второй нити (плюс-смысловой ДНК) начинается позднее, но завершается только частично. В результате этого, сердцевина вириона содержит частично к дц ДНК (т.е. геном вируса). Сердцевина вируса, содержащая ДНК генома, в дальнейшем использует несколько путей реализации. На ранних этапах инфекции вновь образованные частицы могут усиливать образование кдцДНК в ядре. Они содержат геномную ДНК и не отличаются от аналогичных частиц поступающих в клетку при ее инфицировании. Вновь образованная геномная ДНК может транспортироваться в ядро и там превращаться в кдцДНК. Следует отметить, что амплификация кдцДНК, осуществляется только через промежуточную форму генома в виде молекулы РНК, используя путь описанный ранее. То есть прямая репликация ДНК в ядре отсутствует. На поздних стадиях инфекции клетки происходит созревание сердцевины, собираются полноценные вирионы, которые отпочковываются от ядерной мембраны в эндоплазматический ретикулюм. Переключение на процесс отпочковывания регулируется поверхностными белками перикапсида (1, 5, 6, 11, 16, 18, 28).
Стратегия одноцепочечных ДНК геномных вирусов. Семейство парвовирусов является единственным из ДНК вирусов животных относящихся к данной группе. Они имеют очень малый размер генома – 2х106. Некоторые из парвовирусов, кроме того, имеют одноцепочечную ДНК (–) негативной полярности. Они реплицируются в быстроделящихся клетках. Другие из парвовирусов содержат (+) или (-) ДНК, являются ко-инфицирующими и зависят от репликации основного вируса “помощника”. Для создания двуцепочечного ДНК – генома вируса они используют кольцевидную ДНК полимеразу, называемого репликативной формой. При этом для прайминга используется собственная нуклеиновая кислота, образующая петлю с 3’конца. Это следует за смещением цепи родительской ДНК и синтезом комплементарных молекул к цепи-матрице. Молекулы мРНК синтезируются с использованием соответствующей цепи ДНК в качестве матрицы, которые затем транслируются в виде белков. Трансляция и биосинтез белков вируса. Трансляция вирусных мРНК осуществляется клеточными системами. Большинство мРНК вирусов животных имеют шапочку (кэп) на 5’ и полиаденилированы на 3’ концах. При этом используются те же самые пути, что и при трансляции клеточных мРНК. Хотя трансляция многих вирусных мРНК сопряжена с интерференцией с процессами трансляции клеточных мРНК с целью обеспечения первоочередности. Кроме того, имеются механизмы, используемые некоторыми вирусами, которые не свойственны клеточным: 1) «кэп» независимая трансляция; 2) рибосомный сдвиг рамки считывания. Наличие на 5’ конце молекулы мРНК шапочки является необходимым условием трансляции. Началом процесса трансляции является взаимодействие клеточных «кэп»-связываюших белков с мРНК. мРНК затем сканируется комплексом инициации, стартующим в участке кэп. Трансляция начинается со стартового кодона AUG. Однако мРНК некоторых вирусов (полиовирусы, гепатита С) лишены шапочки и используют другой механизм инициации трансляции. 5’ нетранслируемая область РНК полиовирусов является длинной – более 700 нуклеотидов. Последовательности этой области длиной около 400 нуклеотидов c 5’ конца называется внутренним участком (элементом) входа рибосом (ВУВР). Рибосомы связываются с ВУВР и инициируют трансляцию мРНК кэп-независимым способом. У различных вирусов структура этого фрагмента разная, но всегда выявляяется в 5’ нетранслируемой области РНК. У полицистронных мРНК имеются множественные ВУВР. Более того, вирусы способны блокировать кэп-зависимый механизм трансляции клеточных мРНК, разрушая кэп-связывающие белки. Этим же механизмом блокируются и многие защитные противовирусные механизмы организма хозяина, а близкородственные вирусы могут обмениваться этими элементами. Эффективность варьирует между 5-20%. Ретровирусы и большинство +РНК вирусов, как и некоторые другие, продуцируют полипротеиновые молекулы благодаря наличию длинной открытой рамки считывания, прерываемой стоп-кодонами. Терминация полипротеина в участке стоп-кодона приводит к синтезу белковых молекул с определенными функциями, образованию длинной молекулы с дополнительными функциями. Для игнорирования стоп-кодонов используются два механизма: 1) считывание стоп-кодона как смыслового, в этом случае, когда верхний (вышележащий) сиквенс некоторых рамок считывания является нижним (нижележащим) сиквенсом других.; 2) сдвиг рамки считывания на рибосомах на +1 или-1 верхнего стоп-кодона. Эффективность сдвига рамки считывания варьирует от 2 до 20% и зависит от вида вирусов. Полипротеиновые молекулы с помощью протеаз вирусов разрушаются на индивидуальные белки, за исключением белков-предшественников. Последние расщепляются ферментами клетки, расположенными в субклеточных компартментах. Некоторые протеазы вирусов разрушают молекулы полипротеинов в «cis»-мономолекулярной реакции (полипротеиновая молекула сама себя расщепляет), другие – в «trans»-бимолекулярном типе реакций (протеазы разрушают молекулы полипротеина другого типа). Серии этих реакций регулируют жизненный цикл вирусов. Вирусы используют три типа протеаз – сериновые (риновирусы), папаин подобные (+РНК вирусов) и металлопротеазы (вирус гепатита С). По своему строению и функции они подобны ферментам животных – химотрипсину, пепсину, ренину, катепсину Д и др.
Дата добавления: 2015-12-16 | Просмотры: 1447 | Нарушение авторских прав |