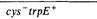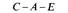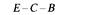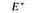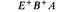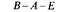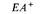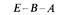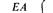|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Трансдукционное картированиеРезультаты, получаемые при рекомбинационном картировании мерозигот, желательно подтверждать реципрокными скрещиваниями, как это делалось в случае скрещиваний 6 и 7. Однако создание штаммов Hfr и F–, необходимых для проведения реципрокных скрещиваний, часто дело непростое, и в большинстве случаев рекомбинационное картирование у Е. coli производится другим методом, а именно, с использованием мерозигот, возникающих при трансдукции умеренным бактериофагом Р1. После того, как Р1 инфицирует чувствительную клетку Е. coli, развитие может пойти либо по литическому пути, что приводит к появлению
250 Организация и передача генетического материала потомства фага, либо по пути лизогенизации. При образовании фагового потомства в головки зрелых частиц с помощью механизма, обеспечивающего заполнение головки Т4 максимальным количеством ДНК, упаковываются молекулы ДНК Р1 протяженностью примерно 105 н. п. В отдельных фагах последовательности нуклеотидов представляют собой циклические перестановки друг относительно друга. Иногда, однако, в головку фага вместо его собственной ДНК упаковывается фрагмент хромосомы клетки-хозяина, разрушенной в процессе лизиса. Частота образования таких дефектных фаговых частиц составляет около 2:1000 потомков фага. Дефектные частицы фага, содержащие ДНК Е. coli могут быть выявлены посредством генетического анализа при наличии в ДНК Е. coli генетических маркеров. Например, если клетка thr –«инфицирована» фагом, содержащим фрагмент ДНК Е. coli с геном thr+, то ген thr+ может включаться путем рекомбинации в хромосому бактерии. В результате образуется прототрофный рекомбинант, способный к росту в отсутствие треонина (рис. 8.17). Фаг Р1 осуществляет общую (неспецифическую) трансдукцию; это значит, что он способен переносить любые гены бактерий. Такие фаги следует отличать от специфически трансдуцирующих фагов (к ним относится фаг λ), которые переносят лишь те бактериальные гены, которые локализованы неподалеку от сайта интеграции профага. Когда фаг Р1 размножают на клетках thr + leu + aziR, и затем полученным препаратом фага инфицируют реципиента thr – leu – aziS, то лишь 3% от рекомбинантов типа Thr+ обладают также фенотипом Leu+, и ни один из них - фенотипом AzR. Однако, если отбирать рекомбинанты типа Leu +, то 50% из них составляют AzR. Следовательно, leu + более тесно сцеплен с aziR, чем с thr +, и гены, по-видимому, расположены в последовательности thr + leu + aziR. Частоты совместной трансдукции (котрансдукции) соответствующих маркеров можно использовать для определения степени их сцепления. Тот факт, что лишь 3% трансдуцирующих фагов thr+ содержат также ген leu+, указывает на то, что эти гены столь удалены друг от друга, что редко оказываются вместе во фрагменте ДНК, попадающем в головку фага Р1. На физической карте, полученной методом прерванной конъюгации, эти маркеры расположены на расстоянии около 1/50 от общей длины хромосомы бактерии, что составляет 6,4 · 104 н. п. Это находится в хорошем соответствии с данными, согласно которым молекула ДНК фага Р1 содержит чуть меньше 105 н.п. Выращивая фаг Р1 на различных штаммах бактерий, а затем используя потомство фагов для трансдукции соответствующих маркеров в другие штаммы, легко производить трехфакторные реципрокные скрещивания. В таких экспериментах используется мутант фага P1, clear, не способный к лизогенизации бактерий. Подобные опыты по трансдукции с использованием реципрокных трехфакторных скрещиваний позволяют определить последовательность мутантных генов в хромосоме в тех случаях, когда, как в приводимом ниже примере, эксперименты по котрансдукции не позволяют этого сделать. Все маркеры trp трансдуцируются вместе более чем в 80% всех случаев. Представленные в табл. 8.4 данные содержат частоты совместной трансдукции cys+ и четырех тесно сцепленных ауксотрофов Trp ~. Частота совместной трансдукции (котрансдукции) - это частота, с которой клетки реципиента, приобретшие прототрофность по цистеину (cys+), приобретают
8. Бактериальный геном 251
252 Организация и передача генетического материала
одновременно ауксотрофность по триптофану (Trp–). Мерозиготы при этом сперва высевают на минимальную среду, содержащую триптофан. Образовавшиеся колонии перепечатывают на минимальную среду с тем, чтобы выявить не прототрофные, т.е. обладающие фенотипом Trp–. Частота котрансдукции позволяет установить порядок генов в хромосоме cys-trpE-trpC-(trpA, trpB), но не позволяет уверенно определить взаимное расположение trpA и trpB, так как различие между 46 и 47% (см. табл. 8.4) статистически недостоверно. Трехфакторные скрещивания с участием cys, trpE, trpB, схематически изображенные на рис. 8.18, подтверждают, что гены расположены в по-
8. Бактериальный геном 253
следовательности cys-trpE-trpB. Порядок генов можно установить, зная, что рекомбинантный генотип, появляющийся наиболее редко, возникает в результате четырехкратного кроссинговера. (Сравните частоты генотипов cys + trpEtrpB и cys + trpE + trpB.) Разделить рекомбинантные классы trpEtrpB +, trpE + trpB и trpEtrpB, каждый из которых обладает фенотипом Тгр–, можно, используя селективные среды, в которых отсутствует то или иное промежуточное соединение на метаболическом пути биосинтеза триптофана. Пути биосинтеза и прерывающие их ауксотрофные мутации подробно обсуждаются в главе 10, сейчас мы рассматриваем эти мутации просто как генетические маркеры, позволяющие различать некоторые генотипы. Трехфакторные скрещивания в результате трансдукции фагом Р1 позволяют установить на генетической карте взаимное расположение всех генов ауксотрофности по триптофану: Е, С, В и А. Результаты реципрокных трехфакторных скрещиваний представлены в табл. 8.5. В этих скрещиваниях вектор селектируемых маркеров задает участок, в котором произошел единичный перекрест. Положение участка, в котором произошел второй перекрест, выявляется при исследовании частот комбинаций неселектируемых маркеров. Условием выбора маркеров для проведения трехфакторного скрещивания служат данные о возможности их котрансдукции, полученные в предварительных экспериментах.
254 Организация и передача генетического материала
На рис. 8.19 схематически изображены кроссинговеры, приводящие к возникновению рекомбинантов, полученных в экспериментах 1 и 2 из таблицы 8.5. Выбор одной из двух возможных последовательностей генов основывается на следующих рассуждениях: 1) чем ближе неселективный маркер к селективным, тем меньше частота неселективного кроссинговера между ними; 2) четырехкратный кроссинговер происходит реже, чем двойной. Таким образом, поскольку в первом из изображенных на рис. 8.19 эксперименте генотип ЕС+ А+ обнаруживается чаще, чем Ε + С + А +, то гены расположены в последовательности Е- С -А. Правильность такой последовательности подтверждается реципрокным скрещиванием (эксперимент 2), в котором тоже наиболее часто встречается генотип ЕС + А +. Картированные гены ауксотрофности по триптофану образуют оперон (см. гл. 15), в котором последовательность расположения генов соответствует последовательным биохимическим реакциям, приводящим к синтезу триптофана. Мы уже видели, что мутации, влияющие на утилизацию лактозы, расположены в хромосоме очень близко друг от друга (рис. 8.16). Такое «кучное» расположение генов, определяющих родственные генетические функции - это один из наиболее важных фактов, обнаруженных при изучении генетической организации бактерий. Вспомним, что кучное расположение генов, определяющих родственные функции, наблюдалось у бактериофагов λ и Т4 (гл. 7). Такая генетическая организация не случайна: она, по-видимому, отражает фундаментальные основы регуляции генетических функций у прокариотических организмов.
8. Бактериальный геном 255 Дата добавления: 2015-12-16 | Просмотры: 834 | Нарушение авторских прав |