|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Айала Ф., Кайгер Дж. Современная генетика: В 3-х т. Т. 3. Пер. с англ.: – М.: Мир, 1988. – 336 с.22. Генетическая структура популяций 97
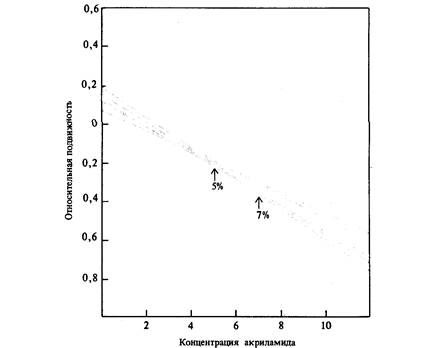
обусловлены тем, что их молекулы имеют разную конфигурацию и разную величину суммарного электрического заряда. Однако некоторые из аминокислотных замен не сопровождаются ни изменением суммарного электрического заряда белка, ни сколько-нибудь существенными изменениями молекулярной конфигурации. Следовательно, с помощью электрофореза мы можем выявить не все различия в аминокислотных последовательностях. Существует несколько методов выявления криптических различий между белками, не обнаруживаемых посредством обычного электрофореза. Один из этих методов, получивший название последовательного электрофореза, состоит в электрофоретической разгонке одних и тех же образцов в различных условиях, например с использованием различных буферов или различных концентраций геля (рис. 22.12). При другом методе образцы ткани или ферменты подвергаются действию высокой температуры или некоторых других денатурирующих агентов, например обрабатываются мочевиной. В результате один из двух электрофоретически неразличимых белков может денатурировать, а второй - остаться Дата добавления: 2015-12-16 | Просмотры: 515 | Нарушение авторских прав |