 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Потенциометрия.Потенциометрия – это физико-химический метод анализа, основанный на измерении величины ЭДС гальванической цепи, составленной из двух электродов: · Стандартного электрода (электрода сравнения); · Измерительного электрода (электрода определения). Оба электрода опущены в исследуемый раствор.
Рис. 6.3 Схема потенциометрического измерения. Электроды 1) Общепринятым стандартным электродом является стандартный водородный электрод, потенциал которого принят равным нулю при любой температуре. Но из-за неудобства пользованием таким электродом на практике применяют обычно хлорсеребряный.
Электрод.
Он состоит из серебряной проволоки, покрытой солью AgCl и опущенной в насыщенный раствор KCl. На межфазной границе протекает реакция восстановления.
Концентрация всех компонентов в полу-реакции постоянны. Поэтому и потенциал этого электрода постоянен.
Согласно уравнению Нернста, потенциалы этих электродов зависят от концентрации этих ионов в растворе.
Принцип работы таких электродов основан на возникновении мембранного потенциала на мембране, встроенный в этот электрод. Эта мембрана имеет избирательную чувствительность к анализируемому иону. Мембраны бывают твёрдыми и жидкими.
Рис 6.5. Дата добавления: 2015-12-16 | Просмотры: 675 | Нарушение авторских прав |
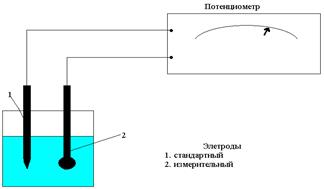
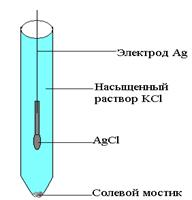
 Рис 6.4. Стандартный хлорсеребряный
Рис 6.4. Стандартный хлорсеребряный
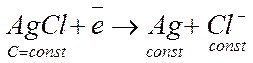
 относительно водородного
относительно водородного (6.11)
(6.11) Чаще всего используют измерительный электрод с твёрдой мембраной – стеклянный электрод для измерения концентрации ионов Н + и величины pH.
Чаще всего используют измерительный электрод с твёрдой мембраной – стеклянный электрод для измерения концентрации ионов Н + и величины pH.