|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Типы растворен-Ных веществ:
Их влияние на
Природа веществ:
Изотерма Поверхностного натяжения:
Уравнение
Гиббса:

Вид адсорбции:
Поведение Веществ в растворе:
Частокол Ленгмюра
ПАВ в жидкостях разной полярности:
Изотерма адсорбции ПАВ:
Табл. 3 Адсорбция газа на твёрдом адсорбенте.
Адсорбенты:
Теория механизма
адсорбции:
Полож-ения теории:
Уравнение Ленгмюра (описывает участки 1,3):
Изотерма
Уравнение Фрейндлиха (описывает участок 2) Табл.4. Молекулярная адсорбция неэлектролитов из раствора на твёрдом адсорбенте.
Состав системы:
Правило Ребиндера:
Принцип смачивания:
Полярности адсорбента и растворителя:
Схема адсорбции
неэлектролита: Расчетное уравнение: Табл.5. Избирательная ионная адсорбция.
Сущность:
Её закономерности:
1 и 2 правила:
Табл.6. Ионообменная адсорбция.
Адсорбенты- иониты:

Пример ионного обмена:
Табл.7. Коллоидные системы Дата добавления: 2015-12-16 | Просмотры: 569 | Нарушение авторских прав |

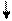
 >0
>0
 ∆
∆ 

 раст-ля
раст-ля  К+An-
К+An-
 Неэлектролиты
Неэлектролиты

 Вещества с дифильной структурой молекул.
Вещества с дифильной структурой молекул.





 ПАВ
ПАВ

 изотермы
изотермы ∆
∆ 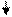 Положительная адсорбция.
Положительная адсорбция.
 Самопроизвольно накапливаются на поверхности из раствора.
Самопроизвольно накапливаются на поверхности из раствора.


 П
П









 Г
Г
 Г
Г 
 СПАВ
СПАВ


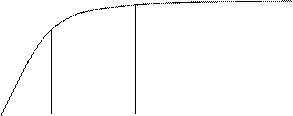
 Мономолекулярная теория Лэнгмюра
Мономолекулярная теория Лэнгмюра



 Образуется мономолекулярный слой - предельная адсорбция
(Г∞).
Образуется мономолекулярный слой - предельная адсорбция
(Г∞).
 На одном центре адсорбируе-тся одна молекула газа.
На одном центре адсорбируе-тся одна молекула газа.
 идет на активных центрах адсорбента.
идет на активных центрах адсорбента.
 десорбция.
десорбция.




 С
С Ленгмюра:
Ленгмюра:






 Несмачивание.
Несмачивание.

 Н П
Н П









 Адсорбция одного вида ионов из раствора.
Адсорбция одного вида ионов из раствора.

 Правила Панета-Фаянса.
Правила Панета-Фаянса.
 На заряженной поверхности адсорбируются ионы противоположного знака.
На заряженной поверхности адсорбируются ионы противоположного знака.
 Адсорбируется ион, входящий в состав адсорбента, способный достраивать его кристаллическую решетку.
Адсорбируется ион, входящий в состав адсорбента, способный достраивать его кристаллическую решетку.
 Cl- Cl-
Cl- Cl-


 R-H
R-H 
 Сущность:
Сущность: