 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Эффект Доннана. Мембранное равновесие ДоннанаЭффект Доннана наблюдается в системах, содержащих полупроницаемую мембрану, которая разделяет два раствора электролитов. Причем, по одну сторону мембраны находятся ионы низкомолекулярного электролита, а по другую – высокомолекулярный электролит, чьи ионы не могут переходить через мембрану: RCOO– Na+, RNH3+ Cl–. Суть этого эффекта состоит в том, что всегда ионы низкомолекулярного электролита переходят через мембрану в сторону ионов высокомолекулярного электролита до тех пор, пока не установится мембранное равновесие Доннана – равенство произведения концентраций подвижных низкмолекулярных ионов по обе стороны мембраны: [Kt+]вн ∙ [An–]вн = [Kt+]нар ∙ [An–]нар (5.3) Примером таких систем в живой природе, где наблюдается эффект Доннана, является клетка. В клетке всегда имеются соли белков PtCOO–Na+ с белковым анионом, не проходящим через клеточную мембрану. Снаружи клетки имеется раствор низкомолекулярного сильного электролита.
 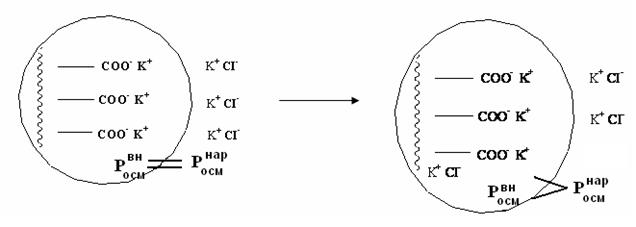
а. исходное состояние б. равновесное состояние Рис.5.7 Мембранное равновесие Доннана Рассмотрим случай, когда общее число ионов в клетке и снаружи одинаково. Тогда наружный и внутренний растворы должны быть изотоничны. Росмвн = Росмнар Но растворы неравновесны с точки зрения диффузии, поэтому низкомолекулярные ионы CI- будут диффундировать внутрь клетки, т.к. их там нет. А за ними перейдет внутрь клетки столько же катионов K+, чтобоы сохранить электронейтральность системы. Этот переход будет происходить до тех пор, пока произведение концентрации подвижных низкомолекулярных ионов по обе стороны мембраны не выровняется. [K+]вн · [CI-]вн = [K+]нар · [CI-]нар Переход части подвижных ионов внутрь клетки приводит к повышению осмотического давления в клетке, раствор в ней становится гипертоническим. Это приводит к осмосу воды в клетку, что и обуславливает тургор клетки (т.е её упругость). Из-за эффекта Доннана общая концентрация ионов в клетке выше, чем снаружи, возникает мембранный потенциал. Число подвижных ионов, перешедших в клетку, рассчитывается по уравнению 5.4

Сколько ионов переходит в клетку, зависит от исходного соотношения концентрации ионов по обе стороны мембраны: а) если наружный раствор является гипертоническим, Свн <<Снар, то Х = Сн2/2Сн = Сн/2, то в клетку перейдет половина наружных низкомолекулярных ионов. б) Если растворы изотоничны, Свн = Снар, то Х = Сн2/Сн + 2Сн = Сн/3. Даже при равной концентрации ионов электролита 1/3 низкомолекулярных ионов перейдет в клетку. в) Если Свн >> Снар, то Х – очень малая величина, но всегда Х>0. Следовательно, при соприкосновении клетки с раствором низкомолекулярного электролита всегда часть его ионов переходит в клетку, поэтому осмотическое давление в клетке будет выше (Р белка + Рэл-та), что способствует поддержанию тургора клеток даже изотонических растворов. Дата добавления: 2015-12-16 | Просмотры: 1065 | Нарушение авторских прав |