 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
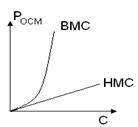
Осмотическое давлениеСогласно закону Вант-Гоффа для растворов низкомолекулярных неэлектролитов осмотическое давление прямо пропорционально молярной концентрации и температуре. Росм.= См·R· Т Осмотическое давление растворов ВМС не подчиняется этому закону Вант-Гоффа, в растворах ВМС оно всегда выше.
Причиной отклонения является большие размеры и гибкость макромолекул. В растворе макромолекулы ведут себя как много коротких молекул. С ростом концентрации ВМС возрастает число кинетически активных фрагментов, а, значит, и осмотическое давление. Галлер предложил для расчета осмотического давления растворов ВМС формулу Р = С/М · RT + bc2 (5.2) где с – весовая концентрация b - константа, учитывающая гибкость и форму макромолекул Осмотическое давление, обусловленное белками крови, называется онкотическим Росм.кр. = Рэл. + Рнэ. + Р белков Оно составляет всего 0,5% от общего осмотического давления крови, но имеет важное биологическое значение. Оно обеспечивает, например, перемещение крови в венозных капиллярах. Артериальные капилляры Венозные капилляры Р гидр.> Росм. Ргидр.< Р осм.
Сброс давления Всасывание Дата добавления: 2015-12-16 | Просмотры: 649 | Нарушение авторских прав |








 Р гидр. Р онк
Р гидр. Р онк 
 .
.
