 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Краткие теоретические сведения. В вирусологической практике широко применяются реакции, основанные на индикации вирусных гемагглютининовВ вирусологической практике широко применяются реакции, основанные на индикации вирусных гемагглютининов. Они получили название диагностических и основаны на способности вирусов адсорбироваться на поверхности эритроцитов, вызывая их склеивание. Это реакции гемагглютинации и гемадсорбции. Реакция гемагглютинации (от греч. Наето - кровь и лат. agglutio — склеивать) -реакция склеивания эритроцитов (РГА). В 1941 г. Херст, Мак Клиленд и Хейр показали, что вирус гриппа агглютинирует эритроциты кур. Впоследствии было показано, что агглютинацию эритроцитов вызывают очень многие, если вообще не все вирусы, относящиеся к большинству известных в настоящее время групп вирусов животных. Было также обнаружено, что некоторые вирусы обладают способностью вызывать адсорбцию эритроцитов на поверхности зараженных ими клеток, растущих в однословных культурах. Это явление было названо гемадсорбцией. Оказалось, что вызываемые вирусами гемагглютинация и гемадсорбция представляют собой весьма полезные инструменты для изучения вирусов, применимые в вирусологических исследованиях самого различного рода. Ниже мы перечислим те области, в которых эти реакции находят применение. А. Выделение вирусов. Гемагглютинация и гемадсорбция широко используются для выявления миксовирусов как в жидкостях зараженных куриных эмбрионов (гемагглю-тинация), так и в зараженных клетках культур тканей (гемадсорбция). Некоторые миксовирусы можно выявить только с помощью гемагглютинации либо гемадсорбции. Ряд вирусов этого типа впервые обнаружили именно с помощью данных методов. Гемадсорбцию используют также для обнаружения вирусов, относящихся к другим классификационным группам (например, к семейству вирусов оспы). Б. Идентификация вирусов. Гемагглютинация и гемадсорбция (конечно, если вирус дает эти феномены) — обычно наилучший способ определения серотипа и классификационной принадлежности вируса. В основе наиболее точного метода идентификации вирусов этого типа лежат реакции торможения гемагглютинации или гемадсорбции. Однако для предварительной идентификации и классификации иногда пользуются иными «маркерами» гемагглютинации. К их числу относится избирательная способность вируса агглютинировать эритроциты животных, титр реакции гемагглютинации, а также оптимальное значение рН и оптимальная температура реакции (4 или 37 °С). В. Классификация вирусов. Установлено, что особенности гемагглютинации вирусов служат хорошей основой для разделения их на группы и подгруппы. Например, то, что вирусы, вызывающие столь различные заболевания, как грипп, свинка и ньюкаслская болезнь, были отнесены к одной классификационной группе, явилось в основном результатом изучения их поведения в реакции гемагглютинации. В качестве классификационных критериев используют тесты на степень перекрестного торможения гемагглютннации, а также «маркеры» гемагглютинации, упомянутые выше. Г.Обнаружение антител. Из всех реакций, в основе которых лежит гемагглютинирующая способность вирусов, наиболее широкое применение для выявления и титрования противовирусных антител благодаря своей простоте находит реакция торможения гемагглютинации. Широта спектра специфичности антител, выявляемых с помощью этой методики, сильно варьирует и определяется в основном классификационной принадлежностью вирусов. Например, при заболеваниях, вызываемых вирусами оспы, с помощью этой реакции выявляются группоспецифичные антитела, тогда как при заболеваниях, вызываемых аденовирусами,— типоспецифичные. Антитела, образующиеся в организме искусственно иммунизированных животных, судя по реакции торможения гемагглютинации, иногда более специфичны, чем антитела, появляющиеся в организме животных, заразившихся естественным путем. Обычно антитела к вирусам, дающим реакцию гемагглютинации, можно титровать с помощью реакции торможения гемагглютинации. Однако это не всегда удается, так как в некоторых случаях в сыворотках содержатся неспецифичные ингибиторы! гемагглютинации, которые не удается удалить ни одним из известных методов. Д. Концентрирование и очистка вирусов. Некоторые вирусы, вызывающие агглютинацию эритроцитов, элюируются с их поверхности при условиях, существенно отличающихся от условий, при которых происходит максимальная адсорбция. Это свойство часто используют на практике. Так, оно лежит в основе относительно простого* метода конце нтрирования и очистки вирусных суспензий. Многие вирусы адсорбируются на эритроцитах при 4 °С, а элюируются при 37 °С, и наоборот. Вирусную суспензию можно смешать с эритроцитами при температуре, оптимальной для адсорбции, затем эритроциты осадить центрифугированием и промыть. Если после этого изменить температуру, то вирус элюируется с эритроцитов, в результате чего получается суспензия вируса, относительно-свободная от сопутствующего материала. При желании объем элюирующей жидкости можно уменьшить. Теоретически для концентрнрования и очистки вирусов можно использовать методы, в основе которых лежат иные способы воздействия на процессы адсорбции и элюции вирусов. Е. Изучение структуры и функции вирионов. Реакция гемагглютинации в сочетании с электронной микроскопией и биохимическими методами исследования является ценным методом изучения структуры и функции вирионов. Теперь, например, стало ясно, что в случае вируса кори и аденовирусов способностью агглютинировать эритроциты обладают не только сами вирионы, но также частицы величина которых значительно меньше, чем величина интактных вирионов Впоследствии во многих лабораториях. РГА широко используется в вирусологической тактике как быстрый, технически простой и надёжный метод для обнаружения гемагглютинирующих вирусов в исследуемом вируссодержащим материале, а также для титрования вирусных гемагглютининов. РГА неспецифична. Механизм реакции состоит в адсорбции вируса на поверхности эритроцитов в результате физико-химического процесса, зависящего от разности зарядов и других сил межмолекулярного притяжения. Эритроциты склеиваются и выпадают в осадок. Агглютинацию эритроцитов вызывают вирусы, содержащие антиген гемагглютинин. Агглютинация эритроцитов — явление, состоящее из трех фаз. В первой фазе происходит адсорбция вируса на эритроцитах. Затем во второй фазе агглютинация эритроцитов с адсорбированным вирусом. Может наступить и третья фаза — элюции (освобождения) вируса от эритроцитов. Факторы, влияющие на РГА многочисленны. Основные из них приводятся ниже. Штампы вирусов. Гемагглютинирующая активность штаммов вирусов неодинакова. У одних серотипов энтеровирусов все штаммы способны агглютинировать эритроциты, тогда как у других серотипов того же вируса не все штаммы обладают этим свойством. Каждый из гемагглютинирующих вирусов способен агглютинироватъ эритроциты животных только определенных видов и в определенном диапазоне температуры и рН среды, что иногда используется при дифференциальной диагностике. Так, эритроциты лошади и кошки агглютинируются вирусом классической чумы птиц и не агглютинируются вирусом Ньюкаслской болезни; владивостокские штаммы вируса Сендай, в отличие от японских штаммов, не агглютинируют эритроциты овцы при температуре 22°С и 37°С, а лишь при 4°С; вирус западного американского энцефаломие- лита лошадей агглютинирует гусиные эритроциты при рН 6.,0...б,2, тогда как вирус Западного Нила — при рН 6,8. Клетка-хозяин. Известно, что в ряде случаев способность вируса агглютинировать эритроциты зависит от хозяина, в котором он размножался. Этот эффект может не зависеть от титра вируса или образования ингибиторов гемагглютинации, хотя очевидно, что определенную роль могут играть и эти факторы. К числу других факторов, которые влияют на гемагглютинацию, относятся доза вируса, используемая при заражении животного, куриного эмбриона или культуры клеток, температура, при которой культуру инкубируют, метод заражения и др. Видовая принадлежность эритроцитов, используемых в РГА, имеет важное значение для реакции. Некоторые вирусы способны агглютинировать эритроциты животных многих видов. В тоже время известны вирусы, агглютинирующие эритроциты животных только одного какого-нибудь вида. В ряде случаев вирусы вызывают агглютинацию эритроцитов животных только тех видов, которые чувствительны к заражению данным вирусом, или клетки которых можно заразить данным вирусом in vitro. В других случаях такую корреляцию обнаружить не удается. Обычно вирусы, относящиеся к одной классификационной группе, способны агглютинировать эритроциты животных, принадлежащих к одному и тому же виду. По вполне понятным причинам в РГА наиболее широко используют эритроциты домашних птиц и млекопитающих. Возраст донора. Возраст донора, от которого получают эритроциты, в значительной степени влияет на их агглютинацию. Например, вирусы оспы значительно интенсивнее агглютинируют эритроциты взрослых кур, чем только что вылупившихся цыплят, а для многих арбовирусов и вирусов бешенства характерна обратная зависимость. Индивидуальные особенности доноров. Известно, что один из факторов, определяющих пригодность эритроцитов животного данного вида для РГА — это индивидуальные различия в чувствительности эритроцитов к вирусу. Среди других факторов, влияющих на способность эритроцитов агглютинироваться вирусами, можно отметить пол животного донора. Факторы окружающей среды, влияющие на РГА. Сильное влияние на агглютинацию эритроцитов вирусами оказывает температура. Одни вирусы агглютинируют эритроциты лучше всего или только при 4 °С, другие — при 37 °С, третьи — одинаково хорошо при любой температуре, хотя по соображениям удобства РГА обычно ставят при комнатной температуре (от 20 до 25 °С). Следует отметить, что пока еще не было обнаружено ни одного вируса который агглютинировал бы эритроциты при этих температурах лучше, чем при 4 °С или при 37 °С. Способность вируса агглютинировать эритроциты, в особенности в тех случаях, когда она слаба, как например, у арбовирусов, зависит также и от концентрации водородных ионов. Так, например, некоторые арбовирусы разрушаются при значениях рН, соответствующих оптимуму для вызываемой ими гемагглютинации. Вирус необходимо разбавлять раствором, рН которого отвечает условиям его стабильности, а затем доводить рН смеси до значения, оптимального для гемагглютинации, используя соответствующий разбавитель. У некоторых вирусов способность агглютинировать эритроциты зависят от наличия или отсутствия в среде некоторых ионов, например, Са2+, Nа+, Mg2+. Иногда присутствие вирусных гемагглютининов маскируется наличием в системе ингибиторов сложного состава, поступающих из клеток, в которых размножался вирус. Перед постановкой РГА эти ингибиторы удаляют путем прогревания, обработки ацетоном, эфиром, фторуглеродными соединениями, трипсином, рецепторразрушающим ферментом и высокоскоростным центрифугированием. Ингибиторы чаще встречаются в препаратах вирусов, полученных из тканей интактных животных, чем из культур клеток. Компоненты реакции: исследуемый вируссодержащий материал (носоглоточные смывы, аллантоисная и амниотическая жидкости, содержимое кожных высыпаний и т.п.); 0,5%...1%-ная взвесь эритроцитов; фосфатно-буферный (физиологический) раствор. Схема постановки. РГА ставят в пластиковых панелях с равномерно округлым гладким дном. Вначале готовят 2-кратные последовательные разведения вируссодержащего материала (от 1:2 до 1:320 и выше). С этой целью в ряд лунок приливают 0,1 мл физраствора. Затем в 1-ю лунку добавляют 0,1 мл исследуемого вируссодержащего материала, перемешивают и 0,1 мл смеси переносят во 2-ю лунку и т.д. Из последней лунки 0,1 мл выливают в дезинфицирующий раствор. Во все лунки добавляют по 0,1…1%-ной взвеси отмытых эритроцитов. Одновременно ставят контроль эритроцитов для исключения возможности спонтанной гемагглютинации. Для этого к 0,1 мл физиологического раствора добавляют 0,1 мл 0,5...1%-ной взвеси эритроцитов. Панели встряхивают и оставляют при комнатной температуре на 30...60 мин (табл.6).
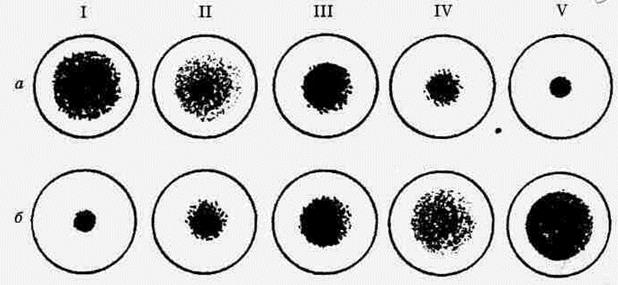
а — титрование вируса: I, II, III — интенсивная агглютинация, обозначаемая тремя и двумя плюсами; IV — слабая агглютинация, обозначаемая одним плюсом; V — отсутствие агглютинации, обозначаемое знаком минус, б — резкая задержка агглютинации. Таблица 6 Схема постановки реакции гемагглютинации (РГА)
Учет и оценка результатов реакции. РГА учитывают визуально по форме образовавшегося осадка эритроцитов — гемагглютината. При резко положительной РГА ("+++") образуется рыхлый осадок (зонтик) на дне и стенках лунки; "++" — осадок только и дне лунки; "+" — наличие незначительной агглютинации эритроцитов на дне лунки; "-" — эритроциты оседают на дне лунки виде точки с ровными краями (отрицательная). Гемагглютинирущий титр вируса — это наибольшее разведение (наименьшее количество вируса), при котором наблюдаете; гемагглютинация не менее чем на "++". Это разведение соответствует одной гемагглютинирующей единице (1 ГАЕ, см. табл.6). В таком же объеме исследуемого (без разведения) материала таких единиц (доз) вируса будет больше во столько раз, во сколько раз пришлось развести материал, чтобы получить 1 ГАЕ. Так, если высшим разведением, еще дающим гемагглютинацию, оцениваемую на "++", будет 1:16 (табл.6), это значит, что в объеме титрования вируса, разведенного в 16 раз, содержится 1 ГАЕ, а в такси же объеме титруемого материала таких единиц будет 16, т.е. титр вируса в данном материале равен 16 ГАЕ. Поскольку суспензию эритроцитов и вируссодержащий материал в разведениях берут в равных объемах, то безразлично, на какой объем будет приходиться 16 ГАЕ, ибо с возрастанием объема одного компонента во столько же раз увеличивается и объем другого. Поэтому соотношение количеств эритроцитов и вирионов смеси вируссодержащего материала с суспензией эритроцитов при изменении их объемов не изменяется, значит, не изменяется и число ГАЕ. Феномен гемагглютинации довольно часто используют для очистки вирусов. Многие из них адсорбируются на эритроцитах при 4 °С, а элюируются при 37 °С и, наоборот. Вирусную суспензию смешивают с эритроцитами при температуре, оптимальной для адсорбции, затем агглютинат центрифугируют и промывают. В дальнейшем изменяют температуру и вирус элюируется с поверхности эритроцитов. В результате получают суспензию вируса, относительно свободную от сопутствующего материала. Гемадсорбция — соединение эритроцитов с поверхностью пораженных вирусом клеток. Сущность реакции заключается в том, что на поверхности клеток, инфицированных гемагглютинирующим вирусом, адсорбируются эритроциты, чувствительные к нему. Так, например, на клетках, инфицированных вирусом парагриппа-3, адсорбируются эритроциты морской свинки, вирусом гриппа — эритроциты кур и т.д. Реакцию гемадсорбции целесообразно ставить с целью обнаружения (до проявления или при слабо выраженном ЦПД) в инфицированной культуре клеток вируса, обладающего гемагглютинирующей способностью. Компонентами реакции служат культура клеток в пробирках в норме и инфицированная, а также 0,4%-ная взвесь эритроцитов, приготовленная на физиологическом растворе или растворе Хенкса. Методика реакции состоит в следующем. Из пробирок с культурой клеток, инфицированных и неинфицированных (контроль), удаляют питательную среду (можно без удаления) и вносят 0,2 мл 0,4%-ной взвеси эритроцитов, способных агтлютинироваться предполагаемым вирусом. Затем штатив с пробирками встряхивают и оставляют в наклонном положении полосой вверх, при комнатной температуре или помещают в холодильник, длительность контакта эритроцитов с клетками зависит от температуры инкубации и вида вируса. Так, гемадсорбция с респираторными вирусами при комнатной температуре наступает через 3...5 мин, а при 4 °С —через 30...50 мин. Учет реакции гемадсорбции проводят при малом увеличением микроскопа после непродолжительного покачивания или вращения пробирки для отделения неадсорбированных эритроцитов от поверхности клеток. При вирусной гемадсорбции эритроциты прочно фиксируются на клетках и сохраняются на них после 1-2-кратного промывания. На клетках, пораженных вирусом, эритроциты адсорбируются в виде островков или диффузно (островковый и диффузный тип адсорбции). При отрицательной реакции адсорбция эритроцитов на культуре клеток не наступает, и они свободно плавают в поле зрения микроскопа. Дата добавления: 2015-12-16 | Просмотры: 1434 | Нарушение авторских прав |





 Вирусосодержащий материал
Вирусосодержащий материал