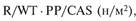Эмболии артерий мозга
Мониторирование кровотока с це-
лью регистрации эмболии произво-
дят по средней мозговой артерии,
поскольку она является наиболее
крупным сосудом, несущим 80 %
крови к соответствующему полуша-
рию, и наиболее доступна для ульт-
развукового исследования. После
корректной регистрации кровотока
по артерии исследование продол-
жают в течение 0,5 ч с записью ре-
зультатов исследования на видео-
магнитофон.
Детекция микроэмболов с помо-
щью УЗ-исследования возможна
только тогда, когда размер и/или
акустический импеданс последних
отличается от такового у нормаль-
ных форменных элементов крови.
Наличие в просвете сосуда движу-
щихся частиц, сопротивление кото-
рых отличается от акустического
сопротивления эритроцитов, вызы-
вает нарушение цветового картиро-
вания спектра допплеровского
сдвига частот с одновременным из-
менением звукового сигнала на
слух «щелкающего» характера. Ин-
тенсивность отраженного от эмбо-
лической частицы ультразвукового
сигнала зависит от ее размера и
акустического импеданса. Воздуш-
ные эмболы по интенсивности име-
ют более сильный сигнал, чем мик-
росгустки крови, жир или атерома-
тозные массы. На СДСЧ регистри-
руются сигналы высокой интенсив-
ности, расположенные по одну или
обе стороны от изолинии. На слух
образуется громкий, «щелкающий»
звуковой сигнал.
Материальные эмболы, акустиче-
ское сопротивление которых близ-
ко к сопротивлению частиц крови,
представлены на СДСЧ в виде сиг-
налов меньшей интенсивности, чем
воздушные эмболы, но большей —
по сравнению с общим фоном
спектра. Сигналы от материальных
эмболов расположены по одну сто-
рону от изолинии, соответственно
регистрируемому потоку крови.
Появление эмболов сочетается с
мягким звуковым сигналом щелка-
ющего характера на слух. Таким об-
разом, качественный анализ спект-
ра допплеровского сдвига частот
позволяет диагностировать наличие
эмболических сигналов на спектре
допплеровского сдвига частот в ис-
следуемом сосуде, высказать пред-
положение о характере эмболиче-
ских частиц. Однако на сегодняш-
ний день в клинической практике
не представляется возможным диа-
гностировать точный состав и раз-
мер регистрируемых эмболов.
В настоящее время в клиниче-
ской практике применяют ультра-
звуковые системы, оснащенные
программным обеспечением авто-
матической регистрации эмболов.
Идентификацию микроэмболиче-
ских сигналов осуществляют мето-
дом автоматической детекции сиг-
налов специальным программным
обеспечением, методом визуально-
го определения по цветовой шкале
градаций и в соответствии с крите-
риями, определенными Spencer и
уточненными согласительным ко-
митетом 9-го Международного сим-
позиума по церебральной гемоди-
намике и межцентровыми соглаше-
ниями (1995).
Для отличия высокоинтенсивных
сигналов от прочих артефактов
было взято за основу, что они име-
ют длительность менее 150 мс в си-
столу и менее 300 мс в диастолу и
энергию, по меньшей мере на 6 дБ
выше фонового спектра скорости
крови, являются однонаправленны-
ми, расположенными внутри огиба-
ющей спектра допплеровского
сдвига частот, в сочетании со зву-
ковым сигналом, описываемым в
литературе как «щелчок». За период
мониторирования подсчитывают
количество микроэмболических
сигналов, измеряют их длитель-
ность, максимальную и среднюю
интенсивность, а также скорость.
2.2.4.5. Методика исследования
глубоких вен мозга и синусов
твердой мозговой оболочки
Исследование глубокой венозной
системы проводят через транстем-
поральное ультразвуковое окно, ис-
пользуя аксиальный срез через про-
межуточный мозг. Этот скан позво-
ляет визуализировать дорсальные
части таламуса и затылочные доли
конечного мозга. Параллельно
средней мозговой артерии распола-
гается глубокая средняя мозговая
вена. Прямой синус представляет
собой окрашенную в синий цвет
точечную структуру, расположен-
ную в дорсальной части серединной
линии, в ряде случаев возможно
визуализировать впадение его в си-
нусный сток. Синусный сток опре-
деляется каудальнее прямого сину-
са и проецируется несколько асим-
метрично на контралатеральную за-
тылочную кость. Кпереди от пря-
мого синуса, в среднедорсальной
части промежуточного мозга, опре-
деляется окрашенная синим цветом
тубулярная структура — большая
вена мозга, или вена Галлена, в ко-
торую впадают внутренние вены
мозга и базальные вены.
Через затылочное ультразвуковое
окно, располагающееся над транс-
форменным окном, используя сере-
динный сагиттальный сканирую-
щий план, визуализируют прямой
синус; также возможно получение
изображения верхнего и нижнего
сагиттальных синусов. В норме
спектр допплеровского сдвига час-
тот в венах мозга имеет слабовыра-
женную фазность.
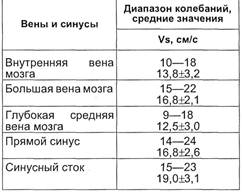
При обследовании здоровых лиц
в возрасте от 25 до 35 лет, согласно
нашим данным, частота визуализа-
ции внутренних вен мозга состави-
ла 100 %, большая вена мозга диа-
гностирована в 71 % наблюдений,
глубокая средняя мозговая вена — в
85,7 %, прямой синус — в 57 %, си-
нусный сток — в 42,8 % случаев.
Количественная оценка кровотока
представлена в табл. 2.10.
Таблица 2.10. Показатели скорости
кровотока по глубоким венам мозга и
синусам в норме
В норме показатели кровотока,
зарегистрированные по данным
ТКД в горизонтальном положении
пациента, отличаются от показате-
лей, полученных при выполнении
ортостатических [изменение поло-
жения тела от ортоположения
(+75°)] и антиортостатических
(—45°) нагрузок. В горизонтальном
положении ЛСК в прямом синусе
(локация через затылочное окно)
находится в диапазоне от 14 до
30 см/с, в ортоположении снижает-
ся — от 13 до 25 см/с, а в антиорто-
положении — увеличивается от 19
до 41 см/с [Шахнович В.А., Галуш-
кина А.А., 1998]. Кроме абсолют-
ных значений скорости кровотока,
авторы предлагают использовать
орто- и антиортостатические ин-
дексы, которые рассчитываются
как процент изменения кровотока
при нагрузке по отношению к го-
ризонтальному положению пациен-
та. В группе здоровых лиц ортоста-
тический индекс составляет 18,8 %
(от 7 до 33 %), антиортостатиче-
ский - 24,9 % (от 11 до 33 %).
2.2.5. Ранние атеросклеретические
изменения в магистральных
артериях
Для диагностики ранних атероскле-
ротических поражений P.Pignoli и
др. впервые в 1986 г. предприняли
попытку количественного изучения
величины комплекса интима — ме-
диа (ВКИМ) в сонных артериях с
помощью ультразвукового исследо-
вания в В-режиме.
ВКИМ в дистальном отделе об-
щей сонной артерии более 1 мм
и/или в бульбусе сонной артерии
более 1,1 мм свидетельствует о на-
личии ранних атеросклеротических
изменений.
Связь между факторами риска
развития атеросклероза и ВКИМ
сонных артерий была убедительно
доказана многими эксперименталь-
ными и клиническими исследова-
ниями. Согласно результатам на-
ших работ, при обследовании лиц
мужского пола в возрасте от 40 до
59 лет с наличием таких факторов
риска развития атеросклероза, как
курение, артериальная гипертензия
в сочетании с начальными проявле-
ниями недостаточности мозгового
кровообращения, выявлены ранние
атеросклеротические изменения в
дистальном участке общих сонных
артерий. Средние значения величи-
ны комплекса интима — медиа со-
ставили 1,26+0,05 мм.
Сопоставление данных липидно-
го состава крови и результатов ис-
следования в В-режиме ОСА у 90
лиц с факторами риска развития
атеросклероза показало, что при
ВКИМ 1,1 — 1,2 мм гиперхолестери-
немия и гипертриглицеридемия
встречаются в 20 % наблюдений,
при КИМ 1,3—1,4 или 1,5 мм и бо-
лее высокий уровень липидов кро-
ви отмечался в 45,5 и 61,5 % на-
блюдений соответственно [Шути-
хина И.В., 1998].
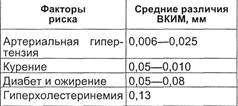
Средние различия между ВКИМ
сонной артерии у лиц с наличием и
отсутствием отдельных факторов
риска развития атеросклероза, вы-
явленные C.Bonithon-Kopp (1996),
представлены в табл. 2.11.
Таблица 2.11. Средние различия меж-
ду ВКИМ сонной артерии у лиц с нали-
чием и отсутствием факторов риска
развития атеросклероза
Результаты наших исследований
ВКИМ у 95 больных с клиниче-
ским проявлением ИБС и отсутст-
вием окклюзирующих поражений в
магистральных артериях шеи и
нижних конечностей показали, что
ранние атеросклеротические изме-
нения только в общих сонных арте-
риях выявлены в 16 % наблюдений,
только в общей бедренной арте-
рии — в 23 % случаев, сочетанные
поражения ОСА+ОБА — у 43 % бо-
льных, и все это на фоне отсутст-
вия клинических проявлений ише-
мии нижних конечностей и нали-
чия дисциркуляторной энцефало-
патии у 11 % больных и ишемиче-
ского инсульта в 20 % наблюдений
[Кунцевич Г.И. и др., 2000]. При
этом по мере нарастания тяжести
клинических проявлений ИБС про-
грессировал ранний атеросклерети-
ческий процесс в общих сонных и
бедренных артериях. Так, у боль-
ных I ФК стенокардии средняя ве-
личина комплекса интима — медиа
в ОСА составляла 1,15+0,05 мм, в
ОБА - 1,19+0,05 мм. У лиц, пе-
ренесших инфаркт миокарда, —
1,25+0,05 и 1,44+0,05 мм соответст-
венно.
Основными признаками пораже-
ния коронарных артерий у больных
с приобретенными пороками серд-
ца следует считать изменение сосу-
дистой стенки при величине инти-
ма — медиа более 2,5 мм в общей
сонной и бедренной артериях и на-
личии мультифокальных пораже-
ний по данным дуплексного скани-
рования [Агаджанова Л.П. и др.,
1998]. Начаты исследования эласти-
котонических свойств артериаль-
ной стенки сонных и бедренных ар-
терий с использованием показателя
модуля Юнга. Модуль Юнга опре-
деляется как отношение стресса к
растяжению и рассчитывается по
формуле:
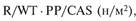
где R — радиус артерии; WT — ве-
личина комплекса интима — ме-
диа; РР — пульсаторное давление;
CAS — изменение диаметра арте-
рии за один сердечный цикл.
В норме величина модуля Юнга
составляет в ОСА 535+22 н/м2, в
ОБА — 682+20 н/м2. Природа более
высоких значений модуля Юнга в
бедренной артерии объясняется
биохимическими свойствами ее со-
судистой стенки, а именно преоб-
ладанием в ней коллагеновых воло-
кон и, следовательно, увеличением
упругости.
Согласно нашим данным, при
обследовании 95 больных ИБС при
отсутствии окклюзирующих пора-
жений в магистральных артериях
шеи и нижних конечностей по мере
нарастания клинических проявле-
ний ИБС регистрируется увеличе-
ние модуля Юнга в общей сонной и
бедренной артериях, где он дости-
гает значений 780+25 и 870+21 н/м2
соответственно [Кунцевич Г.И. и
др., 2000].
Следует подчеркнуть, что модуль
Юнга является более информатив-
ным показателем в диагностике ате-
росклеротического процесса на ран-
них этапах, чем ВКИМ. Так, при
нормальных значениях ВКИМ уве-
личение модуля Юнга выявлено в
ОСА в 23 % наблюдений, в ОБА — в
16 %, сочетанные изменения — в
20 % случаев. Чувствительность уль-
тразвукового исследования в В-ре-
жиме в диагностике атеросклерети-
ческого процесса на ранних этапах с
использованием модуля Юнга со-
ставляет 98 %, специфичность —
88% [Жукова Е.А., 2001].
По данным Э.Ч.Шанцило (2000),
для здоровых лиц характерны низ-
кие значения коэффициента упру-
гости, умеренные его изменения
при проведении проб со статиче-
ской и физической нагрузкой и ни-
федипином. У больных атероскле-
розом отмечаются высокие значе-
ния коэффициента упругости в по-
кое, значительное его возрастание
при пробе со статической нагруз-
кой и практически отсутствие реак-
ции на прием нифедипина. Коэф-
фициент упругости артерий боль-
ных гипертонической болезнью,
повышенный в покое, резко возра-
стает при пробе со статической на-
грузкой и резко снижается при про-
бе с нифедипином.
Метод УЗ-сканирования исполь-
зуется для оценки терапии, прово-
димой у лиц с ранними атероскле-
ротическими изменениями сонных
артерий (табл. 2.12).
Для оценки функционального
состояния эндотелия используют
тесты с анализом изменения плече-
вой артерии под влиянием эндоте-
лийзависимых и эндотелийнезави-
симых стимулов. В В-режиме фик-
сируют изменения в диаметре пле-
чевой артерии и линейной скорости
кровотока в ней в ответ на увеличи-
вающийся поток крови при прове-
дении пробы с реактивной гипере-
мией (эндотелийзависимая реак-
ция) и в ответ на сублингваль-
ный прием 500 мкг нитроглицерина
(эндотелийнезависимая реакция).
Промежуток времени между проба-
ми с реактивной гиперемией и при-
емом нитроглицерина составляет
10 мин. В ходе исследования диа-
метр плечевой артерии измеряют
Таблица 2.12. Оценка эффективности лечения ранних атеросклеротических из-
менений в сонных артериях по данным исследования в В-режиме
10 раз: в покое, через 4,5 мин после
наложения манжеты на область
плеча при пробе с реактивной гипе-
ремией, через 30 и 60 с после сня-
тия манжеты (декомпрессия), снова
в покое и через 1, 2, 3, 4, 5 мин по-
сле приема нитроглицерина. Ско-
рость кровотока оценивают в покое
и сразу после снятия манжеты. Из-
мерение диаметра плечевой арте-
рии проводят линейным методом,
предложенным D.S.Celermajer и со-
авт. (1992), который заключается в
непосредственном измерении диа-
метра артерии с использованием
двух точек: одной — на границе ад-
вентиция — медиа передней стенки
артерии, другой — на границе ме-
диа — адвентиция задней стенки
[Балахонова Т.В. и др., 1998].
Выявлено улучшение эндотелий-
зависимой реакции у больных ИБС
в ответ на пробу с реактивной гипе-
ремией на фоне приема L-аргинина
от 5 % перед началом лечения до
7,8 % после него. Потокзависимая
дилатация плечевой артерии у па-
циентов с распространенным ате-
росклерозом увеличивалась после
2 мес приема флувастатина с 4,7 до
7 % при значимом снижении уров-
ня общего холестерина и холесте-
рина ЛПНП в сыворотке крови
[Балахонова Т.В. и др., 1999].
Оценивая возможности метода
УЗ-исследования в В-режиме в диа-
гностике ранних атеросклеротиче-
ских поражений магистральных ар-
терий, следует подчеркнуть, что в
клинической практике целесооб-
разно использовать этот неинвазив-
ный и информативный способ диа-
гностики ранних морфологических
изменений магистральных артерий
у лиц с факторами риска развития
атеросклероза.
2.2.6. Окклюзионные поражения
внутренних сонных артерий
Дуплексное сканирование сонных
артерий обеспечивает получение
точной диагностической информа-
ции о состоянии стенки и просвета
сосуда, что позволяет применить
данную методику для оценки:
• локализации и степени пораже-
ния артерий;
• структуры атеросклеротической
бляшки.
Исследование больных с окклю-
зионными поражениями внутрен-
них сонных артерий целесообразно
начинать с исследования общих
сонных артерий с учетом количест-
венных показателей величины ком-
плекса интима — медиа в дисталь-
ном отделе общих сонных артерий
и определения локализации и сте-
пени стенозирующих поражений.
Согласно нашим данным, у паци-
ентов со стенозом ВСА менее 60 %
значения величины комплекса ин-
тима — медиа находились в диапа-
зоне 0,9—1,6 мм (среднее значение
1,1+0,2 мм); при стенозе более
60 % — 1,0—1,8 мм (среднее значе-
ние 1,3±0,2 мм).
2.2.6.1. УЗ-критерии диагностики
степени окклюзионных поражений
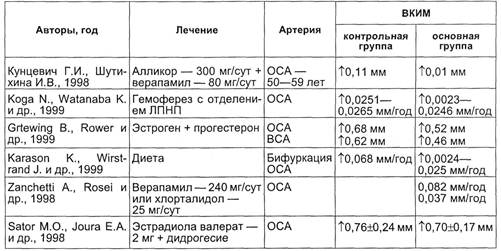
Степень поражения артерий оцени-
вают на основании суммарных дан-
ных, получаемых при расчете про-
цента стеноза по результатам реги-
страции УЗ-изображения и опреде-
ления степени локальных наруше-
ний кровотока по данным анализа
спектра допплеровского сдвига час-
тот. Первый подход основан на ин-
терпретации данных УЗ-изображе-
ния в В-режиме и режимов цвето-
вого допплеровского картирования
и/или ЭОДС. Как бы четко ни
были определены границы контура
бляшки в В-режиме, необходимо
подтверждать полученную инфор-
мацию в режиме ЦДК и/или
ЭОДС. Практически процент сте-
ноза может быть определен двумя
способами: на основании расчета
площади поперечного сечения (Sa)
и по диаметру сосуда (Sd). Все дуп-
лексные системы последнего поко-
ления позволяют производить эти
расчеты автоматически, с помощью
компьютерной программы. Вычис-
ление степени стеноза осуществля-
ют по формулам:
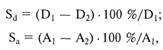
где D1 — истинный диаметр сосуда;
D2 — проходимый диаметр стено-
зированного сосуда; A1 — истинная
площадь поперечного сечения сосу-
да; А2 — проходимая площадь по-
перечного сечения стенозированно-
го сосуда.
Процент стеноза, определяемый
по площади, является более инфор-
мативным, поскольку учитывает
геометрию бляшки, формирующей
стеноз. Как правило, процент сте-
ноза, рассчитанный по площади
поперечного сечения, превышает
процент стеноза по диаметру на
10-20 %.
Гемодинамические характеристи-
ки кровотока в исследуемых арте-
риях включают качественную и ко-
личественную оценку спектра доп-
плеровского сдвига частот и изуче-
ние величины объемной скорости
кровотока.
Анализируют данные СДСЧ в
зоне атеросклеротической бляшки,
для чего контрольный объем поме-
щают в просвет сосуда и плавно пе-
ремещают его в позицию до, над и
непосредственно за бляшкой, а так-
же дистальнее нее, одновременно
регистрируя и оценивая СДСЧ и
звуковой сигнал на слух.
При стенозе почти в 40 % случа-
ев визуализируется выступающая в
просвет сосуда бляшка, более чет-
кая форма которой определяется
при исследовании в режиме ЦДК
или ЭОДС. Спектральный анализ
допплеровского сдвига частот не
выявляет отклонений от нормы.
При стенозе от 40 до 60 % векто-
ры эритроцитов становятся разно-
направленными, и вследствие не-
упорядоченного движения послед-
них возникает локальная потеря
устойчивости кровотока, проявляю-
щаяся расширением СДСЧ с одно-
временным уменьшением или ис-
чезновением площади окна под сис-
толическим пиком. Непосредствен-
но за бляшкой линейная скорость
кровотока может оставаться в пре-
делах нормы или возрастать, однако
кровоток не теряет своего пульсиру-
ющего характера, поэтому форма
контура спектра не меняется.
По мере нарастания стенозирую-
щего процесса регистрируют турбу-
лентный характер кровотока. При
стенозе 60—75 % увеличивается
скорость кровотока, обусловленная
уменьшением просвета сосуда, и
соответственно увеличивается сис-
толическая скорость кровотока, из-
меняется звуковой сигнал на слух.
Поскольку кровоток теряет свой
пульсирующий характер, изменяет-
ся форма контура спектра в виде
сглаживания катакротического
пика, увеличивается угол наклона
восходящей систолической части и
расстояние между восходящей и
нисходящей частями спектра. От-
мечаются значительное расширение
спектра и заполнение окна под сис-
толическим пиком.
Для стеноза 75—90 % присущи
все признаки, характерные для по-
ражения 60—75 %. Кроме этого,
как правило, регистрируют отрица-
тельные значения допплеровского
сдвига частот, обусловленные бес-
порядочным движением эритроци-
тов с направлением как к датчику,
так и от него.
Повышение скорости кровотока
при стенозе 60—75 и 75—90 % от-
четливо регистрируется в режиме
ЦДК в виде изменения интенсив-
ности окрашивания потока на уча-
стке поражения. Как правило, опи-
санные изменения гемодинамики
локальны, регистрируются в месте
препятствия и непосредственно за
ним.
При стенозе более 90 % в месте
препятствия отмечаются резкая де-
формация спектра, который пред-
ставляет собой широкое распреде-
ление частот во всех фазах сердеч-
ного цикла без определения конту-
ра формы спектра из-за ограниче-
ния шкалы скорости кровотока при
использовании линейного датчика.
Обследование таких пациентов с
применением датчика с частотой
излучения 2,5 МГц, где предусмот-
рен более широкий диапазон ско-
ростей, СДСЧ регистрируется в
полном объеме с повышением ско-
рости кровотока свыше 4 м/с. Толь-
ко тщательное сканирование в ре-
жиме ЦДК и ЭОДС в сочетании с
данными анализа спектра доппле-
ровского сдвига частот позволяет
выявить проходимость сосуда и, та-
ким образом, дифференцировать
окклюзию от субтотального стеноза
исследуемой артерии. При наличии
локальной атеросклеротической
бляшки дистальнее максимально
стенозированного участка поток
приобретает ламинарный характер,
о чем свидетельствуют восстановле-
ние контура СДСЧ, снижение ско-
рости кровотока и регистрация
окна под систолическим пиком.
Диагноз окклюзии артерий, участ-
вующих в кровоснабжении голов-
ного мозга, может быть установлен
на основании выявления факта от-
сутствия кровотока по данным цве-
тового картирования и спектра доп-
плеровского сдвига частот. При ис-
следовании артерий с небольшим
по времени сроком окклюзии у
больных достаточно четко визуали-
зируются стенки артерии, гипоэхо-
генный просвет сосуда, заполнен-
ный гиперэхогенными массами.
При длительно существующей ок-
клюзии УЗ-изображение артерий
практически не дифференцируется
от окружающих тканей.
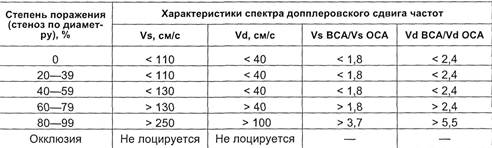
Критерии степени окклюзионно-
го поражения ВСА, основанные на
количественных характеристиках
спектра допплеровского сдвига час-
тот, представлены в табл. 2.13.
Сопоставление данных спектра
допплеровского сдвига частот с инт-
раоперационными результатами в
диагностике степени стеноза ВСА,
согласно нашим исследованиям,
свидетельствует о том, что чувстви-
тельность метода составляет 98 %,
специфичность — 97 %, точность —
99 %. Чувствительность спектра
допплеровского сдвига частот в
определении стеноза 60 % и более
составляет от 77 до 96 %, специфич-
ность — от 78 до 95 %; в диагности-
ке стеноза 70 % и более, чувстви-
тельность — от 77 до 98 %, специ-
фичность — от 87 до 97 %.
Мы провели сопоставление сте-
пени и распространенности атеро-
склеротического процесса во ВСА с
величиной объемной скорости кро-
вотока в общих сонных артериях.
У больных с одно- и двусторонним
стенозом ВСА до 80 % показатели
объемной скорости кровотока в
ОСА статистически достоверно не

Таблица 2.13. Критерии степени окклюзионного поражения ВСА [по Zwiebel V.
1992]
отличались от значений в норме.
Показатели ОСК в общей сонной
артерии при стенозе ВСА более
80 % зависели от состояния проти-
воположной ВСА. Мы отметили
ограничение притока крови к мозгу
на 51 и 36 % при двустороннем сте-
нозе ВСА более 80 % и лишь на
15 % — при одностороннем стенозе
ВСА 80 %, поскольку интактные ма-
гистральные артерии активно участ-
вовали в компенсации мозгового
кровообращения. Степень сниже-
ния величины ОСК при окклюзии
ВСА определялась состоянием про-
тивоположной сонной артерии. Так,
при наличии окклюзии обеих ВСА
отмечалось снижение ОСК на 66 %
нормальной величины. При умень-
шении степени поражения в одной
ВСА величина ОСК оставалась на
47 и 39 % ниже нормальных значе-
ний. В контралатеральной к окклю-
зии ВСА по мере уменьшения сте-
пени поражения увеличивались по-
казатели ОСК, которые в конечном
итоге были выше значений в норме
и носили компенсаторный характер
[Кунцевич Г.И., 1992].
2.2.6.2. Структура
атеросклеротической бляшки
Дуплексное сканирование позволяет
неинвазивно определять структуру
бляшки и выявлять ряд ее осложне-
ний — кровоизлияния, изъязвления,
что крайне важно для определения
тактики лечения больного и выра-
ботки показаний к операции.
Впервые L.M.Reilly и соавт. (1983)
на основании изучения интенсивно-
сти эхосигналов, отражающихся от
структуры бляшки, предложили вы-
делить два ультразвуковых варианта
бляшки в зависимости от морфоло-
гического состава — гомогенную и
гетерогенную. Гомогенной бляшке
соответствовала фиброзная бляшка,
поверхность которой покрыта тон-
ким слоем фибрина, под которой
располагается большее количество
липидов, гладкомышечных клеток и
макрофагов. Гетерогенной бляшке
соответствовала фиброзная бляшка
с изъязвлением, кровоизлиянием,
атероматозом.
Чувствительность ультразвуково-
го исследования в диагностике кро-
воизлияния составляет, по данным
различных авторов, от 72 до 94 %,
специфичность — от 65 до 88 %
[Bluth E.I. et al., 1986; Widder В. et
al., 1990].
Чувствительность ультразвуково-
го исследования в диагностике изъ-
язвления, по данным различных ав-
торов, колеблется от 30 до 90 % и
снижается по мере увеличения сте-
пени стеноза [Goodson S.F. et al.,
1987; Fischer G.G. et al., 1995].
На сегодняшний день в литерату-
ре не существует единой классифи-
кации атеросклеротической бляш-
ки, однако большинство авторов
отдают предпочтение ее структур-
ным характеристикам. Приведен-
ная ниже классификация представ-
ляет собой комплексный подход к
ультразвуковой оценке строения
бляшки и является обобщением ра-
бот ряда авторов [Атьков О.Ю., Ба-
лахонова Т.В., 1999].
I. Ультразвуковая плотность:
• мягкие;
• средней эхоплотности;
• плотные;
• твердые (кальцинирован-
ные).
II. Структура бляшки:
• гомогенная;
• гетерогенная:
а) с преобладанием гипер-
эхогенных элементов (плот-
ного, твердого компонен-
тов);
б) с преобладанием гипо-
эхогенного элемента (мяг-
кого, средней плотности
компонента).
III. Состояние поверхности
бляшки:
• гладкая;
• шероховатая;
• изъязвленная.
Рис. 2.2. Гомогенная ате-
росклеротическая бляшка
внутренней сонной арте-
рии. Изображение в
В-режиме.
IV. Наличие осложнений:
• неосложненная;
• осложненная:
— кровоизлияние;
— изъязвление;
— пристеночный тромбоз.
Гомогенные атеросклеротические
бляшки — это фиброзные бляшки
на разных стадиях формирования
(рис. 2.2).
Мягкой бляшке соответствует
эхонегативное образование, высту-
пающее в просвет артерии, при-
ближающееся по плотности к ее
просвету, расположенное, как пра-
вило, эксцентрично. Выявлению
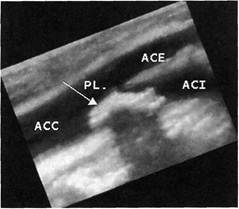
Рис. 2.3. Трехмерная реконструкция
кальцинированной бляшки внутренней
сонной артерии.
такой бляшки способствуют иссле-
дования в режиме ЦДК и особен-
но в режиме энергии отраженного
допплеровского сигнала. В В-ре-
жиме данная бляшка не диагности-
руется.
Бляшке средней эхоплотности со-
ответствует образование, прибли-
жающееся по ультразвуковой плот-
ности к мышечным структурам,
морфологически представляющее
собой фиброзные структуры.
Плотная бляшка по эхоплотности
приближается к адвентициальному
слою артериальной стенки.
Твердая бляшка дает ультразвуко-
вой сигнал высокой интенсивности
и акустическую «тень», перекрыва-
ющую подлежащие ткани, морфо-
логически соответствует кальцино-
зу (рис. 2.3).
Гетерогенные бляшки — бляшки
в стадии атероматоза и атерокаль-
циноза, состоящие из компонентов
различной ультразвуковой плотно-
сти (рис. 2.4, 2.5).
Кровоизлияние в бляшку характе-
ризуется наличием эхонегативной
полости в ее ткани, отделяющей
интимальную бляшку от комплекса
медиа — адвентиция.
Происхождение кровоизлияния
связывают с повреждением сосудов
артериальной стенки (vasa vasorum)
по мере прогрессирования атеро-
склеротического процесса и излия-
нием крови в полость бляшки. На-
Рис. 2.4. Гетерогенная
атеросклеротическая
бляшка внутренней сон-
ной артерии. Изображе-
ние в В-режиме.
растание кровоизлияния способ-
ствует увеличению степени стено-
за и может привести к разрыву
поверхности бляшки, вызывая
тромбообразование на ее поверх-
ности и эмболию в артерии моз-
га.
Ложноположительная диагности-
ка кровоизлияний в бляшку может
иметь место при наличии кальци-
ноза, атероматоза.
Изъязвление поверхности бляшки
диагностируется при выявлении
кратера с резкими, подрытыми
краями, который необходимо ви-
зуализировать при продольном
и поперечном сканировании
(рис. 2.6).
При исследовании в режиме
ЦДК или ЭОДС в чаше кратера
определяется кровоток. Нередко на
его поверхности визуализируются
эхонегативные образования — све-
жие тромботические наложения,
определяющиеся при исследовании
в режиме ЦДК.
Ошибки в диагностике изъяз-
вления могут возникать при нали-
чии:
— двух бляшек, расположенных
рядом;
— бляшки с неровной, шерохова-
той поверхностью без повреждения
ее покрышки.
2.2.7. Извитость внутренних
сонных артерий
Данные ультразвуковой допплеро-
графии позволяют выделить не-
сколько вариантов в состоянии ге-
модинамики, обусловленных изви-
тостью ВСА:
• отсутствие признаков недоста-
точности кровообращения;
• умеренная недостаточность
кровотока;
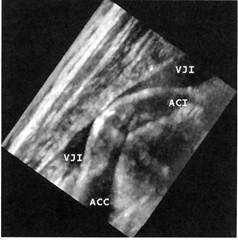
Рис. 2.5. Гетерогенная атеросклероти-
ческая бляшка внутренней сонной ар-
терии. Трехмерное ультразвуковое
изображение.
Рис. 2.6. Атеросклероти-
ческая бляшка с изъязв-
лением внутренней сон-
ной артерии. Изображе-
ние в В-режиме.
• грубая недостаточность крово-
тока;
• признаки дисциркуляции кро-
вотока.
Выявленные изменения анало-
гичны тем, которые наблюдаются
обычно у пациентов при стенотиче-
ском поражении ВСА и, характери-
зуя функциональное состояние
кровотока в бассейне ВСА, отража-
ют степень выраженности этих из-
менений. Однако с помощью мето-
да УЗДГ невозможно выделить ка-
кие-либо характерные УЗДГ-при-
знаки, присущие конкретно состоя-
нию извитости ВСА.
По данным УЗ-изображения,
критерием наличия извитости яв-
ляются изменение прямолинейного
хода артерии шеи или обрыв конту-
ра сосуда, при этом дальнейшее
изображение сосуда может появля-
ться при изменении плоскости ска-
нирования. С внедрением в клини-
ческую практику цветового карти-
рования задача выявления деформа-
ций и уточнения их форм благодаря
окрашиванию потока в просвете ар-
терии существенно облегчилась.
Классификация M.Ciccone осно-
вана на определении величины угла
между теоретической осью сосуда и
его реальным направлением:
• tortuesity (изгиб) — 45—89°;
• kinking (петлеобразование) —
90-120°;
• coiling (перегиб под углом) —
более 120°.
В большом проценте наблюдений
деформация ВСА локализуется
выше устья артерии, и из-за топо-
графически высокой ее локализа-
ции или вовсе не удается получить
изображение извитости, или воз-
можно изучение лишь начального
ее сегмента. Поэтому при УЗ-об-
следовании пациентов, особенно
молодого возраста, имеющих очаго-
вую неврологическую симптомати-
ку при отсутствии патологических
изменений в области бифуркации
общей сонной артерии по данным
дуплексного сканирования, необхо-
димо помнить о возможности суще-
ствования извитости и целесооб-
разности проведения ангиографи-
ческого исследования.
Дуплексное сканирование позво-
ляет оценить состояние устья ВСА,
диагностировать наличие бляшек,
существование которых в какой-то
мере подтверждает вклад атероскле-
роза в формирование извитости.
Кроме того, данный метод исследо-
вания диагностирует септальные
стенозы на участке извитости, раз-
витие которых может быть обуслов-
лено изменением гемодинамиче-
ских условий на участке максима-
льного изгиба сосуда. Исследова-
ние структуры бляшки показало,
что у данного контингента больных
преобладают гомогенные и лишь в
единичных наблюдениях — гетеро-
генные бляшки.
По данным анализа спектра доп-
плеровского сдвига частот можно
выделить особенность, характерную
для всех видов деформаций: лока-
льное повышение скорости крово-
тока в сочетании с чистым артериа-
льным окном под систолическим
пиком на участке максимального
изгиба сосуда.
Проведение более углубленного
исследования извитости артерии с
учетом не только величины диамет-
ра и особенностей кровотока на
участке деформации при различном
уровне артериального давления и
поворотах головы, но и величины
угла в области деформации позво-
лит выявить по данным спектра
допплеровского сдвига частот мо-
менты, важные для принятия реше-
ния о дифференциальной диагнос-
тике между гемодинамически зна-
чимой и незначимой извитостью.
Для определения гемодинамиче-
ской значимости извитости ВСА
можно использовать показатели
ОСК. Среди пациентов, у которых
мы измеряли объемную скорость
кровотока в ОСА, у 52 % величина
ОСК снижалась на 18—55 % диапа-
зона значений в норме. В 48 % слу-
чаев показатели ОСК оставались в
диапазоне нормальных значений
[Кунцевич Г.И., 1992].
2.2.8. Возможности дуплексного
сканирования в оценке
анатомо - физиологических
особенностей позвоночных артерий
Для оценки изменений кровообра-
щения в позвоночной и подклю-
чичной артериях с помощью ульт-
развуковых методов исследования
и, в частности, дуплексного скани-
рования, при различных формах
патологии артерий вертебробази-
лярного бассейна особое внимание
следует обращать на следующие
анатомо-физиологические особен-
ности позвоночных артерий:
• величину диаметра;
• характер анатомического хода;
• возможность визуализации
устья с помощью дуплексного ска-
нирования.
По нашим данным, при исследо-
вании позвоночных артерий в
43,2 % случаев диаметр составил
0,4-0,5 см, в 33,3 % - 0,3-0,4 см,
в 10 % наблюдений — 0,3—0,2 см и
в 13,5 % — 0,2 см и менее. Диаметр
позвоночной артерии в диапазоне
0,3—0,5 см чаще отмечался слева, а
в диапазоне 0,3 см и менее — спра-
ва. Согласно данным J.S.Meyer и
соавт. (1965), J.S.Stopford (1916), в
норме в 73 % случаев отмечается
асимметрия диаметра позвоночных
артерий, при этом в 80 % наблюде-
ний левая артерия больше правой
[Ackerstaff R. et al., 1988].
При сравнении анатомического
хода ПА в проксимальном сегменте
в группе здоровых лиц и в группе
больных с поражением сонных арте-
рий нами отмечена извитость ПА в
виде изгиба или петлеобразования в
27 и 46 % случаев соответственно.
В ряде случаев наблюдается чрез-
мерное удлинение позвоночной ар-
терии, вследствие чего создаются
условия для перегибов или сдавле-
ния их мышцами шеи. По данным
Н.В.Верещагина (1980), в 25-30 %
случаев извитость позвоночной ар-
терии сочетается с аномалиями раз-
вития в виде отхождения позвоноч-
ной артерии от дуги аорты (8 % на-
блюдений), высокого вхождения в
костный канал (на уровне позвон-
ков С4 и С5), латерального смеще-
ния устья.
Исследование устья ПА опреде-
ляется в основном анатомическими
особенностями шеи пациента и
размером используемого датчика.
На аппарате DRF-1000 фирмы «Di-
asonics» устье позвоночной артерии
мы визуализировали в 56 % случаев
[Кунцевич Г.И., 1992]. Согласно
данным ряда авторов, точность
дуплексного сканирования в опре-
делении позвоночной артерии в эк-
стракраниальном отделе составляет
93—100 %, однако успешная визуа-
лизация устья позвоночной артерии
ниже и составляет справа от 82 до
90 % и слева — от 50 до 63 % [Zwie-
bel W.J., 1992]. Более качественную
информацию о состоянии устья ис-
следуемой артерии можно полу-
чить, используя режим ЦДК и/или
энергии отраженного допплеров-
ского сигнала. Согласно нашим
данным, визуализация устья позво-
ночной артерии справа составляет
92 %, слева - 85 %.
2.2.9. Окклюзионные поражения
артерий вертебробазилярного
бассейна
Поражение проксимального сег-
мента подключичной артерии спо-
собствует развитию синдрома по-
звоночно-подключичного обкрады-
вания, величина которого опреде-
ляется степенью поражения под-
ключичной артерии и диаметром
позвоночной артерии. При полном
позвоночно-подключичном синд-
роме обкрадывания, обусловленном
окклюзией устья подключичной ар-
терии, не регистрируется кровоток
в проксимальном сегменте.
Спектр кровотока ПА и результа-
ты проведения пробы «реактивная
гиперемия» приведены в разделе
2.2.1. Мы провели оценку величины
обкрадывания мозга при полном
синдроме обкрадывания. В подклю-
чичной артерии отмечено снижение
объемной скорости кровотока
(ОСК) в среднем на 50 % по сравне-
нию с показателями в норме. При
средних значениях диаметра позво-
ночной артерии 0,4 см величина об-
крадывания мозга составила 100 %.
При интактной или со стенозом до
80 % одноименной ВСА величина
ОСК в общей сонной артерии уве-
личивалась в среднем на 30 %. Ста-
тистически достоверного увеличе-
ния диаметра противоположной ПА
нами не было зарегистрировано, од-
нако отмечалось увеличение ОСК в
среднем на 30 % при интактной или
со стенозом менее 60 % ПА.
При переходном позвоночно-
подключичном синдроме обкрады-
вания, обусловленном наличием
стеноза более 70 % проксимального
сегмента подключичной артерии,
обкрадывание мозга в 2 раза мень-
ше, чем при полном позвоноч-
но-подключичном синдроме обкра-
дывания при одинаковых значени-
ях диаметра ПА.
При стенозе позвоночной арте-
рии степень локальных изменений
скорости кровотока определяется
размерами бляшки, величиной диа-
метра AV и соответствующей дан-
ному диаметру исходной скоростью
кровотока. При выявлении бляшки
ни в одном из наблюдений нами не
была диагностирована гетерогенная
бляшка. В тех случаях, когда невоз-
можно визуализировать устье ПА,
необходимо регистрировать спектр
кровотока на участке, доступном
визуализации, и в зависимости от
отсутствия или наличия нарушений
кровотока в ряде случаев можно
косвенно получить информацию о
состоянии устья исследуемой арте-
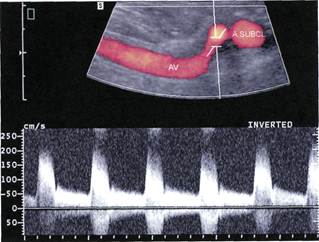
рии (рис. 2.7). Чувствительность
дуплексного сканирования в опре-
делении стеноза более 50 % в устье
ПА составляет 73—76 %, специфич-
ность - 94-97 % [Zwiebel W.J.,
1992].
2.2.10. Окклюзионные поражения
артерий виллизиева круга
По данным ангиографического ис-
следования, стенозы артерий вил-
лизиева круга встречаются пример-
но у 3 % пациентов, страдающих
сосудистыми заболеваниями голов-
ного мозга, при этом чаще поража-
Рис. 2.7. Гемодинамиче-
ски значимый стеноз по-
звоночной артерии.
Изображение в режиме
ЭОДС и СДСЧ.
ется средняя мозговая артерия
[Kaps M, 1998].
Известно, что метод транскрани-
ального дуплексного сканирования
позволяет диагностировать только
гемодинамически значимые стено-
зы артерий, поскольку его разреша-
ющая способность и режимы опти-
мального использования не дают
информации о состоянии стенки
сосудов.
Критерием гемодинамически зна-
чимого стеноза, по данным ЦДК,
может быть локальное изменение
окрашивания просвета артерии на
участке сужения. Однако определя-
ющее значение в диагностике лока-
лизации гемодинамически значимо-
го стеноза имеют данные анализа
спектра допплеровского сдвига час-
тот. Несмотря на то что к настояще-
му моменту уже достаточно хорошо
изучены и оценены диагностиче-
ские возможности спектра доппле-
ровского сдвига частот в диагности-
ке степени стеноза в сонных артери-
ях в экстракраниальном отделе, па-
раметров оценки степени стеноза
артерий виллизиева круга, верифи-
цированных с данными ангиографи-
ческого исследования, на сегодняш-
ний день в литературе нет. Опреде-
ляющее значение для диагностики
гемодинамически значимого стеноза
имеют соотношение скорости кро-
вотока и оценка формы спектра
проксимальнее места сужения, не-
посредственно на участке сужения и
дистальнее его. В каждом из этих
положений показатели линейной
скорости кровотока, форма спектра
будут отличаться от нормы, и интер-
претация их идентична таковой при
диагностике стеноза сонных арте-
рий в экстракраниальном отделе.
По данным J.Ley-Pozo, E.G.Ringel-
stein (1990), сравнение результатов
дуплексного сканирования с данны-
ми ангиографии показало высокий
уровень диагностической точности
ультразвукового метода исследова-
ния в определении стеноза средней
мозговой артерии при регистрации
локального повышения скорости
кровотока с величиной средней ско-
рости кровотока более 80 см/с и на-
личием асимметрии кровотока меж-
ду одноименными артериями выше
30 см/с (при условии односторонне-
го поражения).
Окклюзия средней мозговой ар-
терии может быть диагностирована
при условии хорошей визуализации
структур головного мозга, передней
мозговой артерии и отсутствии в
сильвиевой щели окрашивания
просвета средней мозговой артерии
в режимах ЦДК или ЭОДС.
2.2.11. Интраоперационное
мониторирование мозгового
кровотока
При проведении реконструктивных
операций на магистральных артери-
ях шеи остается открытым вопрос
об оценке адекватного кровоснаб-
жения ткани мозга на этапе пере-
жатия сонной артерии.
Оценка коллатеральной компен-
сации в момент выключения крово-
тока по общей сонной артерии мо-
жет быть проведена по трем на-
правлениям:
• постоянный контроль за невро-
логическим статусом пациента, воз-
можный, однако, только при про-
ведении реконструктивных вмеша-
тельств в условиях местной анесте-
зии;
• интраоперационное измерение
артериального давления прямым
методом с последующим расчетом
индекса ретроградного давления
(ИРД);
• транскраниальное неинвазив-
ное исследование позволяет мони-
торировать и контролировать со-
стояние кровотока в артериях осно-
вания мозга во время операции в
условиях как общего, так и местно-
го обезболивания.
В дооперационном периоде ре-
гистрируется линейная скорость
кровотока в средней, передней,
задней мозговых артериях, позво-
ночной и основной артериях с по-
следующим определением направ-
ления и функционального состоя-
ния передней и задних соедините-
льных артерий.
Существует несколько подходов
к определению толерантности сосу-
дов головного мозга до операции. В
течение 4 мин лечащий врач осуще-
ствляет пальцевое пережатие общей
сонной артерии на стороне предпо-
лагаемой операции, при этом реги-
стрируют кровоток в ипсилатераль-
ной средней мозговой артерии и
проводят наблюдение за состояни-
ем больного. Величина линейной
скорости кровотока в средней моз-
говой артерии после выключения
общей сонной артерии и клиниче-
ское состояние больного дают
предварительную информацию о
ситуации, которая может возник-
нуть во время операции.
Выделяют четыре степени толе-
рантности головного мозга к ише-
мии:
• высокая степень — снижение
ЛСК по СМА до 25 % и отсутствие
неврологической симптоматики;
• удовлетворительная — сниже-
ние линейной скорости кровотока
на 25—50 % и отсутствие невроло-
гической симптоматики;
• низкая — снижение ЛСК на
50—75 %, появление неврологиче-
ской симптоматики на 2—4-й ми-
нуте;
• критически низкая — снижение
ЛСК более 75 %, появление невро-
логической симптоматики через
10-15 с.
Оценку состояния коллатерально-
го кровообращения в момент пере-
жатия общей сонной артерии можно
провести по показаниям линейной
скорости кровотока в средней моз-
говой артерии. При этом выделяют
следующие стадии коллатерального
кровообращения: стадия декомпен-
сации соответствует значениям ли-
нейной скорости кровотока в сред-
ней мозговой артерии 0—10 см/с,
промежуточная стадия — линейной
скорости кровотока в средней моз-
говой артерии 11—20 см/с и стадия
компенсации — линейной скорости
более 20 см/с [Cabrini G.P. et al.,
1998].
Изменение гемодинамики в арте-
риях виллизиева круга при реконст-
руктивных операциях на внутренней
сонной артерии. После введения бо-
льного в наркоз или выполнения
местной проводниковой анестезии
повторно регистрируют линейную
скорость кровотока в артериях вил-
лизиева круга с последующим мо-
ниторированием этих показателей
во время операции. Особое внима-
ние уделяют изменению линейной
скорости кровотока в средней моз-
говой артерии в течение следующих
этапов мониторирования крово-
тока:
• в момент выключения из кро-
вотока общей сонной артерии;
• в период пережатия общей сон-
ной артерии;
• в момент пуска кровотока по
реконструированному сосуду.
Рассчитывать процент изменения
кровотока в средней мозговой арте-
рии во время операции можно,
принимая исходную линейную ско-
рость кровотока за 100 %. Перед
наложением зажима на общую сон-
ную артерию необходимо зафикси-
ровать «чистый», без помех сигнал
от кровотока в средней мозговой
артерии и в момент пережатия об-
щей сонной артерии лоцировать
остаточный кровоток в средней
мозговой артерии.
Кровоток у различных пациентов
снижается неоднозначно: менее
50 %, более 50 % с регистрацией
коллатерального типа кровотока
или на 100 % исходной величины.
Более значительное снижение кро-
вотока в средней мозговой артерии
связано, как правило, с ограничен-
ной способностью коллатерального
кровообращения. Нижней границей
адекватной мозговой перфузии в
момент пережатия общей сонной
артерии является показатель линей-
ной скорости кровотока в средней
мозговой артерии 20 см/с. Коэффи-
циент корреляции между значения-
ми линейной скорости кровотока в
средней мозговой артерии в момент
пережатия общей сонной артерии и
индексом ретроградного давления
составляет 0,81 [Кунцевич Г. И.,
1992].
Мониторирование кровотока в
средней мозговой артерии в момент
выключения сонной артерии из
кровотока позволяет адекватно
контролировать временно возника-
ющий дефицит кровотока в бассей-
не выключенной магистрали.
Информация о клиническом со-
стоянии пациента, величине линей-
ной скорости кровотока в СМА и
интраоперационном измерении АД
позволяет решить вопрос об испо-
льзовании методов защиты мозга.
Во время второго этапа монито-
рирования кровотока, в период пе-
режатия общей сонной артерии, мы
получаем следующую информацию:
— о степени восполнения дефи-
цита кровотока в СМА, при испо-
льзовании временного внутрипро-
светного шунтирования — о его эф-
фективности;
— о реакции смежных артериаль-
ных бассейнов на временно возни-
кающий дефицит кровотока в сис-
теме ОСА на стороне реконструк-
ции.
У больных, оперированных без
защиты мозга, величина прироста
линейной скорости кровотока в
средней мозговой артерии зависит
от состояния противоположной
внутренней сонной артерии и со-
ставляет в среднем 30—40 %, если
противоположная ВСА интактна
или имеется гемодинамически не-
значимый стеноз. В ситуации, ког-
да противоположная внутренняя
сонная артерия окклюзирована, ве-
личина прироста линейной скоро-
сти кровотока меньше.
При использовании временного
внутрипросветного шунтирования
важна оценка его эффективности.
Величина прироста линейной ско-
рости кровотока составляет в сред-
нем 100—220 %. При использова-
нии шунта линейная скорость кро-
вотока в средней мозговой артерии
ниже по сравнению ее с исходными
значениями свидетельствует о низ-
кой резервной возможности арте-
рий смежных бассейнов, что может
быть одной из возможных причин
развития симптомов ишемии мозга
в ближайшем послеоперационном
периоде.
Для оценки реакции смежных ар-
териальных бассейнов на временно
возникающий дефицит кровотока
во время пережатия общей сонной
артерии целесообразно регистриро-
вать линейную скорость кровотока
в передних, средних и задних моз-
говых артериях как на стороне ре-
конструкции, так и в противопо-
ложном полушарии.
Линейная скорость кровотока в
задних мозговых артериях у боль-
ных, оперированных без защиты
мозга, свидетельствует об увеличе-
нии кровотока, больше выраженно-
го на стороне выключенной маги-
страли.
Степень выраженности компен-
саторных возможностей противопо-
ложного каротидного бассейна про-
является в основном в изменении
линейной скорости кровотока в пе-
редней мозговой артерии, однако
функциональные возможности этой
артерии во многом определяются
состоянием одноименной внутрен-
ней сонной артерии.
У больных, оперированных с
применением временного внутри-
просветного шунтирования, во
время пережатия общей сонной ар-
терии повышается линейная ско-
рость кровотока в обеих задних
мозговых артериях, однако в мень-
шей степени, чем у больных, опе-
рированных без защиты мозга. Су-
щественных изменений линейной
скорости кровотока в средней и пе-
редней мозговых артериях противо-
положного полушария, как прави-
ло, не отмечается.
Важным этапом операции явля-
ется момент восстановления крово-
тока по реконструированной арте-
рии, т.е. момент снятия зажима с
общей сонной артерии.
Момент пуска кровотока счита-
ется опасным этапом операции
из-за возможности эмболии пузы-
рьками воздуха, осевшими на стен-
ках артерии в зоне операции, или
материальными частицами. В на-
ших наблюдениях в момент пуска
кровотока эмболы могли или отсут-
ствовать, или регистрироваться.
Максимальное их количество до-
стигало 15. Во всех случаях эмболы
были воздушными. В послеопера-
ционном периоде данных о нали-
чии неврологической симптомати-
ки не отмечено ни в одном наблю-
дении. При успешно выполненной
операции восстанавливается маги-
стральный тип кровотока.
Суммируя данные об особенно-
стях интраоперационного монито-
рирования кровотока в артериях
основания мозга при реконструк-
тивных операциях на магистраль-
ных артериях шеи, следует отме-
тить, что этот вид мониторирова-
ния имеет большое практическое
значение в клинической практике,
поскольку позволяет мгновенно
оценить истинное состояние крово-
тока в артериях основания мозга на
всех этапах оперативного вмешате-
льства. Большое значение для по-
нимания сущности перестройки и
адекватной адаптации мозгового
кровообращения имеют изменения
кровотока в каждой отдельной ар-
терии мозга, поскольку они дают
возможность оценить и наблюдать,
как снижение кровотока в средней
мозговой артерии в момент пережа-
тия общей сонной артерии включа-
ет в работу артерии смежных бас-
сейнов.
2.2.12. Состояние ветвей дуги аорты
после реконструктивных операций
Согласно данным литературы, ответ
артериальной стенки на эндартер-
эктомию существует в виде 4 вари-
антов:
• миоинтимальная реакция, явля-
ющаяся физиологическим ответом
на травму; ее толщина не должна
превышать 3 мм;
• миоинтимальная гиперплазия,
при которой толщина стенки пре-
вышает 3 мм;
• ранний рестеноз (от 12 до 18
мес);
• поздний рестеноз (после 2 лет).
Рассмотренные варианты состоя-
ния реконструированной артерии
достаточно надежно диагностиру-
ются с помощью УЗ-изображения
артерии и спектра допплеровского
сдвига частот. Согласно нашим
данным, среди больных, перенес-
ших каротидную эндартерэктомию,
у 30 пациентов мы провели оценку
и анализ результатов ближайшего
послеоперационного периода и у
70 — отдаленного. При ультразву-
ковом изучении состояния стенки
реконструированной ВСА в бли-
жайшем послеоперационном пери-
оде изменения отсутствовали или
было обнаружено утолщение стен-
ки в 50 % случаев, сужение ВСА
менее 25 % — в 23,3 % и более
25 %, но менее 50 % - в 13,3 %
случаев. Изучение эхогенности
бляшки свидетельствовало о фор-
мировании в ближайшем послеопе-
рационном периоде мягкой повтор-
ной бляшки в 14 случаях и твер-
дой — в 1 случае.
Среди наблюдений, в которых,
по данным изображения реконст-
руированной артерии, отсутствова-
ли какие-либо изменения или ви-
зуально фиксировалось минималь-
ное утолщение стенки, на месте
удаленной первичной бляшки, по
данным спектра допплеровского
сдвига частот, регистрировалось
локальное повышение скорости
кровотока с заполнением артериа-
льного окна, что свидетельствовало
о нарушении ламинарного потока
в реконструированной артерии.
При обследовании этих пациентов
через 2—3 мес изменений по дан-
ным спектра допплеровского сдви-
га частот нами не было обнаруже-
но. Следовательно, формирование
локальных изменений кровотока
на протяжении реконструирован-
ного сегмента артерии в раннем
послеоперационном периоде связа-
но с реакцией стенки сосуда, кото-
рая со временем регрессирует, спо-
собствуя постепенной нормализа-
ции характеристик потока. Эти на-
блюдения, фиксируемые в ближай-
ший период после операции, мы
относили к нормальным первич-
ным проявлениям хирургического
лечения.
Состояние реконструированной
ВСА в отдаленные сроки было не-
сколько иным, чем в ближайшем
периоде: полное отсутствие измене-
ний или наличие утолщения стенки
обнаружено нами у 62,8 % и по-
вторное сужение артерии — у
38,5 % больных, из них у 10 — ме-
нее 25 %, у 11 — менее 50 % и у 4 —
более 50 % просвета сосуда. Изуче-
ние эхогенности повторной бляшки
свидетельствовало о наличии мяг-
кой бляшки в 6 случаях, твердой —
в 7, с отложениями кальция — в 2 и
формирование гетерогенной бляш-
ки—в 1 случае. По нашим дан-
ным, у оперированных пациентов
частота случаев развития рестеноза
составила 5,7 % [Кунцевич И.Г.,
1992].
Проведенные серии исследований
дуплексного сканирования у 68
больных за период наблюдения
30+2 мес позволили в 14,7 % случаев
диагностировать развитие дополни-
тельных гемодинамически значи-
мых поражений в других, неопери-
рованных магистральных артериях.
Клинические симптомы заболева-
ния проявлялись лишь в 1,4 % слу-
чаев, в то время как у остальных па-
циентов они полностью отсутство-
вали. Вышеуказанные обстоятельст-
ва диктуют настоятельную необхо-
димость проведения диспансерного
наблюдения за больными, перенес-
шими КЭАЭ, с целью выявления
возможного прогрессирования ок-
клюзирующего поражения артерий
и соответственно выполнения ре-
конструктивных операций для пред-
отвращения развития инсультов.
К другой группе относятся опе-
рации, выполняемые по поводу ок-
клюзии артерии (протезирование
плечеголовного ствола, подключич-
но-бифуркационное шунтирование,
имплантация подключичной арте-
рии в общую сонную артерию).
В данной группе больных ведущи-
ми УЗ-критериями оценки положи-
тельных результатов лечения явля-
ются восстановление магистрально-
го и антеградного кровотока в ре-
конструированной артерии, увели-
чение показателей объемной скоро-
сти кровотока по сравнению с до-
операционными данными.
Для оценки состояния подклю-
чично-сонного шунта и определе-
ния объема крови, доставляемого
шунтом к мозгу, необходимо оце-
нить просвет шунта, его диаметр и
тип кровотока. В наших наблюде-
ниях ОСК по шунту составляла в
среднем 180—190 мл/мин.
Данные дуплексного сканирова-
ния позволили нам установить кри-
терии, свидетельствующие об адек-
ватном выполнении имплантации
подключичной артерии в общую
сонную артерию:
• антеградное направление кро-
вотока в позвоночной артерии на
стороне реконструкции;
• восстановление магистрального
типа кровотока в реконструирован-
ной подключичной артерии.
Анализируя данные результатов
применения транскраниального ис-
следования в оценке гемодинами-
ческой значимости экстра-интрак-
раниального микроанастомоза
(ЭИКМА) между поверхностной
височной артерией и корковыми
ветвями средней или передней моз-
говыми артериями при окклюзии
ВСА, можно говорить о том, что
создаваемый анастомоз значим тог-
да, когда через него происходит за-
полнение либо крупных ветвей или
ствола СМА, либо мелких ветвей
СМА, находящихся в непосредст-
венной близости от анастомоза. Ло-
кация ретроградного кровотока в
области анастомоза на глубине от
25 до 55 мм и его редукция при
компрессии поверхностной височ-
ной артерии указывают на гемоди-
намическую значимость ЭИКМА
[Куперберг Е.Б., 1998].
2.2.13. Диабетическая
энцефалопатия
При клинически выраженной диа-
бетической энцефалопатии (ДЭ)
выявляются изменения спектра
допплеровского сдвига частот, ре-
гистрируемые по стволу и ветвям
средней мозговой артерии. Оценка
качественного анализа СДСЧ по-
зволяет выделить два типа измене-
ний формы спектра. При одном
виде изменения систолической час-
ти СДСЧ заключались в образова-
нии высокого, острого, четко очер-
ченного систолического пика и
наличии второго пика — меньшей
амплитуды и большей ширины.
При втором типе изменений систо-
лическая составляющая в отличие
от первого типа выглядит цельной
и имеет четкое остроконечное
очертание. Общим для первого и
второго типов изменений систоли-
ческой части спектра является сни-
жение уровня диастолической со-
ставляющей скорости. Данные ко-
личественного анализа СДСЧ в
средней мозговой артерии и ее вет-
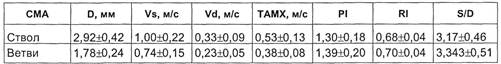
вях представлены в табл. 2.14.
Сопоставление общеклинических
данных и значений кровотока СМА
показало, что самые значительные
отклонения параметров кровотока
Таблица 2.14. Средние значения диаметра и показатели кровотока в средних
мозговых артериях у больных сахарным диабетом с клинически выраженной
диабетической энцефалопатией [Барабашкина А.В., 1997]
отмечаются у пациентов с тяжелой
формой СД. Выраженность измене-
ний кровотока в средней мозговой
артерии и ее ветвях не зависит от
типа СД и возраста больных.
Таким образом, для ранней диа-
гностики поражения ЦНС при са-
харном диабете применение транс-
краниального дуплексного скани-
рования следует рассматривать в
качестве существенного дополни-
тельного объективного способа
диагностики микроангиопатии.
2.2.14. Артериовенозные
мальформации
Выделяют 4 основные категории
сосудистых мальформации голов-
ного мозга: артериовенозные маль-
формации, кавернозные ангиомы,
капиллярные телеангиэктазии и ве-
нозные мальформации.
АВМ в подавляющем большинст-
ве случаев поражают большие полу-
шария головного мозга (до 85 %),
причем нередки случаи интравент-
рикулярной локализации, реже они
располагаются в задней черепной
ямке (15 %) [Дан В.Н. и др., 2000].
Дата добавления: 2015-02-06 | Просмотры: 1222 | Нарушение авторских прав
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
|