|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СИНТЕЗ, ТРАНСПОРТ И ИНАКТИВАЦИЯ ГОРМОНОВСинтез и инактивация белково-пептидных гормонов. Начальные этапы синтеза белково-пептидных гормонов осуществляются на рибосомах гранулярной ЭПС, в результате чего образуются белковые предшественники гормонов, которые затем в результате процессинга превращаются в препрогормоны, прогормоны и, наконец, в гормоны. В отличие от собственных белков клетки, молекулы белково-пептидных гормонов должны выводиться на ее поверхность (т.е. синтезируются "на экспорт" клеткой), в связи с чем их синтез завершается заключением белковых молекул в мембранные гранулы, отшнуровывающиеся от аппарата Гольджи и путем экзоцитоза выводящие свое содержимое за пределы секреторной клетки. Для упаковки молекул гормонов в мембранные гранулы они, после образования на рибосомах, должны проникнуть внутрь цистерн гранулярной ЭПС. Предполагается, что все матричные РНК, кодирующие препрогормоны, на 5'-конце содержат общую (одинаковую для различных мРНК, кодирующих разные гормоны) нуклеотидную последовательность, кодирующую первые 20-25 аминокислотных остатков полипептидной цепи на N-конце пептидной молекулы, большинство из которых являются гидрофобными и выступают в роли своеобразного сигнального участка препрогормона. После образования этого сигнального участка он начинает взаимодействовать с рецепторами мембраны ЭПС, и рибосома, транслирующая мРНК гормона, прикрепляется к мембране ЭПС. Более того, благодаря гидрофобности этого N-концевого участка, он внедряется в мембрану ЭПС и по мере синтеза пептидной цепи обеспечивает дальнейшее протягивание внутрь цистерн ЭПС всей пептидной молекулы. Таким образом, синтезированная молекула препрогормона оказывается внутри эндоплазматического ретикулума, где от нее отщепляется сигнальный участок, и препрогормон превращается в прогормон. Превращение прогормона в гормон осуществляется в аппарате Гольджи путем отщепления под действием протеаз определенных фрагментов. Доставка же мембранных везикул с заключенным в них прогормоном в аппарат Гольджи происходит с участием микротрубочек и микрофиламентов с затратой энергии. Образующиеся в аппарате Гольджи молекулы гормона окружаются мембраной аппарата Гольджи и в виде мембранных везикул транспортируются к плазматической мембране. Внутри везикул, наряду с молекулами гормона, как правило, содержатся вспомогательные белки, обеспечивающие дозревание гормона (например, ацетилирование N-конца или амидирование С-конца). После слияния везикул, содержащих молекулы гормона, с плазматической мембраной секреторной клетки, они высвобождают свое содержимое в межклеточные щели, а опустошенные везикулы изнутри отшнуровываются от мембраны и поступают обратно в цитоплазму секреторной клетки. Такая последовательность процессов типична для синтеза большинства белково-пептидных гормонов. Так, при образовании инсулина в b-клетках островков Лангерганса вначале на рибосомах, присоединяющихся к цистернам ЭПС, синтезируется препроинсулин, представляющий собой одну полипептидную цепь, состоящую из 109 аминокислотных остатков. По завершении синтеза на рибосомах этот полипептид благодаря наличию на N-конце гидрофобного участка, включающего 23 аминокислотных остатка, оказывается внутри цистерн ЭПС, где от него отщепляется эта концевая гидрофобная последовательность, в результате чего препроинсулин превращается в проинсулин. Везикулы с проинсулином переносятся в аппарат Гольджи, в полости которого мембранная протеиназа обеспечивает исключение из молекулы прогормона, содержащей 86 аминокислотных остатков, фрагмента 31-65, что приводит к образованию двух цепей инсулина (a и b), соединенных двумя дисульфидными связями. Затем образовавшиеся молекулы инсулина вместе с исключенным пептидным участком, частично молекулами проинсулина (составляют около 5% молекул от количества таковых зрелого инсулина) и ионами цинка (проявляют высокое сродство к инсулину, изменяют его пространственную структуру и препятствуют растворению) оказываются внутри отшнуровывающихся от аппарата Гольджи мембранных везикул и путем экзоцитоза выводятся за переделы клетки. Синтез молекулы проинсулина происходит за 1-2 минуты, транспорт проинсулина от гранулярной ЭПС к аппарату Гольджи занимает 10-20 минут, "созревание" проинсулина в аппарате Гольджи и транспорт его к плазматической мембране занимает 1-2 часа. При этом в отсутствии действия на b-клетки островков Лангерганса стимулирующей их секреторную активность глюкозы все равно осуществляется постоянный синтез инсулина, а под действием глюкозы стимулируется главным образом слияние инсулиновых везикул с плазматической мембраной клетки, что приводит к усиленной секреции гормона, тогда как скорость собственно синтеза инсулина, его созревание (процессинг) и внутриклеточный транспорт изменяются в меньшей степени. От начала синтеза белково-пептидных гормонов до момента появления их в местах секреции проходит 1-3 часа. Таким образом, низкая скорость секреции белково-пептидных гормонов обуславливает регуляцию их содержания в крови преимущественно не на стадии синтеза или внутриклеточного транспорта, а на стадии секреции из клетки. При этом в самих секреторных клетках запасены большие количества готовых к высвобождению молекул гормона в секреторных гранулах. Регуляторный же сигнал, поступающий к секреторным клеткам, вызывает опустошение части гранул, в результате чего концентрация гормона в крови может быстро и резко возрастать. Некоторые сравнительно короткие пептидные гормоны могут образовываться из одного общего предшественника. Так, из b-липопротеина (состоит из 91 аминокислотного остатка) в аденогипофизе образуется как минимум 6 гормонов: g-липопротеин (1-58 аминокислотные остатки), меланоцитстимулирующий гормон (41-58), b-эндорфин (61-91), a-эндорфин (61-76), метионин-энкефалин (61-65). Данный факт обуславливает то обстоятельство, что такие гормоны зачастую проявляют свои эффекты совместно, поскольку индукция образования одного гормона из этой группы приводит и к усилению синтеза других. Так, АКТГ и МСГ синтезируются в аденогипофизе из общего предшественника и имеют гомологию в строении, в связи с чем МСГ проявляет слабую кортикотропную активность, а АКТГ в больших дозах способен вызывать потемнение кожи (причина потемнения кожи при болезни Аддисона как раз и связана с высоким уровнем АКТГ в крови, синтезируемом компенсаторно в ответ на дефицит глюкококортикоидов после удаления надпочечников). Некоторые предшественники белковых гуморальных факторов могут синтезироваться в печени (так ангиотензиноген – предшественник ангиотензина II – синтезируется в печени, после чего поступает в кровь, где под влиянием ренина превращается в прогормон ангиотензин I, который затем под действием ангиотензинконвертирующего фермента плазмы крови превращается в активный гормон ангиотензин II). Концентрация белково-пептидных гормонов в крови, как правило, составляет 10-10 – 10-11 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2-5 раз. Например, в состоянии покоя в крови человека содержится около 0,2 мкг АКТГ (в расчете на 5 л крови), тогда как при стрессе концентрация этого гормона возрастает до 0,8-1 мкг. Концентрация глюкагона и инсулина в отсутствии действия стимулирующих их секрецию факторов составляет соответственно 0,5 мкг и 5 мкг. В случае, когда человек голоден, содержание глюкагона повышается до 2 мкг, а инсулина снижается на 40-60%. После принятия пищи концентрация глюкагона снижается в 1,5-2 раза, а инсулина повышается до 10-25 мкг. Полупериод жизни белково-пептидных гормонов в крови составляет 10-20 мин, их разрушение происходит под действием протеиназ клеток-мишеней, крови, печени, почек. Возможна инактивация гормона и в самой эндокринной железе, и этот процесс может быть регулируемым. Так, при повышении содержания ионов кальция в крови, дефицит которых стимулирует продукцию паратгормона околощитовидными железами, в секреторных клетках железы повышается активность специфической протеиназы, инактивирующей паратгормон, и скорость его инактивации увеличивается в 5-10 раз. Наряду с протеиназами, в инактивации белково-пептидных гормонов могут принимать участие и другие ферменты, модифицирующие структуру белковой молекулы и, как следствие, делающие ее доступной для действия протеиназ. Так, первым этапом инактивации инсулина является расщепление дисульфидных связей между его a и b-цепями под действием трансдегидрогеназы, после чего они становятся доступны для протеолиза инсулиназой (встроена в мембрану клеток-мишеней, обладает высокой специфичностью и сродством к инсулину).
Синтез и инактивация стероидных гормонов. К группе стероидных гормонов – производных циклопентанпергидрофенантрена – относят половые гормоны (мужские – андрогены и женские – эстрогены и прогестерон, или гестаген), а также гормоны коры надпочечников – кортикостероиды, включающие минералокортикоиды (самый активный – альдостерон) и глюкокортикоиды (самый активный – кортизол или гидрокортизон). Синтез андрогенов преимущественно осуществляется в клетках Лейдига семенников (эндокринных клетках семенников, основным их андрогеном является тестостерон), небольшая доля андрогенов образуется в фолликулярном эпителии яичников и в сетчатой зоне коры надпочечников (продуцирует менее активный, чем тестостерон, дигидроэпиандростерон). Самым активным андрогеном и к тому же секретируемым эндокринными клетками семенников в наибольшем количестве является тестостерон. В клетках-мишенях под действием фермента 5a-редуктазы тестостерон может превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. Причем ЛГ аденогипофиза, стимулирующий синтез тестостерона клетками Лейдига семенников, одновременно активирует превращение тестостерона в дигидротестостерон в клетках-мишенях, тем самым усиливая андрогенные эффекты на организм. Основным местом синтеза эстрогенов (в основном представлены эстрадиолом) являются яичники, но при этом небольшая их доля может синтезироваться и семенниками (эпителиальными клетками семенных канальцев – клетками Сертоли). Прогестерон (или гестаген) синтезируется клетками желтого тела яичников и эндокринными структурами плаценты. Минералокортикоиды синтезируются в клубочковой зоне коры надпочечников, а глюкокортикоиды – в пучковой и сетчатой зонах коры надпочечников, хотя небольшое их количество может образовываться и в половых железах. Все эндокринные структуры, вырабатывающие стероидные гормоны, имеют общее эмбриональное происхождение: развиваются из урогенитального гребешка (производное мезодермы) и в результате дифференцировки специализируются на продукции одного или нескольких стероидных гормонов. При этом тип стероидного гормона, образующегося в той или иной эндокринной структуре, определяется соотношением активностей ферментов, катализирующих альтернативные пути синтеза стероидов. Так, например, начальные этапы синтеза всех кортикостероидов осуществляются в пучковой зоне коры надпочечников, после чего большая часть образующихся предшественников кортикостероидов остается в клетках пучковой зоны, где под действием их ферментных систем превращается в глюкокортикоиды, часть захватывается клетками клубочковой зоны, где под действием ее ферментных систем превращается в минералокортикоиды, и, наконец, небольшая доля этих общих предшественников кортикостероидов захватывается клетками сетчатой зоны, где превращается преимущественно в андрогены. Большая часть холестерина (60-70%), необходимого для синтеза стероидных гормонов, поступает в эндокринные клетки из плазмы крови, где он ассоциирован с липопротеидами (у человека – ЛПНП, тогда как у крысы – с ЛПВП) и небольшая доля холестерина, используемого для синтеза стероидов (30-40%), представляет собой эндогенный холестерин (т.е. холестерин, синтезируемый самими эндокринными клетками из ацетил-КоА и накапливающийся в них в составе липидных капель). Экзогенный холестерин поступает в эндокринные клетки путем эндоцитоза. При этом и эндогенный, и экзогенный холестерин находятся в эндокринных клетках в виде эфиров с ненасыщенными жирными кислотами, в связи с чем первым этапом синтеза стероидных гормонов является отщепление от холестерина жирной кислоты, которое катализируется холестеринэстеразой. Свободный холестерин поступает в митохондрии и там превращается в прегненолон (при этом участвуют цитохром Р450, десмолаза и ряд других ферментов). Лимитирующей стадией синтеза прегненолона является гидроксилирование боковой цепи холестерина, причем ингибирующее влияние на этот процесс оказывает сам образующийся прегненолон (отрицательная обратная связь, предотвращающая синтез избыточного количества стероидных гормонов). Образовавшийся прегненолон покидает митохондрии, попадает в цитоплазму и частично в эндоплазматический ретикулум, на мембранах которого, а также в самой цитоплазме и происходят все дальнейшие стадии синтеза стероидов. Мембрана эндокринной клетки не препятствует проникновению образовавшихся стероидных гормонов в межклеточные пространства, в связи с чем секреция этих гормонов стероидпродуцирующими клетками происходит параллельно с их синтезом (т.е. в отличие от клеток, продуцирующих белково-пептидные гормоны, и фолликулов щитовидной железы, вырабатывающих тиреоидные гормоны, эндокринные структуры, продуцирующие стероидные гормоны, не запасают значительных их количеств, а секретируют гормоны сразу же после их выработки). Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада и регулируется в большей степени путем изменения скорости их синтеза под влиянием определенных гуморальных факторов. Стимулирующими синтез стероидных гормонов в эндокринных клетках факторами являются следующие гормоны. Синтез глюкокортикоидов в пучковой и сетчатой зонах коры надпочечников стимулируется АКТГ аденогипофиза (пептид, состоящий из 39 аминокислотных остатков, синтезируется базофильными аденоцитами гипофиза из общего предшественника для АКТГ, a-МСГ и b-липотропина). В отсутствии АКТГ кора надпочечников истончается, вся железа уменьшается в размерах, а продукция глюкокортикоидов падает практически до нуля. При этом продукция альдостерона тоже несколько снижается, но остается достаточной для того, чтобы предотвратить потерю воды и солей организмом. Наряду с аденогипофизом, АКТГ вырабатывается и некоторыми структурами головного мозга и обнаруживается в них даже у гипофизэктомированных крыс. Скорость секреции АКТГ у человека составляет 5-25 мкг в сутки (при этом под действием такого количества АКТГ кора надпочечников продуцирует 20-50 мг кортизола в сутки, что свидетельствует в пользу значительного усиления стимулирующего гуморального сигнала на уровне самих надпочечников). В условиях стресса секреция АКТГ аденогипофизом может возрастать во много раз. Подобно большинству аденогипофизарных гормонов и рилизинг-гормонов гипоталамуса, АКТГ секретируется эпизодически (7-9 импульсов секреции за 3 часа), кроме того имеют место и суточные колебания секреции АКТГ: наибольший уровень его секреции отмечается в 4-6-8 часов утра (перед пробуждением), а наименьший – в конце дня незадолго до сна. Период полураспада АКТГ в крови составляет 15-25 минут. Наряду с регулирующим влиянием АКТГ на секрецию глюкокортикоидов корой надпочечников, он оказывает воздействие и на поведенческие реакции организма: в частности, облегчает выработку условных рефлексов и замедляет их угасание. Стимуляция синтеза андрогенов в семенниках осуществляется под влиянием ЛГ аденогипофиза, эстрогенов в яичниках – под влиянием ФСГ, а прогестерона желтым телом яичников – ЛГ аденогипофиза (ФСГ и ЛГ являются пептидами, каждый из которых состоит из двух нековалентно связанных субъединиц – a и b, период полужизни ЛГ составляет 12-45 минут, а ФСГ – 12 минут, элиминируются из крови печенью и почками). ФСГ в женском организме стимулирует фолликулогенез в яичниках, в результате осуществления которого в яичниках появляется все больше эндокринных структур, продуцирующих эстрогены. Эстрогены же, наряду с ФСГ, участвуют в стимуляции фолликулогенеза, кроме того, совместными их эффектом с ФСГ является индукция активности ароматазы в эндокринных клетках яичников, катализирующей превращение андрогенов в эстрогены, а также усиление синтеза в этих клетках рецепторов для ЛГ, что подготавливает созревающие фолликулы к действию на них ЛГ. ЛГ, в свою очередь, способствует овуляции зрелого фолликула и формированию на его месте желтого тела, продуцирующего эстрогены, прогестерон и простагландины (ЛГ стимулирует эндокринную функцию желтого тела). В мужском организме ФСГ косвенно способствует нормальному течению сперматогенеза в извитых семенных канальцах семенников (путем стимуляции образования в эпителиальных клетках канальцев (клетках Сертоли) рецепторов для андрогенов, высокие концентрации которых необходимы для осуществления сперматогенеза), кроме того, ФСГ стимулирует синтез в клетках Сертоли эстрогенов из андрогенов. Вместе с тем, лишь небольшая часть эстрогенов, циркулирующих в крови мужчин, секретируется семенниками, основное же их количество образуется в результате метаболизма (ароматизации) андрогенов семенников и надпочечников в других тканях (в частности, в жировой). ЛГ в мужском организме оказывает стимулирующее влияние на продукцию андрогенов эндокринными клетками семенников (клетками Лейдига). Секреция минералокортикоидов клубочковой зоной коры надпочечников регулируется ренин-ангиотензиновой системой (в частности, активным ее фактором ангиотензином II, стимулирует секрецию минералокортикоидов, активация же самой ренин-ангиотензиновой системы осуществляется под влиянием секретируемого почками ренина в ответ на снижение системного и почечного минутного объема кровотока, артериального давления и объема циркулирующей крови), натрийуретическими факторами, синтезируемыми правой половиной сердца (самый активный – атриопептин, подавляют секрецию минералокортикоидов, стимулом для синтеза атриопептина служит увеличение венозного возврата крови к правой половине сердца и соответственно ее перерастяжение), адреногломерулотропином эпифиза (стимулирует секрецию минералокортикоидов); кроме того, синтез минералокортикоидов стимулирует СТГ аденогипофиза и повышенное содержание ионов калия в периферической крови, тогда как повышенное содержание ионов натрия в крови, напротив, тормозит продукцию минералокортикоидов. Вместе с тем эффект гуморальных факторов, стимулирующих продукцию минералокортикоидов пучковой зоной коры надпочечников, может проявляться только в присутствии АКТГ (пермиссивное или «разрешающее» действие АКТГ в отношении эффекта других гормонов). Регуляция же синтеза тропных гормонов аденогипофизом, влияющих на стероидогенез, осуществляется гуморальным и отчасти нервным путем. Так, секреция АКТГ аденогипофизом стимулируется кортиколиберином гипоталамуса и зависит от уровня самих глюкокортикоидов в периферической крови. Секреция же кортиколиберина медиобазальным гипоталамусом регулируется как нервным путем (стимулируется рефлекторно в ответ на действие любых стрессовых факторов – эмоциональное возбуждение, боль, холод, гипоксию и т.д.), так и рядом гуморальных факторов (тироксин, адреналин, инсулин, АДГ, окситоцин, ангиотензин II стимулируют секрецию кортиколиберина гипоталамическими нейронами и к тому же усиливают реакцию аденогипофиза на кортиколиберин). Секреция гонадотропных гормонов аденогипофизом регулируется гонадолиберином медиобазального гипоталамуса (декапептид, секретируется эпизодически с пиком в вечернее время суток, его секреция регулируется не только гуморальными факторами (например, пролактин подавляет секрецию гонадолиберина), но и непосредственными нервными влияниями со стороны коры больших полушарий и других отделов мозга). Причем в женском организме стимулирующий эффект гонадолиберина на синтез ФСГ или ЛГ зависит от уровня эстрогенов в периферической крови: при высоком содержании эстрогенов в крови гонадолиберин стимулирует синтез ЛГ, а при низком – ФСГ. В мужском организме гонадолиберин гипоталамуса оказывает постоянное стимулирующее влияние как на синтез ФСГ, так и ЛГ, но вместе с тем высокий уровень андрогенов в периферической крови тормозит секрецию ЛГ аденогипофизом (отрицательная обратная связь, препятствующая избыточному накоплению андрогенов в периферической крови). Действие рилизинг-гормонов гипоталамуса на аденогипофизарные клетки, продуцирующие тропные гормоны, стимулирующие стероидогенез, осуществляется аденилатциклазным путем (т.е. в результате активации аденилатциклазы в аденоцитах и, как следствие, повышения уровня цАМФ в них). Тропные гормоны аденогипофиза – АКТГ, ФСГ и ЛГ – активируют транспорт эфиров холестерина в эндокринные стероидпродуцирующие клетки-мишени, а также отщепление от этих эфиров жирных кислот, повышают активность митохондриальных ферментов, участвующих в образовании прегненолона. Кроме того, эти тропные гормоны аденогипофиза стимулируют окислительные процессы в стероидпродуцирующих клетках, что обеспечивает процессы стероидогенеза энергией (так, АКТГ стимулирует фосфорилазу, глюкозо-6-фосфат-дегидрогеназу, изоцитратдегидрогеназу и малик-фермент, участвующие в восстановлении НАДФН, необходимого для гидроксилирования предшественников глюкокортикоидов). Молекулярные механизмы действия АКТГ и гонадотропных гормонов на стероидпродуцирующие клетки связаны с образованием под их влиянием цАМФ и последующими реакциями цАМФзависимого фосфорилирования (кроме того, для реализации эффектов тропных гормонов на стероидпродуцирующие эндокринные клетки, наряду с цАМФ, необходим и кальций, который облегчает связывание тропного гормона с рецептором и участвует в механизме действия цАМФ на стероидогенез). цАМФ-зависимая активация ряда ферментов обуславливает стимуляцию транспорта холестерина, а также активацию холестеринэстеразы и фосфорилазы. Вместе с тем основные эффекты АКТГ и гонадотропинов на стероидогенез начинают развиваться лишь спустя 10-20 минут после повышения концентрации цАМФ в стероидпродуцирующих клетках, кроме того, эти тропные гормоны не вызывают усиления синтеза стероидных гормонов в том случае, если вводятся одновременно с ингибиторами синтеза белка (например, актиномицином), несмотря на то, что под их влиянием происходит повышение концентрации цАМФ в стероидпродуцирующих клетках. Отмеченные факты свидетельствуют в пользу того, что эти тропные гормоны оказывают свое влияние на стероидпродуцирующие клетки двумя одинаково важными и согласованно работающими механизмами активации стероидогенеза: цАМФзависимым фосфорилированием ферментов и изменением матричной активности генома. Существует мнение, что цАМФ участвует в обоих этих процессах: с одной стороны, она стимулирует фосфорилирование белков цитоплазмы, имеющих отношение к активации ферментов стероидогенеза и факторов, участвующих в транспорте холестерина, а с другой – вызывает переход протеинкиназы в ядро и вызванное ею (каталитической субъединицей) фосфорилирование гистононых и негистоновых белков, что оказывает влияние на пространственную структуру хроматина, кроме того, регуляторная субъединица протеинкиназы может непосредственно связываться с определенными белками хроматина и вызывать определенные конформационные перестройки в нем. Конформационные перестройки в определенных участках хроматина, в свою очередь, сопровождаются некоторой деконденсацией этих участков, а, следовательно, и улучшением их доступности для транскрипции. Таким образом, под действием тропных гормонов гипофиза в стероидпродуцирующих клетках-мишенях для этих гормонов активируется мембранносвязанный фермент аденилатциклаза, что сопровождается повышением уровня цАМФ в цитоплазме клеток-мишеней. цАМФ, в свою очередь, путем активации протеинкиназы обеспечивает не только запуск фосфорилирования белков в клетке и, как следствие, активацию определенных ферментов стероидогенеза и факторов, обеспечивающих поступление холестерина в секреторную клетку, но и путем непосредственного влияния активированной под влиянием цАМФ протеинкиназы на белки хроматина может стимулировать синтез ферментов стероидогенеза, повышение концентрации которых также способствует стимуляции синтеза стероидных гормонов в клетках-мишенях. Ангиотензин II, образующийся из белка-предшественника плазмы крови при активации ренин-ангиотензиновой системы и стимулирующий синтез минералокортикоидов в клубочковой зоне коры надпочечников оказывает следующее влияние на ее клетки. Являясь пептидом, ангиотензин II, подобно тропным гормонам аденогипофиза, внутрь секреторных клеток не проникает, а связывается с мембранными рецепторами секреторных клеток клубочковой зоны коры надпочечников. Образование гормон-рецепторного комплекса приводит к временному увеличению проницаемости мембран секреторных клеток для кальция. Повышение же внутриклеточной концентрации кальция в клубочковой зоне коры надпочечников сопровождается активацией ферментов, катализирующих превращение 11-дезоксикортикостерона в альдостерон. В крови человека в норме содержится около 500 мкг кортизола, при стрессе его содержание может повышаться до 2000 мкг (т.е. в 4 раза). Содержание альдостерона в крови в 1000 раз ниже такового кортизола – 0,5 мкг; если же человек находится на бессолевой диете, содержание альдостерона может повыситься до 2 мкг. Концентрация тестостерона у мужчин составляет 20-40 мкг, тогда как у женщин в норме – 2-4 мкг. Содержание эстрадиола у женщин в отсутствии беременности – 0,25-2,5 мкг, при беременности – повышается до 50-100 мкг, тогда концентрация этого гормона в мужском организме составляет 0,1-0,2 мкг. При этом 90-95% стероидных гормонов в крови обычно находятся в связанном состоянии с белками плазмы, тогда как действующие (свободные) концентрации стероидных гормонов составляют 10-8-10-10 М. Полупериод их жизни равен 0,5-1,5 часа. Распад стероидных гормонов может происходить во многих тканях: печени, почках, кишечнике, мышцах и других структурах. В результате метаболических изменений стероидных гормонов при их инактивации молекулы утрачивают биологическую активность и повышают свою гидрофильность, что важно для экскреции метаболитов почками.
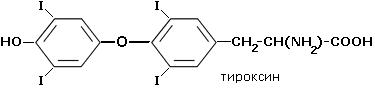
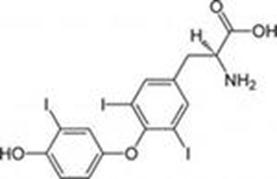
Биосинтез и инактивация тиреоидных гормонов. Тиреоидные гормоны являются производными аминокислоты тирозина и представляют собой йодированные тиронины. Молекула йодированного тиронина состоит из двух молекул тирозина, соединенных гидроксильной связью и йодированных по трем (трийодтиронин) или четырем (тетрайодтиронин или тироксин) гидроксильным группам.
тироксин
трийодтиронин
Синтез тиреоидных гормонов происходит в фолликулах щитовидной железы. Фолликул представляет собой структурно-функциональную единицу щитовидной железы и состоит из стенки, образованной одним слоем фолликулярных клеток (эпителиальной природы, в норме кубических по форме), и полости, заполненной коллоидом (представляет собой промежуточное вещество в синтезе тиреоидных гормонов). И фолликулярный эпителий, и полость фолликула принимают участие в синтезе тиреоидных гормонов. Так, вначале в фолликулярных клетках с участием гранулярной ЭПС и аппарата Гольджи синтезируется гликопротеид тиреоглобулин. Синтез его белковой части осуществляется на рибосомах гранулярной ЭПС, после чего белковая часть тиреоглобулина в составе мембранных везикул отшнуровывается от цистерн гранулярной ЭПС и доставляется путем активного транспорта к цистернам аппарата Гольджи, в полости которого происходит синтез углеводной части тиреоглобулина и ассоциация ее с белковой частью. Белковая часть тиреоглобулина является димерной, имеет молекулярный вес 670000 Да; каждая белковая субъединица состоит примерно из 5000 аминокислотных остатков, из которых около 120 приходится на тирозин. Мембранные пузырьки, содержащие тиреоглобулин отшнуровываются от цистерн аппарата Гольджи и путем экзоцитоза через апикальные поверхности фолликулярных клеток (обращенные в полость фолликула) высвобождают свое содержимое в фолликулярную полость. Синтез тиреоглобулина осуществляется с очень большой скоростью: содержимое первых гранул, меченных радиоактивным йодидом, в коллоиде, находящемся в фолликулярной полости, удается обнаружить уже через несколько минут после введения радиоактивной метки. В полости фолликула тиреоглобулин депонируется и йодируется. Йодирование тиреглобулина осуществляется по гидроксильным группам аминокислотных остатков тирозина и возможно благодаря высокой концентрации йода в щитовидной железе. Фолликулярные клетки обладают способностью поглощать из крови йод. В мембрану базальной поверхности фолликулярных клеток встроен йодный насос, осуществляющий закачку йодида из тканевой жидкости против 100-500 кратного градиента путем активного транспорта. Йодный насос насыщаем (при сильном избытке йода ингибируется), и его деятельность зависит от работы Na+/K+-насоса. Щитовидная железа, несмотря на свой относительно небольшой размер, способна извлекать 20-40% йодида, присутствующего в крови, основная же часть непоглощенного йода (до 90%) экскретируется из организма с мочой; концентрация накапливающегося в щитовидной железе йодида в 30-40 раз превышает таковую в плазме крови. Главным фактором, стимулирующим работу йодного насоса тиреоцитов, является ТТГ аденогипофиза. Йодид поступает из крови в тканевую жидкость соединительнотканных прослоек щитовидной железы по градиенту концентрации, после чего захватывается фолликулярными клетками (создают же этот градиент концентрации сами тиреоциты, извлекающие йодид из тканевой жидкости щитовидной железы и поддерживающие таким образом низкие концентрации йода в соединительной ткани, окружающей капилляры). Йодид (I-), поступающий в фолликулярные клетки, является химически инертным, для включения его в состав тиреоглобулина (йодирования тиреоглобулина) необходимо окисление йодида (т.е. превращение его в йодиниум (I+)), которое происходит в полости фолликулов при участии фермента тиреопероксидазы, встроенного в мембрану апикальной поверхности фолликулярных клеток, и перекиси водорода. При этом в самом фолликуле существует градиент концентрации йода, который обуславливает движение йодида, захваченного фолликулярной клеткой путем активного транспорта, пассивно в направлении от базальной части клетки к апикальной и последующему поступлению в полость фолликула, где концентрация свободного йода минимальна из-за его включения в тиреоглобулин. Образующийся йодиниум включается в гидроксильные группы фенольного кольца тирозина и имидазольного кольца гистидина, входящих в состав тиреоглобулина (при этом йодируется лишь около 10% остатков тирозина, локализующихся преимущественно на поверхности глобулы тиреоглобулина). Йодирование тирозиновых остатков тиреоглобулина завершается образованием моно-и дийодтирозинов в составе тиреоглобулина, после чего в молекуле йодированного тиреоглобулина происходит внутримолекулярная перегруппировка, представляющая собой «сшивку» внутри молекулы тирозиновых остатков через оставшиеся нейодированными их гидроксильные группы. Такая внутримолекулярная сшивка представляет собой окислительную реакцию, протекающую с участием пероксидазы и завершающуюся образованием внутри молекулы тиреоглобулина йодированных тиронинов (три- и тетрайодтиронина). Для того, чтобы йодированные тиронины высвободились из тиреоглобулина и экскретировались из фолликулярных клеток должен произойти протеолиз тиреоглобулина в фолликулярных клетках, что требует обратного поступления тиреоглобулина внутрь фолликулярных клеток. Захват тиреоцитами тиреоглобулина осуществляется путем эндоцитоза (при этом поглощается не только йодированный, но и частично нейодированный тиреоглобулин, но первыми все же подвергаются эндоцитозу молекулы тиреоглобулина, которые последними йодировались). После чего вакуоли, содержащие тиреоглобулин, сливаются с лизосомами фолликулярных клеток, и под действием протеаз лизосом происходит расщепление тиреоглобулина до аминокислотных остатков. В результате протеолиза тиреоглобулина, наряду с различными аминокислотами, которые повторно реутилизируются клеткой на синтез нового тиреоглобулина, высвобождаются и йодированные тиронины, а также небольшое количество молекул йодированного тирозина, которые частично поступают в межклеточные пространства и кровь (гормональной активностью они, в отличие от йодированных тиронинов, не обладают), а большей частью вновь используются тиреоцитами для синтеза новых молекул тиреоглобулина (в самих тиреоцитах подвергаются дейодированию и тут же реутилизируются). При расщеплении одной субъединицы тиреоглобулина, включающей более 5000 аминокислотных остатков и 300 углеводных радикалов, образуется всего лишь 1-3 молекулы йодированных тиронинов. При этом тироксина образуется в 10 раз больше, чем трийодтиронина. Секреция высвободившихся из связи с тиреоглобулином тиреоидных гормонов из тиреоцитов происходит путем пиноцитоза. Так, мембранные пузырьки, содержащие тиреоглобулин и слившиеся с лизосомами тиреоцитов, после расщепления тиреоглобулина подходят к базальной части тиреоцитов и встраиваются в плазматическую мембрану, опустошая свое содержимое в межклеточные пространства. При этом в тканевую жидкость, наряду с йодированными тиронинами, поступают и другие аминокислоты, входившие в состав тиреоглобулина, откуда они вновь поглощаются тиреоцитами и используются либо для синтетических (синтеза нового тиреоглобулина и других белков клетки), либо для энергетических нужд. Высвобождающиеся в составе пиноцитозных пузырьков из тиреоцитов йодированные молекулы тирозина быстро дейодируются (дейодиназами тканевой жидкости, крови и периферических тканей) и вновь поступают в фолликулярные клетки. Наряду с секрецией тиреоидных гормонов щитовидной железой, в кровь поступают и небольшие количества тиреоглобулина. Регуляция секреции тиреоидных гормонов фолликулярными клетками щитовидной железы осуществляется преимущественно гуморальным путем. В этом процессе участвуют как тиреотропный гормон аденогипофиза, так и катехоламины и ряд других гуморальных факторов (в частности, простагландин Е2), способных повышать концентрацию цАМФ в тиреоцитах. Кроме того, показано, что тиреотропин аденогипофиза обладает способностью стимулировать вход кальция в тиреоциты (возможно в результате непосредственного действия на проницаемость мембран тиреоцитов для кальция) и активировать синтез фосфатидилинозитола. Повышение концентрации цАМФ, кальция и фосфатидилинозитола в цитоплазме тиреоцитов оказывает стимулирующее влияние на синтез тиреоглобулина и тиреоидных гормонов, а также на рост и пролиферацию тиреоцитов. В частности, цАМФ путем цАМФзависимого фосфорилирования клеточных мембран тиреоцитов стимулирует активный транспорт йода внутрь клеток из крови, а путем цАМФзависимого фосфорилирования цитоплазматических и ядерных белков (в том числе белков хроматина) обуславливает ускорение синтеза мРНК тиреоглобулина и рибосомальной РНК, что сопровождается усилением транскрипции и трансляции тиреоглобулина и на фоне усиленного транспорта йода в тиреоциты, а затем в полость фолликулов, приводит к увеличению синтеза тиреоидных гормонов щитовидной железой. Кроме того, под влиянием избыточных концентраций тиреотропного гормона наблюдается рост тиреоцитов, и они из кубических превращаются в высокие призматические, а также усиленное деление фолликулярных клеток, что приводит к разрастанию паренхимы щитовидной железы и повышению ее способности синтезировать тиреоидные гормоны. Наиболее важную роль в регуляции секреции тиреоидных гормонов щитовидной железой играет гипоталамо-гипофизарная система. Так, в медиобазальном гипоталамусе синтезируется пептид тиреолиберин (подобно большинству рилизинг-факторов гипоталамуса, синтезируется импульсно (эпизодически) как днем, так и ночью с пиком секреции в часы, предшествующие сну; во время сна его секреция снижается), является трипептидом, обнаружен не только в гипоталамусе, но и в эпифизе и внегипоталамических отделах мозга, где вероятнее всего синтезируется, а не доставляется из медиобазального гипоталамуса (внегипоталамический тиреолиберин может влиять на поведенческие реакции и электрофизиологические процессы в нервной системе). Тиреолиберин с током венозной крови доставляется в аденогипофиз, связывается с рецепторами базофильных аденоцитов, продуцирующих ТТГ, и активирует в их мембране фермент аденилатциклазу, что приводит к временному повышению содержания цАМФ внутри клеток и обусловленной этим секреции тиреотропного гормона (наряду со стимуляцией секреции ТТГ аденогипофизом, тиреолиберин стимулирует и секрецию пролактина). Кроме того, существует мнение, что стимулирующее действие тиреолиберина на продукцию ТТГ аденогипофизарными клетками может опосредоваться кальцием (внутриклеточная концентрация которого в тиреотрофах после введения тиреолиберина увеличивается) или продуктами превращения полифосфатидилинозитола. Тиреотропный гормон, секреция которого аденогипофизом возрастает под влиянием тиреолиберина, представляет собой белок (мол. масса – 29000 Да), состоящий из двух субъединиц (a и b, т.е. является гетеродимером, одна из его субъединиц идентична субъединице гипофизарного ЛГ и плацентарного хорионического гонадотропина), включающий 22 аминокислотных остатка цистеина, все SH-группы которого связаны между собой и образуют внутри молекулы 11 дисульфидных мостиков, стабилизирующих молекулу белка. В щитовидной железе тиреотропин связывается с рецептором, включающим два домена – домен гликопротеидной природы и домен, образованный ганглиозидом GM1, и локализованный на наружной поверхности мембран тиреоцитов (для инициации биологического ответа молекула ТТГ должна вступить в контакт с обоими доменами рецептора тиреоцитов). Как уже отмечалось выше, ТТГ стимулирует как синтез тиреоидных гормонов фолликулярными клетками (воздействуя на все этапы внутриклеточного йодного цикла и синтез тиреоглобулина в тиреоцитах), так и разрастание паренхимы щитовидной железы, что приводит к повышению секрецию ею тиреоидных гормонов. Более того, в исследованиях in vitro показано, что диспергированные с помощью протеолитических ферментов тиреоциты при добавлении в среду ТТГ через несколько часов заново собираются в фолликулы, и этот процесс «сборки фолликулов» предотвращают ингибиторы синтеза РНК и белка. Отмеченное очевидно свидетельствует в пользу того, что ТТГ способствует синтезу каких-то компонентов клеточной мембраны, необходимых для распознавания тиреоцитами друг друга, а также для формирования межклеточных контактов между ними. В отсутствии ТТГ тиреоциты нормальной щитовидной железы сохраняют определенную способность концентрировать йодид, но синтез и секреция тиреоидных гормонов оказываются резко заторможенными. Сами же тиреоидные гормоны в крови, связываясь с рецепторами клеток медиобазального гипоталамуса, секретирующих тиреолиберин, и аденогипофиза, продуцирующих ТТГ, ингибируют секрецию этих стимулирующих факторов (отрицательная обратная связь). Причем в настоящее время принято считать, что основной точкой приложения тормозного действия тиреоидных гормонов на секрецию стимулирующих факторов гипоталамо-гипофизарной системой служат клетки аденогипофиза, вырабатывающие ТТГ: тиреоидные гормоны, связываясь с рецепторами аденоцитов через определенный лаг-период делают их резистентными к стимулирующему действию тиреолиберина (т.е. отрицательная обратная связь осуществляется преимущественно на гипофизарном уровне, хотя не исключается и участие в этом гипоталамуса). Кроме того, тиреоидные гормоны повышают концентрацию в плазме крови протеиназ, расщепляющих тиреолиберин (при этом они стимулируют синтез и секрецию почками или печенью пироглутаматпептидазы, отщепляющей от тиреолиберина N-концевой остаток – пироглутамат, и тем самым инактивирующей тиреолиберин). Существует также предположение, что ингибирующее влияние на синтез ТТГ аденогипофизом может оказывать соматостатин (связывание соматостатина антисывороткой у крыс приводит к повышению базальной секреции ТТГ аденогипофизом) и дофамин. Реакция аденогипофиза на тиреолиберин модулируется и другими гормонами: эстрогены повышают чувствительность аденоцитов гипофиза к тиреолиберину и тем самым усиливают секрецию ТТГ и соответственно тиреоидных гормонов, а глюкокортикоиды и гормон роста, напротив, ингибируют реакцию аденоцитов-тиреотрофов на тиреолиберин, что сопровождается в конечном итоге снижением секреции тиреоидных гормонов щитовидной железой. С другой стороны, обратное торможение тиреоидными гормонами секреции тиреолиберина гипоталамусом сказывается и на других гормональных системах организма, так как тиреолиберин стимулирует секрецию не только ТТГ, но и гормона роста аденогипофизом. Наконец, отрицательная обратная связь в биосинтезе тиреоидных гормонов может замыкаться на уровне самой щитовидной железы: тироксин непосредственно тормозит синтез тиреоглобулина фолликулярными клетками. Тиреоидные гормоны характеризуются достаточно большой продолжительностью жизни в крови по сравнению со многими другими гормонами и нейромедиаторами. В частности, они могут циркулировать в крови в неизменном виде в течение нескольких дней (тогда как период полужизни стероидных гормонов в крови – 0,5-1,5 часа). Такая устойчивость тиреоидных гормонов объясняется прочной их связью с глобулинами и преальбуминами плазмы крови (около 10% тиреоидных гормонов транспортируется альбуминами плазмы). Причем эти белки имеют в 10-100 раз большее сродство к тироксину, чем к трийодтиронину; кроме того, как было отмечено ранее, тироксина щитовидной железой образуется в 10 раз больше, чем трийодтиронина, в связи с чем содержание тироксина в крови (300-500 мкг) в 50 раз больше такового трийодтиронина (6-12 мкг). Вместе с тем, особенности связывания тиреоидных гормонов с белками плазмы крови (и, в частности, очень низкое сродство трийодтиронина к транспортирующим тиреодные гормоны белкам) обуславливает тот факт, что концентрация свободного трийодтиронина в плазме оказывается лишь в 2 раза ниже концентрации свободного тироксина. Запасы тиреоидных гормонов в щитовидной железе, входящие в состав тиреоглобулина, намного превышают суточную потребность организма в них. Человек может выдерживать полное прекращение поступления йода с пищей без нарушения содержания тиреоидных гормонов в крови в течение нескольких месяцев (по некоторым данным до полугода). Вся система по синтезу тиреоидных гормонов очень экономична, в связи с чем щитовидная железа способна адаптироваться к низкому поступлению йодида в организм путем увеличения его захвата тиреоцитами, что обеспечивается повышением емкости механизма транспорта йодида. Причем поскольку транспортируемый в тиреоциты йодид быстро окисляется и включается в тиреоглобулин (органифицируется), создается высокий градиент йода внутри самих фолликулов щитовидной железы, что обеспечивает увеличение эффективности его поглощения из крови фолликулярными клетками. Наиболее уязвимы в молекуле тиреоидных гормонов атомы йода в положениях 3’ и 5’. Их отщепление дейодиназами приводит к потере биологической активности гормонов. После дейодирования тиронины могут восстанавливаться до двух молекул тирозина; тиронины (а возможно и йодтиронины) могут подвергаться также декарбоксилированию, дезаминированию или переаминированию. В печени и почках могут образовываться конъюгаты тиронина с глюкуроновой кислотой или сульфатом, которые затем экскретируются с калом и мочой.
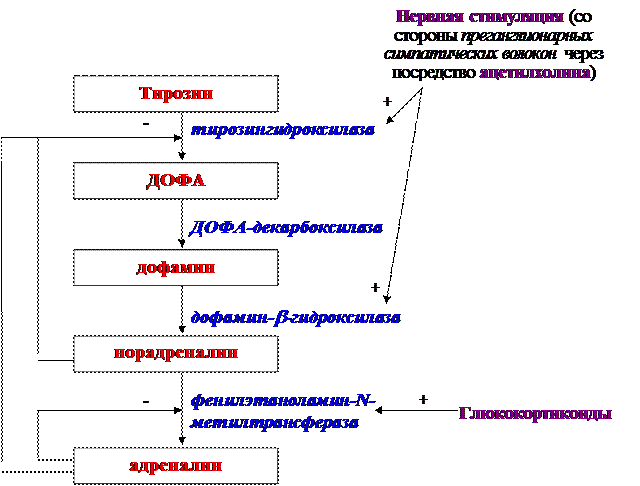
Биосинтез, секреция и инактивация катехоламинов. Катехоламины (адреналин и норадреналин), подобно тиреоидным гормонам, являются производными аминокислоты тирозина, однако при их биосинтезе превращению подвергается свободная аминокислота, а не тирозиновые остатки, входящие в состав тиреоглобулина. Синтез катехоламинов завершается помещением их в специальные хромаффинные гранулы, в которых катехоламины депонируются, а затем в их составе экскретируются секреторными клетками (концентрация катехоламинов внутри этих гранул примерно в 10000 раз превышает таковую в окружающем цитозоле клетки). Более того, некоторые промежуточные стадии биосинтеза катехоламинов осуществляются внутри этих гранул. Хромаффинные гранулы являются наиболее типичной особенностью хромаффинных клеток и представляют собой электроноплотные, покрытые оболочкой частицы, по размерам уступающие митохондриям. Они являются высокоспециализированными, сложно устроенными органеллами; окружены мембраной, которая содержит разнообразные белки и гликопротеины, включая протонный насос (Н+-АТФазу), белок-переносчик катехоламинов, белок-переносчик нуклеотидов, цитохром b-561, актин, различные гликопротеины, ориентированные внутрь клетки, и дофамин-b-гидроксилазу. При слиянии мембраны гранул с плазматической в момент экскреции все эти вещества высвобождаются в межклеточные пространства.
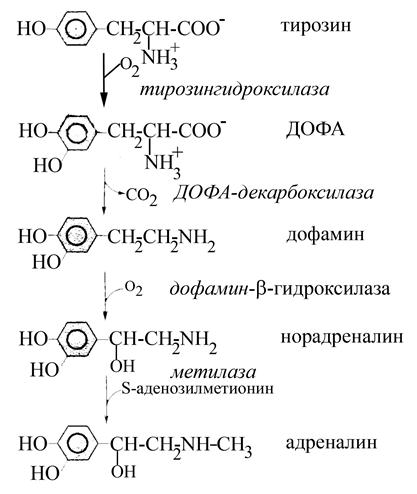
Рис. Основные этапы биосинтеза катехоламинов
Биосинтез катехоламинов осуществляется следующим путем. Вначале тирозин подвергается окислению (с участием фермента тирозингидроксилазы и с использованием молекулярного кислорода), в результате чего образуется диоксифенилаланин (ДОФА). Данный этап является наиболее медленным в биосинтезе катехоламинов, а активация фермента, его катализирующего, осуществляется под действием холинергической стимуляции секреторных клеток. Затем ДОФА подвергается декарбоксилированию (под действием ДОФА-декарбоксилазы) и превращается в дофамин. Эти процессы протекают в цитоплазме клеток, после чего дофамин проникает в специальные хромаффинные везикулы и при наличии в них фермента дофамин-b-оксидазы (или дофамин-b-гидроксилазы, обнаруживается только в хромаффинных гранулах, является Сu2+-содержащим ферментом) подвергается окислению, что приводит к образованию норадреналина. Норадреналин можетсекретироваться из этих везикул во внеклеточное пространство или же выходить в цитоплазму клетки, где при наличии фермента метилазы (фенилэтаноламин-N-метилтрансферазы), метилируется (донором метильной группы служит S-аденозилметионин) и превращается в адреналин. Адреналин из цитоплазмы должен вновь поступать в хромаффинные гранулы, в составе которых экскретируется из клеток. При этом в гранулах, депонирующих катехоламины, всегда присутствует специальный катехоламинсвязывающий белок и АТФ, и секреция катехоламинов в синаптическую щель или кровь сопровождается выбросом АТФ и связывающего белка. Транспорт катехоламинов (дофамина, адреналина) из цитоплазмы секреторных клеток в хромаффинные гранулы является активным: энергия, необходимая для его осуществления, вырабатывается благодаря работе протонной помпы, встроенной в мембрану этих гранул (т.е. подобно тому, что имеет место в митохондриях).
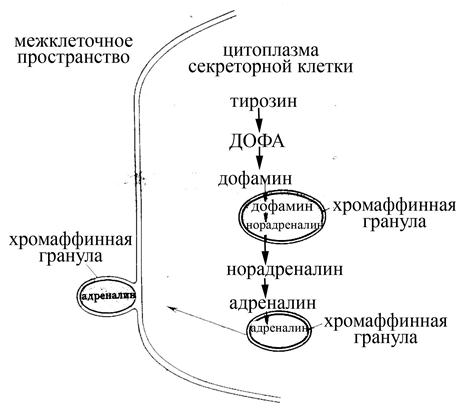
Рис. Локализация различных этапов биосинтеза катехоламинов в клетке
Синтез катехоламинов осуществляется не только в эндокринных клетках мозгового вещества надпочечников, но и в ряде нейронов ЦНС, а также в симпатических нейронах вегетативных ганглиев. Кроме того, в некоторых клетках (нейросекреторные клетки медиобазального гипоталамуса, нейроны черной субстанции среднего мозга) в качестве конечного продукта превращения тирозина может образовываться дофамин, а адреналин и норадреналин синтезируются в ничтожно малых количествах (вследствие очень низкой активности ферментов, катализирующих дальнейшее превращение дофамина). Синтез катехоламинов в нервных клетках осуществляется в аксонах, после чего они накапливаются в синаптических пузырьках и высвобождаются в результате прихода нервного импульса к пресинаптическим терминалям аксонов (т.е. выступают в роли медиаторов). При этом в постганглионарных симпатических нервных волокнах дофамин (предшественник в синтезе катехоламинов) не накапливается, а быстро превращается в норадреналин, который хранится в синаптических пузырьках; адреналина в этих волокнах образуется значительно меньше, чем норадреналина, вследствие низкой активности метилазы. Гематоэфнцефалический барьер не проницаем для катехоламинов, в результате чего катехоламины крови не могут оказывать влияние на нейроны ЦНС (это влияние оказывают в строго определенных синапсах только собственные катехоламины, синтезируемые в аксонах адренергических нейронов, что важно для осуществления высокой точности передачи информации в нервных цепях). Вместе с тем, предшественник катехоламинов – ДОФА – легко проникает через гематоэнцефалический барьер и может усилить образование катехоламинов в адренергических нейронах ЦНС (что, в частности, используют для лечения болезни Паркинсона, сопровождающейся недостаточной продукцией дофамина нейронами черной субстанции). Катехоламины, синтезируемые эндокринными клетками мозгового вещества надпочечников, высвобождаются в межклеточные пространства, откуда поступают в кровь (т.е. являются типичными гормонами). В отличие от постганглионарных симпатических нервных волокон, в эндокринных клетках мозгового вещества надпочечников концентрация и активность метилазы значительно выше, вследствие чего большая часть норадреналина метилируется и превращается в адреналин: его образуется в 4-6 раз больше, чем норадреналина, тогда как дофамин сохраняется в следовых количествах. Регуляция секреции катехоламинов как в мозговом слое надпочечников, так и в нервных клетках осуществляется двумя путями, в зависимости от срока действия регулятора: быстрая или кратковременная регуляция (без изменения количества молекул фермента) и хроническая стимуляция (с образованием и накоплением большого количества молекул определенных ферментов, катализирующих определенные стадии синтеза катехоламинов). Кратковременная регуляция осуществляется главным образом на первом этапе биосинтеза, ограничивающем скорость всего процесса и катализируемым тирозингидроксилазой (существует в двух формах: активной и неактивной). В результате стимуляции со стороны нервной системы, во-первых, возрастает секреция катехоламинов путем экзоцитоза, а во-вторых, увеличивается скорость их биосинтеза из легко доступного тирозина вследствие активации большей части молекул тирозингидроксилазы. Хроническая стимуляция (в течение 12 часов и более) приводит к избирательной индукции тирозингидроксилазы с помощью механизма, обеспечивающего транскрипцию генов и синтез белка; при этом параллельно происходит и менее выраженная индукция синтеза и дофамин-b-гидроксилазы. Стимулом для высвобождения катехоламинов из эндокринных клеток мозгового вещества надпочечников является возбуждение, передаваемое от преганглионарных симпатических волокон, вступающих в непосредственный синаптический контакт с эндокринными клетками, которые являются видоизмененными симпатобластами. Медиатором в передаче сигнала от преганглионарных симпатических нейронов к секреторным клеткам мозгового вещества надпочечников служит ацетилхолин, действующий через посредство Н-холинорецепторов на эндокринные клетки мозгового вещества. Ацетилхолин путем деполяризации мембраны секреторной клетки и связанного с этим повышения концентрации кальция в ней вызывает активацию в секреторных клетках мозгового вещества надпочечников тирозингидроксилазы, катализирующей первый этап биосинтеза катехоламинов (превращение тирозина в ДОФА), а также ускоряет движение хромаффинных гранул к поверхности клетки и их опорожнение. Благодаря непосредственной нервной регуляции секреторной активности мозгового вещества надпочечников, они могут отвечать усилением синтеза и секреции катехоламинов на многие стрессовые воздействия (боль, эмоциональные раздражители, гипоксию, гипотонию, мышечную нагрузку, охлаждение), что позволяет катехоламинам, секретируемым надпочечниками, наряду с активацией симпатического отдела вегетативной нервной системы, обеспечить быструю неспецифическую (т.е. не зависящую от природы стрессового фактора) мобилизацию всех сил и ресурсов организма, что обуславливает повышение его резистентности и выживание в условиях действия стрессового фактора. Вместе с тем, симпатическая нервная система и мозговой слой надпочечников не всегда реагируют параллельно: каждый вид стресса имеет свои особенности. Так, симпатический отдел вегетативной нервной системы играет особо важную роль в реакциях на охлаждение, физическую нагрузку и ортостатическую гипотензию, тогда как секрецию адреналина мозговым веществом надпочечников усиливают тревожные состояния или психические нагрузки, а также гипоксия и гипогликемия. Более того, при голодании, сопровождающемся гипогликемией, секреторная активность мозгового вещества надпочечников возрастает, а активность симпатической нервной системы (которая в основном определяет термогенез) снижается, что обусловлено тем, что адреналин, продуцируемый преимущественно надпочечниками, способствует поддержанию уровня глюкозы в крови, а снижение тонического термогенного влияния со стороны симпатического отдела сохраняет необходимые калории. Следовательно, нервная система организована таким образом, что отдельные компоненты ее симпатического отдела (в том числе и те, что ответственны за регуляцию эндокринных клеток мозгового вещества надпочечников) могут включаться и вместе (как единое целое), и порознь в любой нужной комбинации. Катехоламины являются первой линией защиты при стрессе, тогда как другие гормоны, принимающие участие в развитии стрессовых реакций (глюкокортикоиды, ренин-ангиотензиновая система, альдостерон, АДГ), обеспечивают большую длительность защитной реакции.
Рис. Регуляция биосинтеза катехоламинов
Наряду с нервными, существуют и гуморальные пути регуляции секреторной активности эндокринных клеток мозгового вещества надпочечников. Так, синтез и секреция катехоламинов могут возрастать под действием инсулина, глюкокортикоидов, а также при гипогликемии. При этом глюкокортикоиды, секретируемые корковым веществом надпочечников, с током венозной крови доставляются в мозговое вещество, где непосредственно могут стимулировать продукцию адреналина хромаффинными клетками (путем активации метилазы). Сами же катехоламины выступают в качестве подавляющего свой синтез и секрецию фактора. В частности, адреналин является мощным ингибитором метилазы, катализирующей превращение норадреналина в адреналин. Кроме того, адреналин и норадреналин, активируя аденилатциклазу адренергических нейронов и секреторных клеток мозгового вещества надпочечников, обуславливают повышение уровня цАМФ в них; цАМФзависимое же фосфорилирование тирозингидроксилазы сопровождается снижением активности этого "пускового" фермента биосинтеза катехоламинов. Катехоламины могут регулировать и собственное высвобождение из пресинаптических терминалей нейронов. Так, действуя через пресинаптические a2-адренорецепторы, катехоламины, высвобождаемые при активации синапса, оказывают ингибирующее влияние на свою дальнейшую секрецию. Аутоингибирование секреции свойственно всем катехоламинам и обнаружено во всех тканях, секретирующих их в качестве гормонов или нейромедиаторов. В отличие от холинергических синапсов, в синаптической щели которых присутствует холинэстераза, расщепляющая ацетилхолин, в адренергических синапсах нет ферментов, разрушающих катехоламины, и их удаление из синаптической щели осуществляется либо путем обратного захвата медиатора пресинаптическим нервным окончанием (которое происходит путем активного транспорта с большой скоростью и высокой избирательностью, около 80% катехоламинов, действующих в синапсе, инактивируются таким путем), либо путем захвата и инактивации постсинаптическими клетками (около 20% катехоламинов, выступающих в роли медиаторов в нервной системе, инактивируются таким путем). Поступающие из синаптической щели в нервное окончание катехоламины вновь концентрируются в хромаффинных везикулах и могут повторно участвовать в синаптической передаче. Ингибиторы же обратного захвата катехоламинов пресинаптическими терминалями (таковым, к примеру, является резерпин, к тому же стимулирующий генерализованное высвобождение катехоламинов из депо, что вместе с ингибированием обратного захвата катехоламинов, приводит к опустошению катехоламиновых резервов) вызывают эффекты, подобные симпатической денервации. Определенное количество катехоламинов, высвобождаемых пресинаптическими терминалями адренергических нейронов, не успевает подвергнуться обратному захвату и диффундирует из синапсов в межклеточные пространства, а затем в кровь (т.е. норадреналин, выступающий в роли нейромедиатора, частично переходит в кровь и оказывает влияние на ткани-мишени подобно гормонам). Именно этим, по-видимому, объясняется тот факт, что содержание норадреналина в крови выше такового адреналина, несмотря на то, что мозговое вещество надпочечников секретирует в 4-6 раз больше адреналина, чем норадреналина. Таким образом, мозговое вещество надпочечников секретирует в кровь преимущественно адреналин, тогда как норадреналин крови имеет преимущественно синаптическое происхождение. Общее содержание катехоламинов в крови человека составляет 1,5-2,5 мкг (концентрация адреналина в плазме крови – 0,05 нг/мл, а норадреналина – 0,2 нг/мл) и при стрессе повышается в 4-8 раз. Полупериод жизни катехоламинов в крови равен 1-3 минуты (по некоторым данным – до 20 с). Катехоламины инактивируются в тканях-мишенях, печени и почках под действием ферментов моноаминоксидазы (содержится в митохондриях, вызывает окислительное дезаминирование катехоламинов) и катехол-О-метилтрансферазы (присутствует в цитоплазме, катализирует оксиметилирование катехольного кольца), после чего утрачивают биологическую активность и экскретируются в составе мочи (большая часть) и кала. Небольшое количество катехоламинов экскретируется в виде сульфопроизводных и глюкуронидов.
Транспорт гормонов в секреторных клетках и кровью. Белково-пептидные гормоны и производные аминокислот обладают гидрофильностью и в процессе синтеза заключаются в специальные мембранные везикулы, с помощью которых экскретируются из клеток путем эндоцитоза и могут депонироваться в секреторной клетке. Кроме того, мембранные везикулы защищают гормоны от инактивации под действием цитозольных ферментов. Но главный выигрыш, который обеспечивает такой способ запасания гормона, – это возможность быстрого выброса большого количества молекул гормона в кровь, тогда как воздействие регуляторных сигналов на биосинтез этих гормонов (особенно белково-пептидных) приведет к изменению их уровня в крови лишь через несколько часов, поскольку их синтез и транспорт к плазматической мембране секреторной клетки занимает 1-3 часа. Влияние же регулирующих факторов на секрецию гормонов, синтезированных "впрок" и запасенных в специальных гранулах, позволяет повышать их концентрацию в крови в несколько раз за секунды или минуты. Экзоцитоз содержимого гранул большинства секреторных клеток происходит с обязательным участием кальция. Так, например, в отсутствии кальция ацетилхолин (медиатор преганглионарных симпатических волокон, иннервирующих секреторные клетки мозгового вещества надпочечников) вызывает деполяризацию секреторных клеток, но при этом секреции катехоламинов не происходит. Участие кальция в процессе экзоцитоза содержимого секреторных гранул состоит в следующем. В мембрану нервных и эндокринных клеток встроены актомиозиноподобные белки, которые при связывании кальция активируются и начинают взаимодействовать с определенными белками секреторных везикул. Отмеченное приводит, с одной стороны, к подтягиванию пузырька на "критическое" расстояние к плазматической мембране (такое расстояние, при котором мембрана пузырька встраивается в плазматическую), а с другой – к повышению гидростатического давления внутри пузырька вследствие его скольжения в направлении плазматической мембраны и связанной с этим скольжением деформации, что облегчает разрыв секреторных везикул и выброс их содержимого в межклеточные пространства. Повышение концентрации кальция внутри секреторных клеток, которое инициирует экзоцитоз большого количества секреторных везикул, может осуществляться под влиянием регулирующих факторов разными путями. Так, глюкоза, взаимодействуя с глюкорецепторами b-клеток островков Лангерганса, вызывает деполяризацию их мембраны, что обуславливает повышение внутриклеточной концентрации кальция и, как следствие, опустошение в межклеточные пространства большого количества секреторных гранул, содержащих инсулин. Вторым фактором, способным повлиять на секрецию инсулина b-клетками, служит глюкагон, вырабатываемый a-клетками островков Лангерганса. Но, в отличие от глюкозы, глюкагон стимулирует повышение концентрации кальция в b-клетках и связанный с этим выброс инсулина цАМФ-зависимым путем, не изменяя при этом мембранный потенциал секреторных клеток. В частности, в результате взаимодействия глюкагона с рецептором, встроенным в плазматическую мембрану b-клеток, активируется мембранносвязанный фермент аденилатциклаза, катализирующий образование цАМФ. Повышение уровня цАМФ в клетках приводит к цАМФзависимому фосфорилированию мембран, в результате чего временно повышается их проницаемость для кальция. Повышение же внутриклеточной концентрации кальция инициирует секрецию инсулина из клетки. цАМФ облегчает также секрецию инсулина, стимулируемую глюкозой. Наряду с актомиозиноподобными белками мембран секреторных клеток определенную роль в процессах секреции гормонов играют белки цитоскелета. Так, митотические яды (колхицин, винбластин, цитохлозин В), вызывающие разрушение микротрубочек и микрофиламентов, тормозят секрецию катехоламинов клетками мозгового вещества надпочечников, тироксина тироцитами щитовидной железы, гистамина тучными клетками, инсулина b-клетками островков Лангерганса. Между тем, состояние белков цитоскелета (процессы полимеризации-деполимеризации тубулина, формирующего микротрубочки) находиться под контролем кальция и циклических нуклеотидов. Таким образом, повышение внутриклеточной концентрации кальция является необходимым для транспорта секреторных везикул к плазматической мембране эндокринных клеток. Стероидные гормоны, благодаря своей липофильности, не накапливаются в эндокринных клетках, а легко проходят через мембрану в межклеточные пространства и кровь, вследствие чего регуляция их содержания в крови осуществляется путем изменения скорости биосинтеза. Тиреоидные гормоны, будучи ковалентно связанными с тиреоглобулином, экскретируются из тиреоцитов только после протеолиза тиреоглобулина в фаголизосомах тиреоцитов. Экскреция тиреоидных гормонов осуществляется путем экзоцитоза содержимого фаголизосом. Регуляция содержания тиреоидных гормонов в крови реализуется путем ускорения процессов йодирования тиреоглобулина и последующего протеолиза. После поступления гормонов в кровь они связываются с "транспортными" белками, защищающими гормоны от разрушения и экскреции. В связанной форме гормон с током крови переносится от места секреции к клеткам-мишеням. При этом рецепторы клеток мишеней к гормону проявляют гораздо большее сродство, чем транспортирующие его белки, в связи с чем молекула гормона может отсоединяться от транспортного белка и присоединяться к рецептору (т.е. гормон из химически связанного состояния переходит в свободное, после чего взаимодействует с рецептором). Связывание большей части молекул гормонов с белками крови приводит к созданию некого буфера гормонов в крови, который не оказывает своего действия на клетки-мишени до тех пор, пока гормоны из него не высвободятся. Такой буфер гормонов, с одной стороны, защищает организм от избыточного их влияния, а с другой – делает возможным быструю доставку нужных гормонов к тканям-мишеням в случае повышения потребности в них. Как правило, лишь 5-10% молекул гормонов находятся в крови в свободном состоянии. Эти свободные молекулы гормонов могут взаимодействовать со специфическими рецепторами. Однако, как только они свяжутся с рецепторами, равновесие в реакции взаимодействия соответствующего гормона с транспортными белками сдвинется в сторону распада комплекса, и концентрация свободных молекул гормона быстро нормализуется. Взаимодействие гормонов с белками плазмы крови зависит от их сродства друг к другу, а количество связанных молекул гормона – от концентрации связывающих его белков в плазме крови. Константа связывания гормонов специфическими гормонсвязывающими белками (например, для глюкокортикоидов таким белком является транскортин, для тироксина – тироксинсвязывающий глобулин и тироксинсвязывающий преальбумин, для половых гормонов – тестостерон-эстрогенсвязывающий глобулин) очень высока (составляет 107-109 М< Дата добавления: 2015-02-06 | Просмотры: 2500 | Нарушение авторских прав |