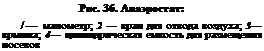|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Классификация питательных сред и способы их приготовленияПитательные среды классифицируют в зависимости от исходных компонентов, консистенции, целевого назначения, химического состава. В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред. Среды неопределенного химического состава. Их подразделяют на: 1) среды животного происхождения (исходные продукты — мясо, рыба, яйца, молоко и т.д.); 2) среды растительного происхождения (исходные продукты — соя, горох, картофель, морковь и т.д.). Некоторые продукты используют в натуральном виде (картофель, морковь, молоко и т. д.), но чаще животные и растительные ткани подвергают различной обработке (экстрагированию, ферментативному или кислотному гидролизу). Среды известного химического состава (синтетические). В них входят известные химические соединения (соли, углеводы, аминокислоты, витамины и т. д.) в оптимальном количественном соотношении. Синтетические питательные среды используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединении. По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие. Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы исходных продуктов. Полужидкие и плотные питательные среды. Необходимую консистенцию среде придают добавлением различных уплотнителей. Агар-агар (малайское желе) — полисахарид, продукт переработки некоторых морских водорослей. Плавится при 80...86 ºС, затвердевает при 40 ºС. Для получения плотных сред его добавляют в количестве 1,5...2%, реже 3 %; полужидких — 0,3...0,7%. Желатина — экстракт из тканей, содержащих много коллагена (кости, хрящи, сухожилия и т.д.). Желатиновый гель плавится при 25 °С, что делает его неудобным для выращивания микроорганизмов с температурным оптимумом 37...38 °С. Кроме того, ряд бактерий выделяют протеолитические ферменты, разлагающие желатину. Обычно в питательные среды вносят 10...20 % желатины. По целевому назначению различают общеупотребительные (основные), обогащенные, специальные, элективные (избирательные) и дифференциально-диагностические питательные среды. Общеупотребительные (основные) среды. Их применяют для культивирования относительно неприхотливых микроорганизмов. В качестве исходных компонентов для приготовления основных сред используют наиболее часто мясную воду, перевар Хоттингера, растительные гидролизаты. Мясная вода: говядину освобождают от костей, жира, сухожилий, пропускают через мясорубку. Мясной фарш заливают водопроводной водой в соотношении 1: 2, кипятят 1 ч. После кипячения мясную воду охлаждают, фильтруют через ватно-мар-левый фильтр, затем доливают водопроводной водой до первоначального объема, разливают по емкостям, закрывают ватно-мар-левыми пробками и стерилизуют при 120 °С 20 мин. Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия мелко нарезают, заливают кипящей водой в соотношении 1:2, кипятят, охлаждают до 45 °С и добавляют панкреатин, подщелачивают раствором карбоната натрия до рН 7,8...8,0, встряхивают и добавляют хлороформ (10 мл/л), плотно закрывают, выдерживают в теплом месте 10 дней, получают продукт гидролиза (перевар). Мясо-пептонный бульон (МПБ). К 1 л мясной воды добавляют 1 % пептона[1] и 0,5 % хлорида натрия, устанавли-
Рис. 32. Приготовление скошенного агара
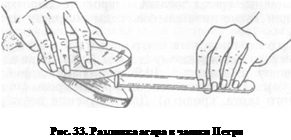
вают необходимый рН дробным добавлением 10%-го раствора гидроксида натрия или гидроксида калия. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют при 120 "С 15...20 мин. Мясо-пептонный агар (МПА): к МПБ добавляют 2...3 % промытого мелко нарезанного агар-агара, нагревают до расплавления агара, доводят до кипения, в горячем виде проверяют рН, затем, если необходимо, доводят его до нужного значения (7,2...7,6), фильтруют через ватно-марлевый фильтр. Профильтрованный горячий агар разливают по пробиркам и колбам, стерилизуют автоклавированием при 1 атм 20...30 мин. Чтобы получить скошенную поверхность агара, удобную для посева, после стерилизации пробирки с расплавленным МПА оставляют при комнатной температуре до уплотнения в наклонном положении (конец с пробкой приподнят) (рис. 32). Широко используют культивирование микроорганизмов на плотных питательных средах в чашках Петри. Диаметр стандартной чашки Петри (рис. 33) около 10 см, выпускают чашки меньшего и большего диаметров, а также одноразовые пластиковые. В
стандартные стерильные чашки Петри над пламенем горелки наливают около 20 мл расплавленного и охлажденного до 45...50 "С питательного агара, чашки помещают на горизонтальную поверхность до застывания агара. Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25 % агара. Кипятят при помешивании до полного расплавления агара, устанавливают рН 7,2...7,6, фильтруют в горячем виде, стерилизуют в автоклаве. Мясо-пептонная желатина (МПЖ): к МПБ добавляют 10...20% измельченной желатины, нагревают до расплавления уплотнителя, устанавливают рН 7,2...7,4, кипятят, фильтруют через ватно-марлевый фильтр, разливают по пробиркам и стерилизуют дробно в аппарате Коха три дня по 20 мин или однократно в автоклаве при 112°С 15 мин. Бульон Хоттингера: основной перевар Хоттингера разводят водопроводной водой в соотношении 1:5 (1:8) до содержания аминного азота 120 мг%, добавляют 0,5% хлорида натрия, 0,1 г гидрофосфата калия, устанавливают рН 7,4...7,6, кипятят 15...20 мин, фильтруют через ватно-марлевый или бумажный фильтр, разливают по емкостям и стерилизуют при 120 °С 20...30 мин. Агар Хоттингера готовят, добавляя к бульону Хоттингера 2 % агар-агара. Предприятия биологической промышленности выпускают готовые питательные бульон и агар в виде сухого порошка. Питательный бульон содержит (г/л): триптический гидролизат кильки — 10,05, хлорид натрия — 4,95. Навеску порошка массой 15 г растворяют в 1 л дистиллированной воды, кипятят 2 мин, фильтруют через бумажный фильтр, разливают по емкостям и стерилизуют в автоклаве при 120 ºС 20 мин (рН 7,3). Питательный агар содержит (г/л): ферментативный гидролизат кормовых дрожжей — 12,0; агар— 12,5; хлорид натрия — 5,5. Навеску порошка массой 36 г растворяют в 1 л дистиллированной воды, кипятят 3 мин, фильтруют через ватный фильтр, стерилизуют при 120 "С 20 мин (рН 7,3). Обогащенные среды. Многие виды болезнетворных бактерий плохо растут на общеупотребительных питательных средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т. д. Такие питательные среды получили название обогащенных. Сывороточный и кровяной агары: к расплавленному и охлажденному до 45...50°С стерильному питательному агару добавляют 5...10% стерильной дефибринирован-ной крови барана (кролика) или сыворотки крови (лошади, крупного рогатого скота, кролика). Для получения дефибринирован-ной крови у барана кровь берут асептично из яремной вены стерильной иглой в стерильный флакон (или колбочку) со стеклянными (фарфоровыми) бусами или шариками, встряхивают вращательными движениями 15...20 мин, чтобы предотвратить свертывание крови. Фибрин остается на бусах. Компоненты перемешивают, разливают в чашки Петри, пробирки и оставляют до застывания питательной среды. Сывороточный и кровяной бульоны готовят аналогичным образом. Растворы углеводов (глюкоза и др.) стерилизуют текучим паром или фильтрованием и добавляют в количестве 0,5... 1 % к питательной среде. Специальные среды. Так называют среды, разработанные с учетом специфических ростовых потребностей ряда бактерий. Например, желточная среда Мак-Коя для возбудителя туляремии, среда Терских для культивирования лептоспир и др. Среда Мак-Коя: чистые куриные яйца обрабатывают спиртом, быстро проводят через пламя горелки. Стерильно вскрывают, желтки отделяют от белков. К 60 частям желтков добавляют 40 частей физиологического раствора (рН 7,0...7,2). Компоненты перемешивают, разливают в пробирки по 4...5 мл и помещают в наклонном положении в аппарат для свертывания сыворотки. Стерилизуют в первый день при 75 °С 1 ч, на второй день при 85 °С 30 мин. Для контроля стерильности приготовленные среды выдерживают 2 сут в термостате при 37...38 °С. Среда Терских состоит из фосфатной смеси Зеренсе-на и кроличьей сыворотки. Смесь Зеренсена: раствор А: гидрофосфат натрия — 11,876 г, вода дистиллированная — 1000 мл; раствор Б: дигидрофосфат калия — 9,078 г, вода дистиллированная — 1000 мл. К 90 мл раствора А добавляют 10 мл раствора Б и доводят объем дистиллированной водой до 1000 мл. Раствор разливают в пробирки по 5 мл, стерилизуют при 1,5 атм 20 мин. В каждую пробирку добавляют шесть—восемь капель стерильной инактивированной при 56 °С сыворотки кролика. Элективные среды (лат. electus — избранный). Это питательные цель увеличить количество искомого микроорганизма в смешанной популяции. Молочно-солевой агар предназначен для избирательного культивирования стафилококков. К расплавленному МПА с рН 7,2...7,4, содержащему 5...7,5 % хлорида натрия, добавляют 10 % стерильного обезжиренного молока, перемешивают и разливают в чашки Петри. Среда Шустовой предназначена для выделения сальмонелл. Представляет собой МПА (рН 7,4) с добавлением 10 % к объему среды 50%-го водного раствора тиосульфата натрия и 2 % раствора Люголя. Среда Раппопорт предназначена для культивирования сальмонелл. К МПБ добавляют 1 % глюкозы, 10 % желчи, 1 % индикатора Андрэдэ. Стерилизуют текучим паром. Среда Мюллера предназначена для культивирования сальмонелл. В колбу с 4,5 г стерильного мела наливают 90 мл МПБ, стерилизуют в автоклаве при 120 "С 30 мин. Затем стерильно добавляют 2 мл раствора Люголя и 10 мл раствора тиосульфата натрия (тиосульфат натрия — 50 г, дистиллированная вода — 100 мл), стерилизуют в аппарате Коха 30 мин. Среда Кауфмана — это среда обогащения для сальмонелл. К 100 мл среды Мюллера добавляют 1 мл водного раствора бриллиантового зеленого, разведенного 1: 1000, и 5 мл стерильной бычьей желчи. Смесь стерилизуют текучим паром 30 мин. Казеиново-угольный агар (КУА) с пенициллином используют для культивирования бордетелл. К 1000 мл дистиллированной воды добавляют гидролизат казеина — 20 мл, хлорид натрия — 5 г, хлорид калия — 0,2 г, хлорид кальция — 0,002 г, карбонат натрия — 0,4 г, хлорид магния — 0,025 г, гидрофосфат калия — 0,24 г, растворимый крахмал — 1 г, цистин — 0,01 г, агар —20 г. Компоненты растворяют, устанавливают рН 7,2, стерилизуют при 0,5 атм 30 мин. Перед употреблением в расплавленный агар (50 °С) добавляют 3 % дрожжевого экстракта и 0,2 % сухого активированного угля и 0,5 ЕД/мл пенициллина. Компоненты перемешивают и разливают по чашкам Петри. Дифференциально-диагностические среды. Предназначены для выявления ферментов у микроорганизмов. По консистенции могут быть жидкими, полужидкими, плотными. В состав этих сред входят основная питательная среда, обеспечивающая рост изучаемого микроорганизма, субстрат для обнаружения фермента и индикатор, по изменению цвета которого судят о сдвиге рН среды в результате расщепления субстрата. К питательным средам такого типа относят среды Гисса, Эндо, Плоскирева, Левина и др. Среды Гисса используют для изучения ферментативных свойств выделенных культур микроорганизмов. К 100 мл дистиллированной воды добавляют 1 % пептона, 0,5 г хлорида натрия. Компоненты растворяют, фильтруют через бумажный фильтр, устанавливают рН 7,0...7,4, добавляют один из углеводов-субстратов (лактоза, глюкоза и т.д.), агар-агар (0,3...0,4 %), а затем 1мл индикатора Андрэдэ или 0,1мл 1,6%-го раствора бромтимолового синего. Готовую среду разливают по 3 мл в пробирки, стерилизуют текучим паром три дня подряд по 30 мин или при 112 °С 20 мин. Выпускают сухие среды Гисса с индикатором BP — смесь водно-голубого с розоловой кислотой (готовые среды — полужидкой консистенции). Плотные дифференциально-диагностические среды применяют для первичной изоляции возбудителей из материала. В их состав нередко кроме известного субстрата входят вещества, придающие питательной среде селективные свойства. Среда Эндо содержит лактозу в качестве субстрата и предназначена для дифференциации бактерий, различающихся по способности расщеплять лактозу. К 1000 мл расплавленного МПА (рН 7,4) температурой 70 °С добавляют 1 г лактозы, предварительно растворенной в небольшом количестве дистиллированной кипяченой воды. В отдельных пробирках готовят: 2...3 мл спиртового раствора основного фуксина; 10 мл 10%-го водного раствора сульфата натрия. В стерильную пробирку вносят 1 мл раствора фуксина и добавляют раствор сульфита натрия до обесцвечивания фуксина. Приготовленную смесь вливают в расплавленный агар, перемешивают и разливают по чашкам Петри. Готовая среда бесцветна, при росте на ней микроорганизмов, расщепляющих лактозу, среда закисляется, обесцвеченный фуксин восстанавливается, и колония микроорганизма, например эшерихий, приобретает красный цвет с металлическим оттенком. Среду готовят за сутки до ее использования. Выпускают также сухую среду Эндо. Перед употреблением определенную навеску порошка вносят в дистиллированную воду, кипятят и разливают по чашкам Петри. Среда Левина аналогична по целевому назначению среде Эндо, но содержит другой индикатор (эозин с метилено-вым синим). К 100 мл расплавленного МПА (рН 7,2...7,4) добавляют 2 мл 0,5%-го водного раствора метиленового синего, 1,5 мл 2%-го раствора эозина желтого, 2 г лактозы, 0,2 г дигидрофосфата калия. Растворы красителей готовят на дистиллированной воде, стерилизуют текучим паром 60 мин. Лактозу и дигидрофос-фат калия предварительно разводят в небольшом количестве стерильной дистиллированной воды и кипятят. Колонии лактозопо-зитивных бактерий на этой среде окрашены в фиолетово-черный цвет. Агар Плоскирева предназначен для выделения сальмонелл, содержит лактозу в качестве субстрата и компоненты, подавляющие рост сопутствующей микрофлоры. Среду выпускают в виде порошка, в ее состав кроме питательной агаровой основы входят: желчные соли, цитрат натрия, тиосульфат натрия, фосфат натрия, бриллиантовый зеленый, кальцинированная сода, йод, хлорид натрия, лактоза, нейтральный красный. Навеску порошка растворяют в воде, кипятят и разливают в чашки Петри. Готовая среда прозрачная или розоватая. Колонии сальмонелл бесцветные, эшерихий — брусничного цвета.
Методы культивирования микроорганизмов. Наряду с общими принципами культивирование микроорганизмов различных физиологических групп имеет некоторые особенности Культивирование аэробных и факультативно-анаэробных бактерий. Плотные, жидкие или полужидкие питательные среды, засеянные чистыми культурами микроорганизмов или исследуемым материалом, помещают в термостаты (рис. 34), поддерживающие оптимальную для данного микроорганизма температуру. При температурах, превышающих верхнюю границу нормы, бактерии не только замедляют рост, но и быстро гибнут. При температуре ниже оптимальной скорость роста микроорганизма постепенно замедляется.
У мезофилов температурный оптимум находится в интервале 30...37 ºС, у психрофилов — 10... 15 ºС, у термофилов — 50...60 ºС. Микроорганизмы в процессе культивирования на питательных средах при условии, что в среды не вносят дополнительные вещества, постепенно замедляют и затем прекращают свой рост из-за истощения питательного субстрата, изменения оптимальных значений биофизических показателей (рН, Eh и т.д.). Такое культивирование микроорганизмов называют периодическим. Если при этом жидкую питательную среду в процессе инкубирования посевов не перемешивают, то такой способ культивирования определяют как стационарный. При диагностических бактериологических исследованиях обычно используют именно такой способ культивирования. В биологической промышленности при производстве вакцин и других биопрепаратов, когда необходимо достичь максимального выхода бактериальной массы или экзотоксинов, применяют периодическое культивирование в жидких средах с их интенсивным перемешиванием. При таких задачах аэробные бактерии культивируют в колбах, бутылях на шюттель-аппаратах с частотой колебания 150... 250 мин-1, что облегчает передачу бактериям кислорода и питательных компонентов.
Рис. 35. Схема ферментера для глубинного культивирования аэробных микроорганизмов. 1 – вход воздуха; 2 – выход воздуха; 3 – отбойники; 4 – мешалка; 5 - барботер
Наиболее эффективное культивирование бактерий в жидких питательных средах с максимальным выходом биопродукта достигают в ферментерах. Ферментеры (реакторы) представляют собой металлические или стеклянные культуральные сосуды емкостью от 500 мл до 1000 л (рис. 35). При культивировании бактерий в ферментерах среду перемешивают Культивирование анаэробных бактерий. Облигатные анаэробы — бактерии, у которых энергетический и конструктивный метаболизм происходит без молекулярного кислорода 02. У таких микроорганизмов в процессе дыхания конечными акцепторами электронов являются окись углерода (IV), ионы сульфата, фумарат и др. Кроме того, молекулярный кислород действует на многие анаэробы губительно. Например, строгие анаэробы погибают при незначительных концентрациях кислорода (бактероиды, фузобак-терии), умеренные анаэробы менее чувствительны (С. perfringens), аэротолерантные анаэробы могут расти в условиях обычной атмосферы (молочнокислые бактерии). Большинство болезнетворных анаэробов относят к строгим или умеренным анаэробам. Для их культивирования используют специальные питательные среды и газовые смеси. Последними наполняют анаэростаты. Необходимое условие роста облигатных анаэробов — не столько отсутствие молекулярного кислорода, сколько низкий ОКВП питательных сред. Резко восстановительных условий достигают, добавляя в среды редуцирующие (восстанавливающие) вещества и одновременно удаляя из них молекулярный кислород. В качестве редуцирующих веществ в питательные среды добавляют химические соединения, приведенные в таблице 1.
1. Восстанавливающие вещества для культивирования анаэробов
С этой же целью в питательные среды вносят вареные кусочки печени, мышц, мозга, кровяные сгустки, куриный яичный белок, зерна ржи. Считают, что в этих тканях сильное редуцирующее действие оказывают вещества, богатые SH-группами. Для создания условий анаэробиоза питательные среды максимально освобождают от кислорода путем кипячения, а также пропуская через жидкие среды инертные газы или наслаивая на поверхность питательной среды вазелиновое масло для предотвращения контакта с кислородом воздуха. Мясо-пептонный печеночный бульон (МППБ) Китта—Тароцци — традиционная среда для культивирования анаэробов. Ее основой служит печеночная вода, которую готовят путем кипячения в воде мелких кусочков говяжьей печени (соотношение 1:1). Печеночную воду смешивают с МПБ в соотношении 1:2, смесь кипятят, устанавливают необходимый рН и разливают в пробирки по 10 мл. В пробирки добавляют кусочки вареной печени (восстановитель) и затем вносят по 2 мл вазелинового масла. Автоклавируют при 0,5 атм 20 мин. Перед употреблением пробирки со средой кипятят в водяной бане, затем охлаждают и только после этого проводят посев. Для выращивания анаэробов используют также питательные среды с повышенной вязкостью, поскольку диффузия кислорода в них затруднена. Полужидкий агар: к МПБ добавляют 0,25...0,75 % агара, 1 % глюкозы, устанавливают рН 7,4, разливают в пробирки высоким столбиком и дробно стерилизуют. Практикуют культивирование анаэробов в толще плотных сред. Сахарный агар в трубках Вейона: к 2%-му МПА добавляют 1 % глюкозы, устанавливают рН 7,4. Посевной материал вносят в расплавленную и охлажденную до 48...50 "С среду, перемешивают и разливают по стерильным узким стеклянным трубкам — трубкам Вейона (длина 20...25 см, диаметр 1...1,5 см). Концы трубок закрыты стерильными резиновыми пробками. Колонии анаэробов вырастают в толще питательной среды. Широко применяют культивирование анаэробов на поверхности плотных питательных сред в чашках Петри. Из числа плотных сред для культивирования анаэробов довольно часто используют кровяной агар с глюкозой и железо-сульфитный агар. Глюкозо-кровяной агар: к 3%-му МПА (рН 7,2...7,4), расплавленному и охлажденному до 50°С, добавляют 1...2% стерильного раствора глюкозы, 15...20% дефибриниро-ванной крови барана и разливают по чашкам Петри. Железо-сульфитный агар (среда Вильсон—Блера): к 100 мл 3%-го МПА (рН 7,4) с 1 % глюкозы при температуре 60 °С добавляют 10 мл 20%-го раствора сульфита натрия и 1мл 8%-го раствора хлорида железа, затем среду разливают по чашкам Петри. Анаэробы при росте на этой среде восстанавливают сульфит натрия до сульфата натрия, который реагирует с хлоридом железа, образуя черный осадок сульфита железа; колонии бактерий окрашены в черный цвет. Для культивирования анаэробов на поверхности плотных питательных сред недостаточно добавления в них восстанавливающих агентов. Культуральные сосуды с посевами помещают в герметические камеры (анаэростаты), в которых тем или иным способом создают анаэробные (бескислородные) условия. Обычный анаэростат представляет собой металлический цилиндр, который герметически закрывает крышка с резиновой прокладкой (рис. 36). На крышке размещены манометр и краны для откачивания воздуха или наполнения анаэростата инертным газом (азот). Воздух откачивают с помощью вакуумного насоса, закручивают вентиль и анаэростат с пробирками или чашками помещают в термостат. Обычное остаточное давление в анаэро-стате около 10 мм рт. ст. Созданы анаэростаты, удаление кислорода из которых происходит за счет его реакции с водородом в
 присутствии катализатора (платиновый, палладиевый). Водород в камеру закачивают из баллона через редуктор. Некоторые анаэробные камеры снабжены нагревательными элементами с терморегулирующим устройством, обеспечивающим автономное поддержание температуры на необходимом уровне. присутствии катализатора (платиновый, палладиевый). Водород в камеру закачивают из баллона через редуктор. Некоторые анаэробные камеры снабжены нагревательными элементами с терморегулирующим устройством, обеспечивающим автономное поддержание температуры на необходимом уровне.
Культивирование микроаэрофильных бактерий. Хотя микроаэрофильные бактерии по типу дыхания аэробы, они растут не в обычной атмосфере (21 % кислорода), а с пониженным содержанием кислорода. Например, Campylobacter fetus растет в атмосфере, содержащей не более 6 % кислорода. Такую атмосферу можно создать в герметичных термостатах, анаэростатах, заменяя часть воздуха сжатым оксидом углерода (IV) из баллона, или в обычном эксикаторе. В последнем случае пробирки с посевами помещают в эксикатор вместе с бюксом, содержащим ватку, смоченную спиртом, или свечу. Вату (свечу) зажигают и закрывают крышку эксикатора. Пламя затухает по мере выгорания кислорода, и снижение его содержания достаточно для роста микроаэрофилов. Наиболее доступен и эффективен способ культивирования микроаэрофилов в полужидкой среде с 0,1...0,4 % агара. В такой среде конвекционные потоки не способны перемешивать верхние, богатые кислородом слои среды с нижними, что создает в среде, заполняющей пробирку, градиент концентрации кислорода. Культуру микроаэрофила засевают уколом, и микроорганизм растет в зоне с оптимальным содержанием кислорода, обычно в виде тонких дисков на расстоянии от нескольких миллиметров до нескольких десятков миллиметров от поверхности среды. Культивирование грибов. Лучший рост грибов отмечен на средах с содержанием углеводов 1...4%. При первичной изоляции для подавления роста различных сопутствующих бактерий в питательные среды часто добавляют антибиотики. Агар Сабуро применяют для культивирования возбудителей дерматомикозов и кандидамикоза. Глюкоза —4 г, пептон — 1 г, агар — 1,8 г, дистиллированная вода — 100 мл. После растворения агара среду фильтруют, разливают по пробиркам и стерилизуют при 0,5 атм 30 мин. После стерилизации рН среды 6,9...7,0. Агар Чапека используют для культивирования грибов многих видов. Глюкоза — 30 г, нитрат натрия — 2 г, дигидрофосфат калия — 1, сульфат магния — 0,5 г, хлорид калия — 0,5 г, сульфат железа —0,0012 г, агар —20 г, дистиллированная вода — 1000 мл. Естественный рН среды 5,6...5,9. Среду стерилизуют при 0,5 атм 30 мин. Сусло-агар предназначен для культивирования возбудителей дерматомикозов и кандидамикоза. Солодовое неохме-ленное сусло разбавляют водопроводной водой в соотношении 1: 2 (до содержания Сахаров 7 %), устанавливают рН 6,5...6,7, добавляют 2 % агара, кипятят, фильтруют, стерилизуют при 0,5 атм 30 мин. Агар Литмана пригоден для культивирования дерматофитов. Пептон — 10 г, глюкоза — 10 г, бычья желчь — 15 г, кристаллвиолет —0,01 г, агар —20 г, дистиллированная вода— 1000 мл. Среду стерилизуют при 1 атм 15 мин. Среда Ван-Итерсона предназначена для выделения из кормов токсичных грибов, вызывающих стахиботриотоксикоз, дендродохиотоксикоз и др. Нитрат аммония — 0,5 г, дигидрофосфат калия — 0,5 г, водопроводная вода — 1000 мл. Среду стерилизуют при 1 атм 30 миц. Затем средой увлажняют стерильные чашки Петри с фильтровальной бумагой. Жидкая среда Чапека. Глюкоза — 30г, нитрат натрия — 2 г, дигидрофосфат калия — 1 г, сульфат магния — 0,5 г, хлорид калия —0,5 г, сульфат железа — 0,001 г, дистиллированная вода — 1000 мл. Среду стерилизуют при 0,5 атм 30 мин. После стерилизации рН среды 5,9...6,2. Жидкую среду можно использовать для увлажнения фильтровальной бумаги в чашках Петри с целью последующего культивирования грибов. Среда Билай предназначена для получения макроконидий грибов. Нитрат калия — 2 г, дигидрофосфат калия — 1 г, сульфат магния —0,5 г, хлорид калия —0,5 г, сульфат железа — следы, крахмал растворимый — 0,1 г, сахароза — 0,1 г, глюкоза — 0,1 г, дистиллированная вода — 1000 мл. Среду разливают по пробиркам по 5 мл и в каждую пробирку вставляют полоску фильтровальной бумаги таким образом, чтобы большая часть ее находилась над раствором. Среду стерилизуют при 1 атм 20 мин. Глюкозный бульон Сабуро используют для культивирования грибов многих видов. Глюкоза — 40 г, пептон — Юг, дистиллированная вода— 1000мл. Нагревают до кипения, разливают по пробиркам и стерилизуют при 1 атм 15 мин. Культивирование на волосах по Ван-брейзегему применяют при выделении дерматофитов. Здоровые стерильные волосы прикрепляют коллодием к стеклянной трубочке. На середину волос наносят культуру гриба. Трубочку помещают в цилиндр, на дно которого для влажности наливают небольшое количество воды. Культивируют при 25 "С пять—десять дней и более. Для выделения возбудителей гистоплазмоза, эпизоотического лимфангита применяют кровяной агар.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Приготовить скошенный МПА, сывороточный и кровяной 2. Изучить устройство анаэростата и ферментера.
Контрольные вопросы 1.Какие общие требования предъявляют к питательным средам? 2.На какие группы классифицируют питательные среды? Как культивируют анаэробы и микроаэрофилы
Тема 8 Дата добавления: 2014-12-12 | Просмотры: 3286 | Нарушение авторских прав |

 специальными мешалками с одновременной подачей необходимого количества стерильного воздуха. Ферментеры конструируют как автономные системы с автоматической регуляцией температуры и рН среды. В ферментерах также осуществляют непрерывное (проточное) культивирование, при котором в отличие от периодической культуры автоматически в среду подаются свежие питательные компоненты со скоростью, равной удалению аналогичного объема выросшей культуры бактерий. Такое непрерывное культивирование в хорошо отрегулированной системе в принципе можно продолжать неограниченно долго.
специальными мешалками с одновременной подачей необходимого количества стерильного воздуха. Ферментеры конструируют как автономные системы с автоматической регуляцией температуры и рН среды. В ферментерах также осуществляют непрерывное (проточное) культивирование, при котором в отличие от периодической культуры автоматически в среду подаются свежие питательные компоненты со скоростью, равной удалению аналогичного объема выросшей культуры бактерий. Такое непрерывное культивирование в хорошо отрегулированной системе в принципе можно продолжать неограниченно долго.