|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 6 страница
Коли-адгезин-тест: антиадгезивные коли-сыворотки К 88, К 99, 987 Р, А 20, F41. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Изучить морфологические, тинкториальные и культуральные свойства Е. coli. 2. Изучить ферментативные свойства Е. coli. 3. Определить у культур Е. coli адгезивные антигены и О-серогруппы в РА на стекле. Контрольные вопросы 1. Какие дифференциально-диагностические среды применяют для выделения 2. Каковы основные биохимические свойства Е. coli? 3. Как определяют патогенность Е. coli?
Тема 30 ЛАБОРАТОРНАЯ ДИАГНОСТИКА САЛЬМОНЕЛЛЕЗА. БИОПРЕПАРАТЫ Цель занятия. Ознакомить студентов с методами лабораторной диагностики, биологическими свойствами сальмонелл и биопрепаратами, применяемыми при сальмонеллезе. Оборудование и материалы. Культуры сальмонелл на МПА, МПБ, агаре Эндо, агаре Плоскирева, среде Олькеницкого или Ресселя, ПБДЭ-пластинах. Набор сальмонеллезных сывороток О-комплексных и монорецепторных О- и Н-агглютинирующих для экспресс-идентификации сальмонелл в реакции агглютинации на стекле. МЕТОДИЧЕСКИЕ УКАЗАНИЯ Сальмонеллезы. Группы инфекционных заболеваний преимущественно молодняка сельскохозяйственных и промысловых животных (телят, поросят, жеребят, ягнят, пушных зверей, птиц), а также человека. Телята чаще заболевают в возрасте старше двух недель, поросята — от 1 до 4мес. Овцы могут болеть сальмонеллезом с первых дней жизни. У молодняка птиц сальмонеллы вызывают массовую гибель. Бактерии, размножаясь в кишечнике, вызывают воспаление слизистой оболочки, проникают в кровь, развивается септицемия. Характерна следующая клиническая картина: угнетенное состояние животного, высокая температура, диарея. Заболевание беременных животных ведет к абортам и рождению нежизнеспособного потомства. Возможно развитие бронхопневмоний и артритов. Возбудители сальмонеллеза — бактерии рода Salmonella, семейства Enterobacteriaceae. Род Salmonella по ферментативной активности условно подразделяют на подроды (I, II, III, IV, V).
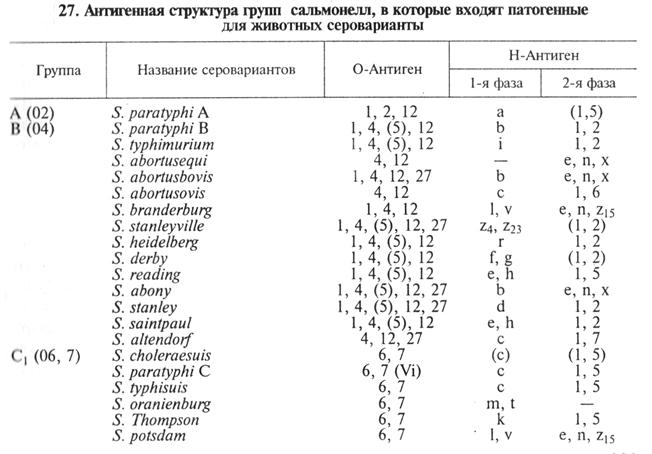
Лабораторная диагностика сальмонеллеза основана на результатах бактериологического и серологического исследований. Бактериологическое исследование включает в себячобнаружение возбудителя в исходном материале методом световой и люминесцентной микроскопии, выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим и патогенным свойствам. Материал для исследования. В лабораторию направляют паренхиматозные органы или их части: печень с желчным пузырем, почку, мезентериальные лимфатические узлы, трубчатую кость, сердце, перевязанное у основания аорты лигатурой. Погибшие в 12... 18-дневном возрасте эмбрионы птиц (до 30 шт.) и павшую птицу (до 10 гол.), абортированные плоды с плодными оболочками и околоплодной жидкостью, а также свежие трупы мелких животных направляют в лабораторию целиком. При подозрении на хроническую форму от телят дополнительно берут измененные участки легких, от кур — измененные фолликулы яичника. Материалом для прижизненной диагностики служат фекалии больных животных. Микроскопия препаратов из исходного материала. Мазки – отпечатки окрашивают по Граму, обрабатывают сальмонеллезными люминесцирующими сыворотками и микроскопируют. Сальмонеллы представляют собой грамотрицательные палочки размером (2...4) х (0,7... 1,5) мкм, располагающиеся одиночно. Спор и капсул не образуют. Подвижные, за исключением S. pullorum. Положительным результатом люминесцентной микроскопии считают свечение типичных для сальмонелл форм не ниже чем па два креста. Выделение и идентификация культуры возбудителя. Сальмонеллы—факультативные анаэробы, температурный оптимум 37...38 °С, рН 7,2...7,4. Исследуемый материал высевают в МПБ, в чашки Петри с МПА и одной из плотных дифференциально - диагностических сред (Эндо, Левина, Плоскирева, висмут-сульфитный агар). При подозрении на хроническое течение сальмонеллеза делают посевы на одну из сред обогащения (селенитовая, Мюллера, Кауфмана, Киллиана). Посевы инкубируют 16...20 ч, после чего просматривают невооруженным глазом, отмечая колонии, характерные для сальмонелл. Сальмонеллы на средах Эндо и Плоскирева формируют прозрачные бесцветные колонии, на среде Левина — голубоватые, на висмут-сульфитном агаре — черные с металлическим блеском, за исключением S. choleraesuis, S. abortusovis, S. gallinarum- pullorum, которые на висмут-сульфитном агаре образуют нежно-зеленые колонии. На мясо-пептонном агаре сальмонеллы растут в виде гладких, прозрачных, бесцветных колоний с ровными краями (рис. 96); в мясо-пептонном бульоне — с диффузным помутнением среды. При отсутствии колоний сальмонелл на МПА, дифференциально-диагностических средах и наличии роста бактерий, похожих на сальмонеллы, в средах обогащения из последних делают высев на плотные среды, чтобы получить изолированные колонии. Из подозрительных колоний делают мазки, окрашивают по Граму и микроскопируют. При обнаружении бактерий, типичных по морфологическим и тинкториальным свойствам для сальмонелл, у них изучают ферментативные свойства.
Рис. 96. Сальмонеллы: а – чистая культура; б - колонии
Подозрительные на сальмонеллы колонии пересевают в пробирки с комбинированными средами Олькеницкого или Ресселя. Среда Олькеницкого: агар питательный сухой — 25 г, лактоза — Юг, аммоний-железо сульфат (соль Мора) — 0,2 г, тиосульфат натрия —0,3 г, мочевина — Юг, 0,4%-й водный раствор фенолового красного — 4 мл, дистиллированная вода— 1000 мл. Соли предварительно растворяют в небольшом объеме дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах воды при подогревании на водяной бане. Сухой питательный агар расплавляют в оставшемся объеме воды при нагревании и помешивании. Затем все компоненты соединяют, перемешивают с расплавленным агаром, фильтруют через марлевый фильтр, устанавливают рН 7,2...7,4, добавляют индикатор и разливают в пробирки по 6...7 мл. Среду стерилизуют текучим паром три дня по 20 мин и скашивают, оставляя столбик среды высотой 2...2,5 см. Готовая среда бледно-розового цвета. Среда Ресселя: к 100 мл 1,5%-го мясо-пептонного агара (рН 7,2) прибавляют 1 % лактозы, 0,1 % глюкозы и 1 мл индикатора Андреде, среду разливают в пробирки по 5...6 мл, стерилизуют в автоклаве при 112 °С 20 мин и скашивают, оставляя столбик среды высотой 2...Зсм. Готовая среда бледно-розового цвета. В состав сухой среды Ресселя входит сухой питательный агар, индикатор BP, лактоза и глюкоза. Приготовленную среду разливают в стерильные пробирки и стерилизуют текучим паром два раза по 30 мин. Среду скашивают, оставляя столбик 2...2,5 см. Готовая среда фиолетового или розовато-серого цвета. Посевы инкубируют в термостате при 37 °С 18...20 ч. Учет биохимических свойств сальмонелл на указанных средах — визуальный, по изменению цвета среды. На среде Олькеницкого появление желтой окраски в скошенной части агара характеризует ферментацию лактозы и сахарозы; в столбике — глюкозы. Газообразование устанавливают по появлению пузырьков, разрывам агара или его отслоению от стенок пробирки. Об образовании сероводорода судят по почернению среды. При росте культуры, гидролизующей мочевину, среда Олькеницкого приобретает красно-малиновый цвет. На среде Ресселя определяют ферментацию глюкозы в столбике по изменению окраски и лактозы в скошенной части. Цвет среды меняется в зависимости от индикатора, входящего в состав среды: индикатор Андреде дает малиновую окраску, а индикатор BP — синюю. Газообразование устанавливают также по появлению пузырьков и разрывам агара. Для дальнейшего исследования отбирают культуры, не утилизирующие мочевину, ферментирующие глюкозу, не разлагающие сахарозу и лактозу, образующие сероводород. Такие культуры пересевают со среды Олькеницкого в среду Гисса с маннитом, в полужид кий агар для определения подвижности и ставят пробу на индол. Дополнительно делают пересев на МПА, чтобы накопить чистую культуру возбудителя для постановки реакции агглютинации. При выделении культур с ферментативными свойствами, характерными для представителей рода сальмонелл (ферментируют глюкозу, маннит, не утилизируют лактозу, сахарозу, не расщепляют мочевину, не образуют индол, не разжижают желатину, растут на агаре Симмонса, т. е. усваивают цитратно-аммонийные соли), проводят их серологическую идентификацию. Антигенную структуру сальмонелл выявляют с помощью наборов сальмонеллезных О-комплексных и монорецепторных О- и Н-агглютинирующих сывороток в РА на стекле. Сыворотки выпускают наборами № 1 и № 2 в двух коробках (табл. 28).
Исследуемую культуру выращивают на скошенном мясо-пептонном агаре при 37...38 °С в течение 18...24 ч. Первоначально культуру испытывают с О-комплексными сыворотками. Для этого реакцию агглютинации на стекле ставят с каждой О-комплексной сывороткой, начиная с первой, до получения положительной реакции с двумя сыворотками (табл. 29).
Чтобы определить серотиповую принадлежность, сальмонеллы, отнесенные к определенной серогруппе, исследуют с Н-моносыво-ротками 1-й и 2- фазы. При выборе сывороток для реакции исходят из антигенной структуры сальмонелл той группы, к которой отнесена определяемая культура, с учетом вида животного. Культуры сальмонелл, которые не удалось идентифицировать сыворотками из набора, следует направлять в Государственный институт контроля, стандартизации и сертификации ветеринарных препаратов. Техника постановки РА: из флакона, не захватывая осадка борной кислоты, пастеровской пипеткой набирают сыворотку, одну каплю которой наносят на предметное стекло. Бактериологической петлей в нее вносят 20...24-часовую исследуемую агаровую культуру сальмонелл. Для РА с О-сыворотками культуру берут с верхней части агара, с Н-сыворотками — с нижней, вблизи конденсационной жидкости. Петлю с культурой увлажняют в капле сыворотки, затем культуру тщательно растирают рядом с каплей, смешивают с сывороткой и энергично (6... 10 раз) покачивают стекло круговыми движениями. Агглютинация наступает не позднее 1...2мин. О-Агглютинат выглядит как плотные, с трудом разбивающиеся комочки и зернышки; Н-агглютинат — крупные, рыхлые, легко разбивающиеся хлопья. Агглютинация проявляется в виде склеивания бактериальной массы и полного или частичного просветления жидкости. При отрицательной реакции культура после тщательного смешивания с каплей сыворотки образует гомогенную взвесь. Агглютинирующие адсорбированные О- и Н-сыворотки выпускают согласно серологической классификации бактерий рода сальмонелл наборами и отдельными рецепторами. Кроме монорецепторных О- и Н-сывороток производят поливалентную сальмонеллезную О-сыворотку против сальмонелл основных пяти групп (А, В, С, D, Е). Наборы О- и Н-сывороток выпускают двух видов. Узкий набор состоит из 28 рецепторов. Расширенный набор включает в себя 108 рецепторов. Монорецепторные О- и Н-сыворотки применяют для идентификации бактерий рода Salmonella в реакции агглютинации на предметном стекле, поливалентную — для отбора культур из первичных посевов. Поливалентная сыворотка против сальмонелл основных групп содержит О-агглютинины против антигенов 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 15, 19, 26 и vi. При агглютинации культуры с О-сывороткой определяют ее групповую принадлежность. Затем при помощи Н-сывороток соответствующей группы окончательно устанавливают тип исследуемой культуры. Сухие сыворотки перед употреблением растворяют в стерильном физиологическом растворе из расчета 2 мл на ампулу, что соответствует первоначальному объему сыворотки до высушивания. Растворенные сыворотки используют в реакции агглютинации на стекле. Методика постановки РА на стекле такая же, как и с комплексными сыворотками. Биопроба. Метод применяют в необходимых случаях, например при выделении нетипируемых серологически сальмонелл. Исследуемую культуру вводят подкожно белым мышам по 0,2...0,3 мл при концентрации клеток (0,5... 1) • 108/мл. В положительных случаях животные гибнут в течение З...10 сут. Серологическая диагностика входит в состав лабораторной и заключается в постановке РА. Используют свежие сыворотки от животных или сыворотки, консервированные фенолом (до 0,5%), со сроком их давности не свыше 15 дней. Антиген для реакции агглютинации выбирают в зависимости от вида животного, а именно: сыворотки от крупного рогатого скота исследуют с антигенами S. enteritidis (dublin) и S. typhimurium, от свиней — S. typhisuis или S. choleraesuis и S. typhimurium и т. д. Для постановки реакции агглютинации готовят двукратное разведение исследуемых сывороток карболизированным (0,5%-м) физиологическим раствором, начиная с разведения 1:25 и до 1:3200. Сыворотку берут по 0,5 мл каждого разведения. При массовых исследованиях допускают постановку реакции в четырех разведениях (1:50, 1:100, 1:200, 1:400) с последующей проверкой положительных проб в разведениях сыворотки до 1:3200. Одновременно ставят контроли: 1) с негативной сывороткой в тех же разведениях, что и исследуемые сыворотки; 2) с положительными сыворотками до их предельного титра; 3) антиген с физиологическим раствором без сыворотки. В пробирки вносят по 0,5 мл соответствующего разведения сыворотки. Затем во все пробирки (в том числе и контрольные) добавляют по 0,5 мл антигена при концентрации клеток 5*108 мл. Штатив с пробирками тщательно встряхивают до получения равномерной суспензии и выдерживают в термостате при 37...38 °С 4...10 ч, затем оставляют при комнатной температуре на 14...20 ч, после чего проводят макроскопический учет реакции. Реакцию считают положительной при наличии агглютинации в разведениях сыворотки 1:200 и выше, при отрицательных результатах реакции агглютинации — в контрольных пробирках. Реакцию считают сомнительной при наличии агглютинации в разведении сыворотки 1:100 и ниже. При получении сомнительной реакции сыворотку крови от этих животных исследуют повторно через 10... 15 дней, и в случаях, если титр не повысился, реакцию следует считать отрицательной. Оценивают реакцию агглютинации в крестах. Возбудитель сальмонеллеза телят — S. enteritidis (dublin) может обусловливать гастроэнтерит у человека вследствие пищевой токсикоинфекции. По антигенной структуре относится к группе D1. Патогенен для белых мышей. Реже сальмонеллез телят может быть обусловлен S. typhimurium, который вызывает сальмонеллез у водоплавающей птицы и у человека. По антигенной структуре входит в группу В. Возбудители сальмонеллеза поросят — S. typhisuis (kunzendorf) или S. choleraesuis (suipestifer) помимо заболеваний у свиней могут служить причиной пищевой токсикоинфекции у людей. По О-антигену отнесен к группе С1. Реже вызывает сальмонеллез S. typhimurium и S. dublin. Возбудитель сальмонеллезного аборта кобыл — S. abortusequi (открыт в 1893 г.). Поголовье лошадей (в неблагополучном хозяйстве) обследуют серологически (РА). Фекалии исследуют для выявления бактерионосителей. Показателем развития инфекционного процесса у взрослых лошадей служит титр сыворотки в РА выше 1:400. S. abortusequi по О-антигену входит в группу В. В случае невыделения данной культуры из исследуемого материала целесообразно проверить материал на наличие бактериофага S. abortusequi. Возбудитель сальмонеллеза овец — S. abortusovis. По О-антигену отнесен к группе В. Реже сальмонеллез овец вызывают S. typhimurium, S. anatum. Возбудитель сальмонеллеза птиц — S. pullorum (S. gallinarum). По антигену отнесен к группе D1. Сальмонеллез (пуллороз) протекает остро, в септической форме с большим процентом гибели цыплят (и эмбрионов) — до 100% в первые недели жизни. У взрослой птицы пуллороз протекает чаще бессимптомно. Взрослое поголовье птицы обследуют серологическим методом крове - капельной РА с пуллорозным эритроцитарным антигеном. Сальмонеллез у птиц могут вызывать S. typhimurium, S. enteritidis, S. anatum, S. infantis и др. Возбудитель сальмонеллеза водоплавающей птицы — S. typhimurium (наиболее часто), реже S. anatum и др. Болеют утята и гусята, реже цыплята. У утят и гусят сальмонеллез протекает остро в 6...20-дневном возрасте, птицы старше 2,5-месячного возраста болеют хронически, взрослые — латентно. Возбудитель сальмонеллеза пушных зверей — S. typhimurium, S. dublin, S. enteritidis, S. choleraesuis. Болеют серебристо-черные лисицы, песцы, нутрии, реже норки, еноты, соболи и речные бобры. Болезнь протекает остро, с высокой лихорадкой, энтеритом, истощением. У беременных животных наблюдают мертворождение или рождение нежизнеспособных щенков. Биопрепараты. Концентрированную формолквасцовую вакцину против паратифа (сальмонеллеза) телят готовят из селекционированного штамма S. dublin. Вакцину против паратифа (сальмонеллеза) поросят готовят из трех штаммов в соотношении: S. choleraesuis — 50 %, S. typhimuriun — 25 %, S. dublin — 25 %. Активность вакцины проверяют на голубях. Ассоциированную (поливалентную) вакцину против паратифа, пастереллеза и диплококковой септицемии поросят готовят из штамма S. choleraesuis, четырех штаммов P. multocida и четырех штаммов диплококка. Иммуногенные свойства вакцины проверяют на голубях и белых мышах. Формолтиомерсаловая вакцина против колибактериоза и паратифа пушных зверей, птиц, телят и поросят представляет собой инактивированную формалином и тиомерсалом суспензию эшерихий и сальмонелл. В качестве адъюванта применяют алюмокалиевые квасцы и хлорид кальция. Сухую живую вакцину против паратифа свиней из штамма ТС-177 готовят из аттенуированного штамма S. choleraesuis ТС-177, зависимого по тиамину, с пониженной вирулентностью для белых мышей и морских свинок. Вакцину проверяют на чистоту роста, безвредность на белых мышах и морских свинках. Вакцина против сальмонеллеза телят из аттенуированного штамма S. dublin № 6. Вакцина живая сухая против сальмонеллеза водоплавающей птицы. Вакцина против сальмонеллеза свиней из супрессорного ревертанта. Вакцина формолтиомерсаловая поливалентная против сальмонеллеза овец. Поливалентную антитоксическую сыворотку против паратифа и колибактериоза телят, ягнят, овец и птиц получают из крови волов-продуцентов, иммунизированных поливалентным антигеном, состоящим из 30 штаммов, 24 серогрупп эшерихий и 3 серотипов сальмонелл: S. dublin, S. typhimurium, S. abortusovis. Сыворотку контролируют на стерильность, безвредность и активность. Поливалентную антитоксическую сыворотку против паратифа телят, поросят, ягнят, овец и птиц получают из крови волов-продуцентов, иммунизированных поливалентным антигеном, состоящим из четырех серотипов сальмонелл: S. dublin, S. typhimurium, S. abortusovis, S. choleraesuis. Сыворотку проверяют на стерильность, безвредность и активность. Бактериофаг против паратифа и колибактериоза телят и бактериофаг против пуллороза (тифа птиц) готовят из фагов, выделенных от переболевших сальмонеллезом или колибактериозом животных. В реактор в МПБ или бульон Хоттингера засевают суспензию бактерий и добавляют маточные фаги. Визуально определяют полноту лизиса бактерий, затем добавляют хинозол и фенол. Фаголизат фильтруют через стерилизующие пластинки. Проверяют на стерильность, безвредность и активность (по Аппельману). Сальмонеллезный антиген для серологической диагностики представляет собой гомогенную инактивированную суспензию сальмонелл (концентрация клеток 1*109/мл). Применяют для серологической диагностики сальмонеллезов в пробирочной РА. Пуллорозный эритроцитарный антиген представляет собой 10%-ю суспензию эритроцитов барана, сенсибилизированных полисахаридно-полипептидной фракцией S. gallinarum-pullorum. Применяют для прижизненной диагностики сальмонеллеза птиц реакцией непрямой гемагглютинации на стекле с каплей крови. Цветной антиген для диагностики пуллороза птиц представляет собой гомогенную суспензию сальмонелл, убитых формалином и окрашенных кристаллвиолетом. Применяют в кровекапельной реакции агглютинации на стекле для прижизненной диагностики сальмонеллеза птиц. Флуоресцирующие сальмонеллезы О-сыворотки получают из крови кроликов, иммунизированных формалинизированными антигенами. Сыворотки адсорбируют, осаждают сульфатом аммония глобулины и проводят люминесцентное мечение очищенных глобулинов флуоресцеинизотиоционатом. Выпускают сыворотки к сальмонеллам 5 серогрупп и комплексную сыворотку. Наборы сывороток сальмонеллезных О-комплексных и моно-рецепторных О- и Н-агглютинирующих предназначены для экспресс-диагностики в РА на предметном стекле 33 групп сальмонелл, выделяемых от животных, из продуктов животного происхождения и объектов внешней среды. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Изучить культуральные, морфологические, тинкториальные и биохимические свойства бактерий из предварительно сделанных посевов на дифференциально-диагностических средах и МПА. 2. Приготовить мазки из колоний, окрасить их по Граму, сделать пересев из колоний на среду Ресселя или Олькеницкого. 3. С готовой чистой культурой сальмонелл поставить РА на стекле с О-комплексными и монорецепторными О- и Н-агглю-тинирующими сыворотками. 4. Учесть биохимические свойства сальмонелл на ПБДЭ. Контрольные вопросы 1. Какие дифференциально-диагностические среды используют для культивирования сальмонелл? 2. Каков характер роста колоний сальмонелл на среде Эндо? 3. Какой материал направляют в лабораторию при подозрении на сальмонеллез 4. Какое количество сероваров входит в род Salmonella? 5. Какие антигены входят в состав сальмонелл?
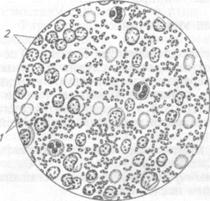
Тема 31 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЧУМЫ ВЕРБЛЮДОВ И ЧЕЛОВЕКА, ПСЕВДОТУБЕРКУЛЕЗА. БИОПРЕПАРАТЫ Цель занятия. Изучить свойства возбудителей и схемы лабораторной диагностики зооантропонозной чумы и псевдотуберкулеза. Оборудование и материалы. Культуры Y. pestis (вакцинный штамм) Y. pseudotuberculosis на МПА и в МПБ, готовые мазки из культур Y. pestis, Y. pseudotuberculosis, биопрепараты. МЕТОДИЧЕСКИЕ УКАЗАНИЯ Чума верблюдов и человека. Природно-очаговая болезнь. В естественных условиях резервуаром возбудителя служат грызуны. Здоровых животных заражают переносчики, в первую очередь блохи. Из сельскохозяйственных животных наиболее чувствительны верблюды. Болезнь характеризуется тяжелой интоксикацией, поражением лимфатической системы, легких, тенденцией к септицемии. Возбудитель чумы верблюдов и человека — бактерия Y. pestis, род Yersinia, семейство Enterobacteriaceae. Лабораторная диагностика чумы верблюдов и человека основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии (разработаны и другие методы), выделение чистой культуры посевом на питательные среды и методом биопробы, идентификацию возбудителя по культурально-морфологическим, ферментативным и серологическим свойствам. Материал для исследования. В лабораторию направляют органы, трупы грызунов, гной из бубонов, мокроту, кровь. Работа с чумным материалом разрешена только в специализированных лабораториях. Микроскопия препаратов из исходного материала. Мазки окрашивают по Граму. В препаратах возбудитель обнаруживают в форме овоидной или палочковидной клетки размером (0,3...0,5) х (1...3) мкм; располагается одиночно, парами, иногда короткими цепочками. Клетки грамотрицательные, часто с биполярной окраской, без жгутиков, спор не образуют (рис. 97).
Рис. 97. К pestis в гное: / — клетки возбудителя; 2—лейкоциты
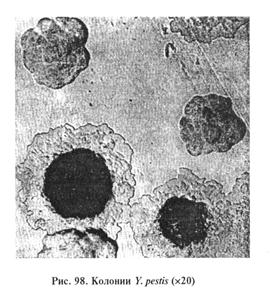
Выделение и идентификация культуры возбудителя. Возбудитель — факультативный анаэроб, температурный оптимум 28...29 °С (диапазон 14...42 °С), рН 7,2...7,4, хорошо растет на обычных питательных средах. Через 24 ч инкубирования при 37 °С на плотных средах образует шероховатые, с фестончатым краем и желтовато-коричневым выпуклым центром колонии, напоминающие из-за прозрачного фестончатого края «кружевной платок» (рис. 98). В МПБ возбудитель образует пленку на поверхности среды, от которой спускаются нити, напоминающие сталактиты, на дне пробирки хлопьевидный осадок.
Возбудитель расщепляет глюкозу, мальтозу, маннит, галактозу, арабинозу, ксилозу до кислоты, желатину не разжижает, индол не образует, выделяет каталазу. При исследовании материала от грызунов необходимо дифференцировать от Y. pseudotuberculosis, который в отличие от Y. pestis образует уреазу и ферментирует рамнозу. Помимо традиционного хода исследования применяют ускоренные методы обнаружения возбудителя и его антигенов в исследуемом материале: иммунофлуоресценцию, реакцию торможения пассивной гемагглютинации (РТГА), реакцию нарастания титра фага, РДП и др. Биопроба. Метод применяют для выделения чистой культуры из материала, контаминированного посторонней микрофлорой. Для этого используют морских свинок, которым материал вводят подкожно. Не загрязненный другими бактериями материал вводят внутрибрюшинно. Загнивший нативный материал втирают морским свинкам в предварительно выбритый участок кожи на животе. После гибели животных (на третий-седьмой день) проводят вскрытие с последующим бактериологическим исследованием внутренних органов. Биопрепараты. Чумная живая сухая вакцина из штамма EV. Химическая чумная вакцина. Чумной бактериофаг. Псевдотуберкулез (родентиоз). Инфекционная болезнь, преимущественно грызунов и птиц, характеризуется узелковым поражением паренхиматозных органов, сходным с изменениями при туберкулезе. Возбудитель псевдотуберкулеза — бактерия Y. pseudotuberculosis, род Yesrinia, семейство Enterobacteriaceae. Лабораторная диагностика псевдотуберкулеза основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале (прежде всего методом биопробы), выделение чистой культуры посевом на питательные среды и биопробой, идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим и патогенным свойствам. Материал для исследования. В лабораторию направляют паренхиматозные органы, лимфатические узлы, трупы грызунов и птиц. Микроскопия препаратов из исходного материала. По морфологии и тинкториальным свойствам Y. pseudotuberculosis практически неотличим от Y. pestis. Выделение и идентификация культуры возбудителя. Y. pseudotuberculosis — факультативный анаэроб, температурный оптимум 28...30 ºС, рН 7,2...7,4. Свойства возбудителя варьируют в зависимости от температурного режима культивирования. К питательным средам нетребователен. На плотных средах при 22...28 °С через 24 ч образует мелкие (диаметр 0,1...0,5 мм) круглые, выпуклые, прозрачные, серовато-желтоватые, блестящие колонии с приподнятым центром. При 37 °С может проявляться полиморфизм колоний, связанный с формированием колоний, выпуклых, с коричневатым центром и волокнистыми истонченными краями. При низких температурах (22 °С и ниже) образует жгутики, чем отличается от Y. pestis, при 37 °С неподвижен. В МПБ растет с равномерным помутнением среды и последующим выпадением хлопьевидного или вязкого осадка. С целью видовой идентификации исследуют ферментативные свойства. V. pseudotuberculosis образует уреазу, расщепляет рамнозу, мелибиозу, не обладает лизин-орнитиндекарбоксилазами, не гидролизует желатин, не образует индол, не утилизирует цитрат Симмонса и не дает реакцию Фогес—Проскауера при 25 ºС. Для серовариантной идентификации выделенных культур возбудителя применяют серологические реакции. Y. pseudotuberculosis подразделяют на шесть серологических групп (I...VI) по термостабильным антигенам и пять вариантов — по жгутиковым антигенам. Дата добавления: 2014-12-12 | Просмотры: 1848 | Нарушение авторских прав |