|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 4 страница
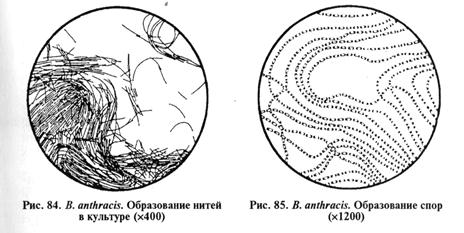
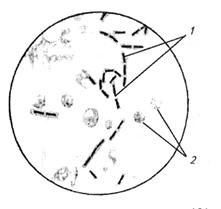
В выросших культурах исследуют морфлогические и тинкто-риальные свойства клеток. В мазках, окрашенных по Граму, обнаруживают длинные цепочки из грамположительных типичных палочек; в мазках из культур на средах с диффузным ростом находят отдельные или парные палочки (рис. 84...86). На бессывороточных средах бактерии капсулу не образуют, на сывороточных средах возбудитель формирует капсулу, причем клетки в препарате в последнем случае чаще располагаются одиночно или парами.
При значительной контаминации материала посторонней микрофлорой (сырье животного происхождения, объекты внешней среды) посев делают на селективный агар следующего состава: расплавленный МПА — 100 мл, сульфат полимиксина М —0,5 мл, невиграмон —0,5 мл, гризеофульвин — 1 мл, моющее средство «Прогресс» —10 мл, фенолфталеинфосфат натрия — 0,1 мл; перемешивают, разливают по чашкам Петри. Через 18...24ч культивирования на внутреннюю поверхность крышки чашки Петри наносят 1...2мл 25%-го водного раствора аммиака, чашку переворачивают. Колонии В. anthracis остаются бесцветными, колонии бактерий с фосфатазной активностью розовеют.
Биопроба. Заражение лабораторных животных исходным материалом — обязательный этап, проводимый сразу после поступления материала в лабораторию. Тканевой суспензией заражают подкожно двух белых мышей по 0,2...0,5 мл или морских свинок по 0,5...2 мл. Наблюдение ведут в течение 10 сут. При наличии возбудителя животные погибают обычно через 1...3 cyт. Павших животных исследуют с выделением культуры возбудителя. Если в ходе указанных исследований выделена бактерия, типичная для В. anthracis по морфологическим, тинкториальным и культуральным свойствам, патогенная для лабораторных животных, то дальнейшие исследования не проводят и диагноз считают установленным. В случае получения нечетких результатов при вышеизложенных исследованиях проводят дополнительные с целью дифференциации выделенной культуры от сходных сапрофитных бацилл, и в первую очередь от В. cereus. При этом определяют способность микроорганизма к капсулообразованию путем посева на сывороточные среды, патогенность для лабораторных животных в биопробе, чувствительность к пенициллину, сибиреязвенному бактериофагу, специфичность к сибиреязвенным люминесцирующим сывороткам, гемолитическую активность, наличие жгутиков (табл. 22).
Тест «жемчужного ожерелья» разработан для определения чувствительности выделенного микроорганизма к пенициллину. В две колбочки (пробирки) с расплавленным МП А (температура 45...50°С) добавляют пенициллин из расчета 0,05...0,5 ЕД/мл и переносят в две чашки Петри, в третью чашку наливают обычный МПА. После застывания агара из него вырезают пластинки размером 1,5 см2, которые переносят на предметные стекла и помещают в чашки Петри. На каждую пластинку бактериологической петлей наносят исследуемую 3-часовую бульонную культуру. Чашки выдерживают 1...3 ч в термостате. Затем посевы просматривают под микроскопом с объективом х 40 и иммерсионной системой. Перед просмотром зону роста накрывают покровным стеклом. Сибиреязвенные микробы на МПА с пенициллином приобретают шаровидную форму, а цепочки — вид «жемчужного ожерелья». Спорообразующие сапрофитные аэробы в аналогичных условиях растут в обычной форме. На агаре без пенициллина сибиреязвенные микробы образуют длинные цепочки из типичных палочек. Для определения чувствительности к сибиреязвенному бактериофагу культуру или материал засевают на скошенный МПА, затем на поверхность среды наносят каплю бактериофага в рабочем титре и посевы выдерживают при температуре 37...38°С 24 ч. В случае принадлежности культуры к В. anthracis на поверхности МПА в зоне нанесения бактериофага остается стерильная зона при наличии роста микроорганизма на остальных участках среды. Для идентификации В. anthracis методом люминесцирующих антител используют флуоресцирующую адсорбированную сыворотку, не дающую перекрестных реакций с антигенно-родственными сапрофитными бациллами. Гемолитическую активность исследуемой культуры определяют посевом на 5%-й МПА или в МПБ. Наличие жгутиков исследуют посевом в 0,3%-й МПА или методом «раздавленной капли». Если для исследования поступил загнивший материал, который нельзя подвергать бактериологическому исследованию, то диагноз ставят на оснований обнаружения антигенов возбудителя в материале при помощи реакции кольцевой преципитации. Материал экстрагируют физиологическим раствором (соотношение 1:10) путем кипячения в течение 30...40 мин (горячий способ). Экстракцию смеси тканевой суспензии и карболизиро-ванного физиологического раствора (соотношение 1: 10) можно проводить в течение 16... 18 ч при комнатной температуре (холодный способ). Экстракт фильтруют через асбестовую вату и исследуют в РП. Реакцию ставят методом «наслаивания» или «подслаивания». При «наслаивании» в преципитационную пробирку вносят 0,2...0,3 мл преципитирующей сыворотки и осторожно наливают (наслаивают) исследуемый экстракт таким образом, чтобы компоненты не перемешивались. При «подслаивании» в пробирку вначале вносят 0,2...0,3 мл экстракта, затем под него пастеровской пипеткой — равное количество сибиреязвенной преципитирующей сыворотки. Одновременно ставят контроли (см. далее). Реакцию считают положительной, если через 1...2 мин и не позже чем через 15 мин на границе между компонентами появился тонкий беловатый диск преципитации. В ветеринарных лабораториях часто исследуют на сибирскую язву в РП кожевенно-меховое сырье. В лабораторию доставляют пробы кожевенного сырья в виде небольших квадратиков (или кружков), взятых от шкур в местах, вырез которых не снижает товарной ценности. Эти пробы нанизывают на тонкую проволоку в том порядке, в котором шкуры расположены на складе. Поступившие пробы обязательно стерилизуют автоклавированием при 1,5 атм 30 мин. Затем пробы измельчают и берут навески: 1 г — от парного, мороженого, пресно-сухого и сухосоленого сырья и 2 г — от мокросоленого. Пробы заливают экстрагирующей жидкостью (физиологический раствор, содержащий 0,3 % кристаллического фенола). Пробы сырья от всех видов животных экстрагируют холодным способом при комнатной температуре в течение 16...20 ч; пробы от свиных шкур кипятят 30 мин. Экстракты фильтруют через асбестовую вату до прозрачности (предварительно взболтав содержимое баночек с пробами). Компоненты соединяют методом «наслаивания» или «подслаивания». Контроли РП. 1. Контроль преципитирующей сыворотки: а) со стандартным сибиреязвенным антигеном (результат положительный в течение 1...2 мин); б) с экстрактом из заведомо благополучных боенских кож (результат отрицательный в течение 1 ч); в) с экстрагирующей жидкостью (результат отрицательный в течение 1ч). 2. Контроль асбестовой ваты на нейтральность (при поступлении каждой новой партии асбестовой ваты). Учет результатов РП проводят через 10... 15 мин для пресно-сухого (одиночные пробы), через 30 мин — для пресно-сухого (сдвоенные пробы) и сухосоленого (одиночные пробы), через 60 мин — для сухосоленого (сдвоенные пробы) и мокросоленого сырья. При исследовании на сибирскую язву свежего тканевого материала, а также при идентификации выделенных культур можно использовать реакцию диск-преципитации, которая основана на взаимодействии продуктов метаболизма возбудителя (антиген), растущего в жидкой питательной среде, с антителами преципитирующей сибиреязвенной сыворотки. В стерильную бактериологическую пробирку вносят 0,5...1 мл преципитирующей сибиреязвенной сыворотки, на ее поверхность осторожно (по стенке пробирки) наслаивают расплавленный (45...50°С) 1%-й агаровый гель столбиком высотой 5...7 мм. Далее на поверхность застывшего агара наливают 1... 1,5 мл жидкой питательной среды (МПБ, среда ГКИ и т. д.) и в нее делают посев исследуемого тканевого материала или идентифицируемой культуры микроорганизма. Посевы выдерживают при 37...38 °С 16...20 ч. Результаты учитывают, просматривая пробирку в проходящем свете на черном фоне. В положительном случае в средней части столбика агарового геля обнаруживают тонкую белую четкую линию (диск) преципитации. Сапрофитные бациллы при росте в этой системе преципитации не дают. Некоторые штаммы В. cereus могут вызывать в нижней части агарового столбика образование рыхлой толстой зоны преципитации, которая за 30...40 ч разрыхляется и сливается с преципитирующей сывороткой. Биопрепараты. Вакцина СТИ — живая вакцина из эталонного штамма, полученного Н. Н. Гинсбургом (1944), представляет собой споровую (95... 100 %) агаровую культуру в виде суспензии в 30%-м стерильном растворе глицерина; содержит (2,5...3,5)*107 жизнеспособных спор в 1 мл. Вакцину контролируют на чистоту роста, концентрацию спор, безвредность на кроликах, иммуногенность на морских свинках. Вакцина ГНКИ — сухая живая вакцина из эталонного штамма ГНКИ. Содержит 5 • 107 спор в 1 мл. Готовят и контролируют так же, как вакцину СТИ. Срок годности сухой вакцины 3 года. Вакцина против сибирской язвы из штамма № 55. Ассоциированная живая жидкая вакцина против сибирской язвы и эмфизематозного карбункула крупного рогатого скота. Лечебно-профилактическую сибиреязвенную сыворотку получают гипериммунизацией лошадей инактивированной сибиреязвенной культурой. Сыворотку проверяют на стерильность, безвредность на белых мышах и морских свинках, активность на кроликах. Также выпускают противосибиреязвенный глобулин. Сибиреязвенная преципитирующая сыворотка предназначена для исследования материала на сибирскую язву в реакции преципитации. Сыворотку получают гипериммунизацией лошадей. Сибиреязвенный стандартный антиген для РП выпускают для контроля активности преципитирующей сыворотки. Представляет собой экстракт из инактивированной бактериальной массы В. anthracis. Сибиреязвенные люминесцирующие сыворотки готовят из сибиреязвенной преципитирующей сыворотки; предназначены для ускоренного обнаружения некапсулированных клеток возбудителя в первичных посевах. Сибиреязвенные диагностические бактериофаги представляют собой освобожденную от бактерий путем фильтрования жидкость бульонной культуры возбудителя, зараженную бактериофагом. Титр бактериофага 10.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Изучить и описать морфологические, тинкториальные и культуральные свойства В. anthracis. 2. Освоить технику постановки РП для исследования тканевого и кожевенно-мехового сырья на сибирскую язву. 3. Ознакомиться с феноменом «ожерелья» и сибиреязвенными биопрепаратами. Контрольные вопросы 1. Каковы правила взятия патологического материала? 2. Какие методы применяют для бактериологической диагностики сибирской 3. Каковы морфологические, тинкториальные и культуральные свойства B. anthracis? 4.На чем основана дифференциация В.anthracis от сапрофитных спорообразую-щих аэробов? 5.Как идентифицируют возбудитель сибирской язвы при помощи сибиреязвенного бактериофага? 6. Что такое феномен «ожерелья»? 7. Какие серологические методы применяют для обнаружения сибиреязвенного
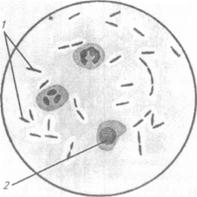
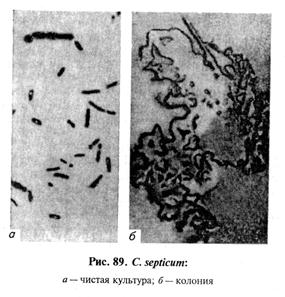
Тема 26 ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЗЛОКАЧЕСТВЕННОГО ОТЕКА, АНАЭРОБНОЙ ДИЗЕНТЕРИИ ЯГНЯТ, БРАДЗОТА, ИНФЕКЦИОННОЙ ЭНТЕРОТОКСЕМИИ, ЭМФИЗЕМАТОЗНОГО КАРБУНКУЛА. БИОПРЕПАРАТЫ Цель занятия. Ознакомить студентов со свойствами возбудителей, схемами лабораторного исследования, биопрепаратами. Оборудование и материалы. Культуры С. perfringens, С. chauvoei, C. septicum на среде Китта—Тароцци, глюкозо-кровяном агаре, среде Вильсона—Блера, трупы морских свинок, павших после заражения перечисленными анаэробами, наборы инструментов в стерилизаторах для вскрытия трупов морских свинок, пастеровские пипетки, стерильная среда Китта—Тароцци в пробирках, анаэростаты. МЕТОДИЧЕСКИЕ УКАЗАНИЯ Злокачественный отек. Это неконтагиозное инфекционное заболевание животных всех видов, возникающее после ранений, травм, родов, кастраций. Характеризуется быстро увеличивающимися, крепитирующими, болезненными отеками, распадом тканей и сепсисом. У злокачественного отека полимикробная этиология. Основные возбудители: С. septicum, С. perfringens, С. novyi (oedematiens), С. histolyticum, С. sordellii, а иногда С. chauvoei. Каждый из них может самостоятельно вызвать заболевание, но чаще их выделяют в ассоциации друг с другом или другими анаэробными и аэробными микроорганизмами (стафилококки, стрептококки и др.). Из сопутствующих микроорганизмов важную роль играет С. sporogenes, придающий процессу гнилостный характер и существенно отягощающий течение болезни. Возбудителей злокачественного отека относят к роду Clostridium. Лабораторная диагностика злокачественного отека основана на результатах бактериологического исследования. Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методами световой микроскопии и биопробы, выделение чистой культуры посевом на питательные среды и методом биопробы, идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим, токсигенным (в РН) и патогенным свойствам (в биопробе). Материал для исследования. В лабораторию направляют кусочки пораженных мышц, тканевый экссудат и паренхиматозные органы, а при поражении половых органов — истечения из влагалища и кусочки органов. Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму. При микроскопировании отмечают форму микробных клеток, их взаимное расположение, тинкториальные свойства, образование спор и капсул, ориентируясь на характеристики возбудителей, изложенные в таблице 23 (рис. 87...91).
Рис. 87. С. perfringens в отечной жидкости: 1 — клетки возбудителя с капсулой; 2 — форменные элементы
Выделение и идентификация культуры возбудителя. Возбудители — облигатные анаэробы, температурный оптимум 37... 38 ºС. Исследуемый материал высевают на среды Китта—Тароцци, Вильсона—Блера, культивируют 24...48 ч. Посевы на средах в чашках Петри инкубируют в анаэростате (крышкой вверх). В первичных посевах обычно вырастают смешанные культуры, поэтому, чтобы получить чистые культуры, из первичных посевов делают дробный рассев на глюкозо-кровяной агар Цейсслера в чашках Петри.
У выделенных культур изучают морфологические, тинктори-альные, культуральные и ферментативные свойства, принимая во внимание данные по свойствам возбудителей, указанные в таблицах 23, 24. При необходимости определяют токсигенные свойства возбудителей и тип токсина в реакции нейтрализации (см. тему 19). По антигенному составу токсических факторов различают 6 сероваров С. perfringens — А, В, С, D, Е, F. С. perfringens серовар А вызывает злокачественный отек у людей и животных, пищевую токсикоинфекцию у лошадей, энтеро-токсемию у телят и свиней, некротический мастит у рогатого скота. С. perfringens серовар В — возбудитель анаэробной дизентерии у ягнят, телят, поросят, козлят, жеребят. С. perfringens серовар С вызывает геморрагическую энтеротоксемию у овец, телят, поросят, ягнят, коз, верблюдов. С. perfringens серовар D — возбудитель энтеротоксемии у овец, коз, телят, кроликов. С. perfringens серовар Е выделяют при энтеротоксемии у телят и ягнят. С. perfringens серовар F вызывает некротический энтерит людей.
По составу растворимых антигенов токсина различают четыре серовара С. novyi — А, В, С и D. С. novyi серовар А выделяют при злокачественном отеке животных и человека и при брадзоте. С. novyi серовар В — возбудитель некротического гепатита овец, крупного рогатого скота и свиней, газовой гангрены у людей. С. novyi серовар С вызывает хронический остеомиелит у буйволов. С. novyi серовар D — возбудитель инфекционной иктерогемоглобинурии у крупного рогатого скота, овец и свиней.
Биопроба. Одновременно с посевом патологического материала на питательные среды заражают морских свинок. Патологический материал измельчают, тщательно растирают в стерильной ступке, добавляют небольшое количество МПБ. Полученную смесь вводят подкожно в область брюшных мышц двум морским свинкам массой 350...400 г по 0,5... 1 мл. При наличии в исследуемом материале возбудителя злокачественного отека морские свинки погибают через 16...48 ч в зависимости от вида возбудителя. При вскрытии у павших животных обнаруживают патолого-анатомические изменения, характерные для того или иного вида возбудителя (табл. 25).
Из ткани в месте введения патологического материала, а также из крови сердца, печени готовят мазки-отпечатки и делают посевы на среду Китта—Тароцци, МПА и в МПБ. Для проверки вирулентности выделенных культур суточную культуру, выращенную на среде Китта—Тароцци, вводят подкожно в область брюшных мышц двум морским свинкам в дозе 0,5... 1 мл. Наблюдение за подопытными животными ведут в течение 8 сут. Брадзот овец. Острая токсикоинфекция овец. Характеризуется геморрагическим воспалением слизистой оболочки сычуга и двенадцатиперстной кишки, а также дегенеративными изменениями паренхиматозных органов. Возбудители брадзота— С. septicum и С. novyi (oedematiens). Лабораторную диагностику проводят, как при злокачественном отеке. Материалом для исследования при подозрении на брадзот служат измененные участки сычуга и инфильтрат подкожной клетчатки. Токсичность С. novyi (oedematiens) определяют на двух белых мышах, которым внутривенно или внутрибрюшинно вводят фильтрат двухсуточных исследуемых культур. При наличии токсина мыши погибают через 24...72 ч. Анаэробная дизентерия ягнят. Острая токсикоинфекция, поражающая ягнят в первые пять дней жизни. Характеризуется геморрагической энтеротоксемией и сопровождается высокой смертностью. Возбудитель болезни — С. perfringens В. Материалом для исследования служат свежий труп ягненка или перевязанный с обеих сторон отрезок пораженного кишечника с содержимым, кусочки паренхиматозных органов, брыжеечные лимфоузлы, трубчатая кость. Содержимое желудка и кишечника направляют в лабораторию после консервирования хлороформом (одна капля на 10 мл патологического материала) или стерильным 30...40%-м раствором глицерина. Отобранные пробы должны быть доставлены в лабораторию в течение четырех часов с момента гибели животного, а консервированные — в течение 1...2 сут. Диагноз ставят при выделении чистой культуры возбудителя и обнаружении токсина в содержимом тонкого кишечника. Выделение чистой культуры С. perfringens проводят, как при злокачественном отеке. Токсин и его тип определяют методами, изложенными в разделе «Анаэробная энтеротоксемия» и в теме 19. Анаэробная энтеротоксемия. Острая инфекционная болезнь преимущественно молодняка, характеризующаяся геморрагическим гастроэнтероколитом, признаками токсемии, некрозом ворсинок тонкого отдела кишечника. Возбудитель энтеротоксемии овец, коз, кроликов — С. perfringens тип D, телят — С. perfringens типы С, D, Е, поросят — С. perfringens типы В, С. Лабораторная диагностика анаэробной энтеротоксемии состоит из двух этапов: 1) обнаружения токсина возбудителя в содержимом кишечника; 2) выделения чистой культуры и идентификации возбудителя по культурально-морфологическим, патогенным и токсигенным свойствам. Материалом для исследования служат содержимое пораженного отдела кишечника и кусочки паренхиматозных органов. Для обнаружения токсина содержимое кишечника разводят физиологическим раствором в соотношении 1:1 (1:2), экстрагируют при комнатной температуре 1 ч, фильтруют через ватно-марлевый фильтр, центрифугируют при 3000...5000 мин-1 20 мин. Надосадочную жидкость вводят внутривенно или внутрибрюшинно двум белым мышам по 0,5 мл или внутривенно кролику 1,-1,5 мл. При наличии в исследуемом материале токсина животные погибают в течение 12 ч. В случае гибели в более поздние сроки (до 24 ч) проводят бактериологическое исследование, чтобы исключить какую-либо другую инфекцию. При обнаружении токсина в содержимом кишечника приступают к определению типа токсина в реакции нейтрализации (см. тему 19). Реакцию ставят на белых мышах, морских свинках или кроликах. При постановке реакции на мышах результаты оценивают по гибели или выживанию животных, которым ввели смесь сывороток и токсина. При использовании морских свинок и кроликов результат учитывают по наличию или отсутствию некроза на месте внутрикожного введения смеси: у животных удаляют шерсть на боку и на следующий день в этот участок вводят смесь сыворотки и токсина. Второй этап исследования — бактериологический метод выделения возбудителя — проводят по общепринятой методике. По лученную культуру С. perfringens изучают по морфологическим, тинкториальным, культуральным, патогенным и токсигенным свойствам. Эмфизематозный карбункул (эмкар). Острое инфекционное заболевание рогатого скота. Характеризуется развитием отечных крепитирующих припухлостей в мышечной ткани. К эмкару более восприимчив крупный рогатый скот, реже овцы и козы. Возбудитель эмфизематозного карбункула — С. chauvoei, род Clostridium. Лабораторная диагностика эмкара основана на результатах бактериологического исследования. Бактериологическое исследование проводят по той же схеме, что и исследование на злокачественный отек. Материал для исследования. В лабораторию направляют кусочки пораженных мышц, экссудат из крепитирующего очага. Пораженный участок разрезают в глубину и из средней части мышцы отбирают кусочки ткани размером 3 см3. При вскрытии трупа берут также кусочки печени и селезенки, кровь сердца. Материал для лабораторного исследования отбирают не позднее чем через 4 ч после гибели животного. В жаркое время года материал консервируют стерильным 30%-м водным раствором глицерина. Микроскопия препаратов из исходного материала. С. chauvoei — толстая крупная грамположительная палочка размером (0,5...1,6) х (1,5...9) мкм, возбудитель — перитрих, образует споры в культуре и тканях, капсулу не формирует. Из нативного материала готовят мазки-отпечатки и окрашивают по Граму. При микроскопии обнаруживают отдельные или попарно лежащие полиморфные (веретенообразные, шаровидные, грушевидные) грамположительные палочки со спорами, расположенными центрально или субтерминально или находящимися отдельно от вегетативной клетки; палочка со спорой может напоминать по форме точильный камень или разливательную ложку. Выделение и идентификация культуры возбудителя. Строгий анаэроб, температурный оптимум 36...38 ºС. Исследуемый материал высевают на среду Китта—Тароцци, глюкозо-кровяной агар, МПА, в МПБ. При поступлении несвежего материала из него готовят суспензию на физиологическом растворе (соотношение 1:4), которую прогревают при 80 °С 15...20 мин для уничтожения сопутствующей микрофлоры и только после этого делают посев на питательные среды. Посевы культивируют 24...48 ч. При росте С. chauvoei на среде Китта—Тароцци сначала наблюдают равномерное помутнение бульона, распределяющееся по всему столбику. Через 20...24ч среда начинает просветляться и через двое суток становится прозрачной, а на дне пробирки образуется осадок микробных клеток. Газообразование незначительное. На агаре Цейсслера обнаруживают характерный рост колоний в виде перламутровой пуговицы или виноградного листа с образованием вокруг колоний неширокой зоны гемолиза. Биопроба. Одновременно с посевами заражают лабораторных животных. Исследуемый материал измельчают, растирают в стерильной ступке с небольшим количеством МПБ. Полученную суспензию (соотношение 1: 10) вводят подкожно в области брюшных мышц двум морским свинкам по 0,5... 1 мл. При наличии в материале возбудителя животные погибают в течение 1...4 сут. У павших морских свинок на коже в месте инъекции наблюдают серозно-гемрррагический выпот, кровоизлияния. Кожа от пораженных мышц отделяется с трудом, мышцы темно-красного цвета, в паховых и реже подмышечных областях обнаруживают небольшие скопления газа. Кишечник не вздут, органы брюшной полости без видимых изменений. В мазках-отпечатках с диафрагмальной поверхности печени обнаруживают отдельно лежащие палочковидные бактерии, что служит одним из дифференцирующих признаков от С. septicum, при заражении которым в аналогичных мазках обнаруживают нити или длинные цепочки. В случае необходимости возбудитель дифференцируют от С. septicum по критериям, изложенным в таблице 26.
Биопрепараты. Поливалентная концентрированная вакцина против брадзота, инфекционной энтеротоксемии, злокачественного отека овец и дизентерии ягнят состоит из смеси нативных токсических бульонных культур, обезвреженных теплом и формалином, сорбированных на геле гидроксида алюминия и затем концентрированных. Содержит С. perfringens типов В и D, С. novyi и С. septicum. Активность контролируют на кроликах после двукратной иммунизации путем определения количества антител в реакции нейтрализации. Поливалентный анатоксин против клостридиозов овец содержит анатоксины С. perfringens типов С и D и С. septicum, сорбированные на геле гидроксида алюминия. К готовым анатоксинам С. perfringens добавляют 25 % вакцины С. septicum. Активность контролируют на овцах путем иммунизации с последующим определением количества антител в РН. Активность препарата относительно С. septicum устанавливают вакцинацией кроликов с последующим заражением смертельной дозой культуры. Антитоксическую сыворотку против анаэробной дизентерии ягнят и инфекционной энтеротоксемии овец получают иммунизацией волов-продуцентов анатоксинами С. perfringens типов С и D. Иммунную сыворотку проверяют на активность в РН; 1 мл препарата должен содержать не менее 10АЕ антитоксинов каждого типа. Антитоксические сыворотки С. perfringens типов А, С, D и Е для диагностики болезней животных, вызываемых С. perfringens, получают гипериммунизацией овец или валухов очищенными анатоксинами типов А, С, D и Е. Сыворотки предназначены для идентификации токсинов С. perfringens в РН. Гидроокисьалюминиевая вакцина против эмфизематозного карбункула крупного рогатого скота и овец представляет собой инактивированную формалином, сорбированную на геле гидро-ксида алюминия реакторную культуру С. chauvoei, концентрированную путем удаления 2/3 культуральной жидкости после сорбции. Активность препарата проверяют на морских свинках.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Изучить морфологические, тинкториальные и культураль-ные свойства возбудителей, описать их признаки. 2. Провести вскрытие трупов морских свинок, приготовить окрашенные мазки-отпечатки, обнаружить возбудитель путем микроскопии. 3. Из органов и тканей провести посев материала на среду Китта—Тароцци с целью выделения культуры возбудителя. 4. Ознакомиться с биопрепаратами.
Контрольные вопросы 1.Какие микроорганизмы вызывают злокачественный отек? 2.Какие среды применяют для культивирования клостридий? 3. Каковы отличительные признаки С. perfringens от других клостридий—возбудителей злокачественного отека? 4. На каких животных ставят биопробу при эмфизематозном карбункуле? 5. Каковы морфологические и культуральные свойства возбудителя эмфизематозного карбункула?
Тема 27 ЛАБОРАТОРНАЯ ДИАГНОСТИКА СТОЛБНЯКА, БОТУЛИЗМА. БИОПРЕПАРАТЫ Цель занятия. Ознакомить студентов с методами лабораторной диагностики и биологическими свойствами возбудителей столбняка и ботулизма Оборудование и материалы. Белые мыши с клиническими признаками ботулизма и столбняка, готовые фиксированные мазки из культур С. tetani, С. botulinum, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ Столбняк. Острое инфекционное заболевание животных и человека, вызываемое токсином микроба С. tetani. Характеризуется повышенной возбудимостью и судорожными сокращениями мускулатуры тела, приводящими к асфикции, развивается в результате попадания спор возбудителя в раны. К возбудителю восприимчивы все виды домашних животных, особенно чувствительны лошади. Болезнь может возникнуть после родовых травм, кастрации, обрезания хвостов или пуповины у новорожденных, если при этих операциях были нарушены правила асептики и антисептики. Дата добавления: 2014-12-12 | Просмотры: 1944 | Нарушение авторских прав |