|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Объем оперативного вмешательства при травме печени
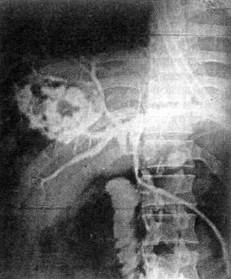
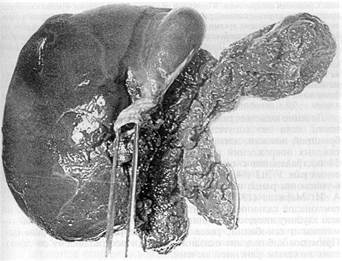
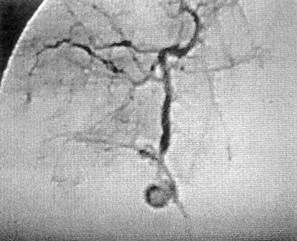
иск, тогда как с помощью раствора красителя можно быстро выявить повреждение желчных ходов даже очень малого диаметра. Чаще раствор контраста или красителя вводили через желчный пузырь — тем более что тяжелая травма печени обязывала к наложению холецистостомы, а если желчный пузырь подлежал удалению, то через дренаж общего желчного протока. Поврежденные протоки прошивали атравматической иглой нерассасывающимся шовным материалом. Обеспечив гемо- и холестаз в ране, дренировали ее перфорированной силиконовой трубкой. Затем, для профилактики затекания инфицированного тканевого «секрета» в подпеченочное пространство, производилась передняя гепатодиафрагмопексия. У трех пострадавших из-за невозможности осуществить гемостаз прошиванием сосудов в ране была лигирована печеночная артерия. Артерия перевязывалась при условии, что временное ее пережатие с помощью резинового турникета сопровождалось прекращением или значительным уменьшением интенсивности кровотечения. После перевязки печеночной артерии желчный пузырь во избежание некроза удаляли, а холедох дренировали по Холстеду — Пиковскому. Один из трех пострадавших умер от развившегося на операционном столе ДВС-синдрома; артерия у него была лигирована, когда кровопотеря уже превысила 5 л. Приводим наблюдение, когда перевязка печеночной артерии с целью гемостаза при тяжелой травме печени оказалась эффективной. Больной О., 25 лет, госпитализирован в районную больницу 07.09.76 г. с ушибом груди и живота — в состоянии алкогольного опьянения упал через борт машины на груду кирпичей. Через 3 недели после травмы у пострадавшего появились боли в правом подреберье, повысилась температура до 40°С. В последующие дни кожа стала иктеричной, несколько раз был дегтеобразный стул. Количество эритроцитов снизилось до 3,2х1012, Hb — 90 г/л. 13.10.76 г. больной оперирован в связи с внезапно возникшей острой болью в животе с клиникой внутрибрюшного кровотечения. Установлено, что источник кровотечения — прорвавшаяся гематома правой доли печени. Из брюшной полости удалено 500 мл жидкой крови и такое же количество сгустков крови. Больших размеров рана на диафрагмальной поверхности правой доли печени тампонирована сальником, который был подшит к краям раны. Через двое суток предпринята релапаротомия по поводу клиники желчного перитонита. Санирована брюшная полость, наложена холецистостома, дренированы поддиафрагмальное и подпеченочное пространства. После операции из правого поддиафрагмального пространства в сутки выделялось около 500 мл желчи, тогда как из холецистостомы — всего 10— 15 мл. Спустя 8 дней через дренаж, подведенный к ране печени, одномоментно выделилось 300 мл крови. Санавиацией больной доставлен в реанимационное отделение клиники. Состояние тяжелое, кожные покровы желтушные, пульс 120 уд./мин, АД 110/60 мм рт. ст., живот равномерно вздут, мягкий. Анализ крови: эритр.— 1,98х1012/л, Hb — 79 г/л, Ht — 22%. Через трое суток — очередной рецидив кровотечения, сопровождающийся геморрагическим шоком: пульс 140 уд./мин, АД 70/50 мм рт. ст. Релапаротомия. Взята на турникет собственная печеночная артерия, после чего из поддиафрагмального пространства и раны печени, расположенной в зоне V—VII сегментов, удалено 600 г старых и свежих сгустков крови. Из глубины раны возникло струйное кровотечение, которое прекратилось после пережатия печеночной артерии; артерия перевязана. Холецистэктомия от шейки, общий желчный проток дренирован по Холстеду — Пиковскому. Холангиография: виден затек контра-
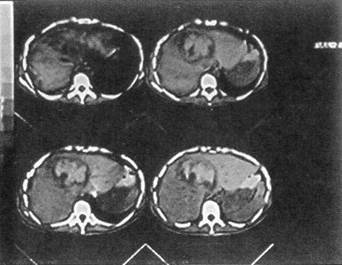
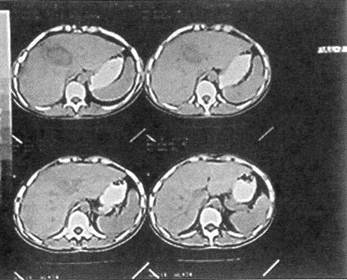
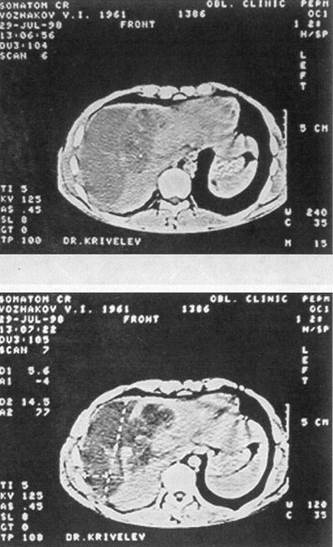
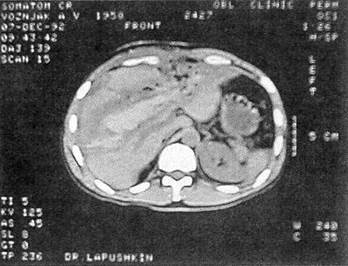
Рис. 7. Операционная холангиограмма больного О., 25 лет, с разрывом печени, осложненным гемобилией и прорывом субкапсулярной гематомы в свободную брюшную полость. Кровотечение остановлено перевязкой собственной печеночной артерии; желчный пузырь удален. Контраст, введенный в холедох через культю пузырного протока, затекает в полость в правой доле печени стного вещества в рану печени больших размеров (рис. 7). В пересеченной во время первого вмешательства круглой связке печени выделена, разбужирована и катетеризирована пупочная вена. Трансумбиликальная портография: на дне раны остатки контрастного раствора, целостность венозного русла не нарушена. Рана печени дренирована перфорированной силиконовой трубкой. Передняя гепатодиафрагмопексия по Хиари — Алферову — Николаеву. Дренировано подпеченочное пространство. После операции инфузионная, антибактериальная терапия осуществлялась трансумбиликально; регионарно вводились антиагреганты и гепатотропные препараты. Суточная потеря желчи через холедохостому составляла около 500 мл, а из раны печени — 100 мл с небольшим гнойным осадком. Даже непродолжительное пережатие дренажа протока сопровождалось увеличением желчеотделения из раны печени. Дренаж из общего желчного протока удален только через 47 дней после контрольной холангиографии, а из поддиафрагмального пространства — спустя 54 дня. Больной выписан 25.12.76 г. в удовлетворительном состоянии, но с наличием свища поперечной ободочной кишки; свищ закрыт через 3 мес. Остановить массивное кровотечение из глубокой размозженной раны печени прошиванием сосудов непосредственно в ране технически не всегда удается, особенно при травме VII—VIII сегментов. Известно, что кровотечение может быть из трех сосудистых систем: артериальной, портальной и нижней полой вен (ретроградное), когда пережатие не только печеночной артерии, но даже и всей гепатодуоденальной связки неэффективно. Резекция печени в такой критической ситуации может оказаться непереносимым для пострадав- шего вмешательством, тем более если она выполняется в неспециализированном отделении. Поэтому считаем преждевременным запрещать тампонаду раны печени марлей, хотя и разделяем мнение хирургов, которые утверждают, что этот способ гемостаза имеет существенные недостатки. К тампонаде раны марлевыми салфетками при разрыве печени 3-й степени тяжести мы прибегли в 7 случаях; гемостаз достигнут у 6 человек. В послеоперационном периоде у 4 больных развились гнойные осложнения. Приводим наблюдение. Ребенок Ч., 10 лет, 12.01.72 г. госпитализирован в городское ургентное хирургическое отделение — сбит машиной. Состояние при поступлении тяжелое. Бледный. Пульс 120 уд./мин, слабого наполнения, АД 60/40 мм рт. ст. Живот напряжен и болезненный, в боковых отделах — притупление. Экстренная лапаротомия. Аспирировано 1200 мл крови; продолжающееся кровотечение из глубокого разрыва на диафрагмальной поверхности правой доли печени. Попытка остановить кровотечение ушиванием раны с тампонадой сальником не увенчалась успехом. Состояние ребенка стало критическим: пульс на периферии исчез, перестало определяться артериальное давление, развился гипокоагуляционный синдром. Рана печени туго тампонирована тремя салфетками, концы которых выведены в верхний угол операционной раны. Гемотрансфузия во время операции составила 1800 мл (реинфузия — 800 мл, прямое переливание — 600 мл, свежецитратная кровь — 400 мл). Уже на следующий день тампоны пропитались желчью, а через четверо суток хирургом областной больницы предпринята релапаротомия по поводу общего желчного перитонита Тампоны удалены, по дну раны уложена силиконовая трубка, выполнены передняя гепатодиафрагмопексия, холецистостомия, санирована и дренирована брюшная полость. Выздоровление. После тампонады раны печени и стабилизации показателей гемодинамики допустима транспортировка пострадавшего в специализированное отделение или крупный многопрофильный стационар, если лечащий врач считает это необходимым. Для удаления тампонов обычно через четверо суток производили повторное оперативное вмешательство, что позволяло выполнить эту манипуляцию осторожно, с минимальной тракцией, а следовательно, и значительно меньшей опасностью возобновления кровотечения; затем дренировалась рана печени и желчевыводящие пути — при условии, что тампоны пропитались желчью. Если тампоны безопаснее удалять во время релапаротомии, то напрашивается вопрос: а следует ли выводить концы тампонов наружу? Ведь именно это обстоятельство прежде всего и способствует развитию гнойных осложнений. Не целесообразнее ли тогда тампоны полностью погружать в брюшную полость? Именно так мы и поступили у одной больной. Выбор лечебной тактики был сложен, поэтому считаем целесообразным привести данное наблюдение. Больная К., 24 года, 15.12.01 г. в дорожно-транспортном происшествии получила сочетанную травму живота, груди, головы. В центральной районной больнице ушита рвано-ушибленная рана лба, проведены противошоковые мероприятия и через 13 ч после травмы при стабильных показателях гемодинамики она была доставлена в клинику. Состояние при госпитализации средней тяжести, пульс 92 уд /мин, АД 120/85 мм рт. ст., дыхание справа ослаблено, живот мягкий, безболезненный. Анализ крови эритр.— 3,5x1012, Hb — НО г/л, Ht — 33%. На рентгенограмме груди виден перелом V—VI ребер справа и пристеночный верхушечный пневмоторакс. Спустя 3 ч возникла интенсивная боль по правому флангу живота, появилось вздутие живота, а пальпация его стала болезненной Лапароскопия — кровь в брюшной полости. Верхняя срединная лапаротомия с продлением ниже пупка. Аспирировано около 1 л крови. Установлено, что имеется прорыв внутрипечёночной гематомы в области VIII сегмента. Кровотечение остановлено тампонированием тремя марлевыми салфетками, которые были полностью погружены в брюшную полость. Через трое суток предпринята релапаротомия. После удаления салфеток началось паренхиматозное кровотечение из «разбитого» участка печени в проекции VII—VIII сегментов, диаметром 10 см, с отслоенной капсулой. На размозженный участок печени уложена гемостатическая губка и выполнена передняя гепатодиафрагмопексия. Дренировано подпеченочное пространство. В течение недели после операции отмечен вечерний подъем температуры до 38°С. При компьютерной томографии печени, предпринятой через 12 дней после травмы, констатировано, что в VII сегменте имеется массивная, нерезко отграниченная гематома гетерогенной плотности, над которой отслоена глиссонова капсула; вторая гематома лоцируется в IV, VIII сегментах, она относительно четко отграничена, с неровными контурами и большим кровяным сгустком — 69 Н, размером 6,8x6,9 см (рис. 8). Казалось бы, необходимость очередного оперативного вмешательства очевидна, но, учитывая его колоссальный риск, предпочли консервативную тактику и динамическое наблюдение. Проводимая терапия оказалась эффективной. Больная выписана 14.01.02 г. с рекомендацией предохраняться от беременности в течение полутора-двух лет. Повторно обследована 18.02.02 г. Жалоб нет. Состояние удовлетворительное. При контрольной компьютерной томографии печени отмечено более четкое отграничение гематомы в VII сегменте с плотностью сгустка 55—62 Н, уменьшение гематомы в IV, VIII сегментах до 5,6x5,0 см со снижением ее плотности до 45—50 Н (рис. 9). Спустя 4 мес после травмы женщина обратилась за советом, сообщила, что беременна,— срок 8 недель, беременность желанная. Принято решение беременность не прерывать Беременность протекала нормально. По данным ультразвукового исследования печени от 16.12.02 г., т. е. через год после травмы, в проекции определяемых ранее гематом лоцируются неправильной формы гипоэхогенные образования размером 4,8Х4,2 см каждая, жидкостных кистозных полостей не обнаружено — эволюция посттравматических гематом 23.01.03 г. родила девочку, вес 3 кг 900 г, роды физиологические, без осложнений 3-я степень тяжести травмы печени определена у 3 пострадавших, оперированных по поводу субкапсулярной гематомы, объем которой превышал 1 л (рис. 10). Вмешательство заключалось в опорожнении гематомы, дренировании полости; у одной больной при продолжающемся диффузном кровотечении из декапсулированной поверхности печени с целью гемостаза выполнена гепатодиафрагмопексия. Атипичная (экономная) резекция печени при закрытой ее травме 3-й степени тяжести произведена 6 пострадавшим; летальных исходов не было. С разрывом печени 4-й степени тяжести госпитализированы 29 пострадавших. Это предельно тяжелый контингент больных; у всех травма оказалась сочетанной. Четверо поступили в агональном состоянии и не оперированы. Тотчас после вскрытия брюшной полости погибли еще трое пострадавших с размозжением печени, причем у одного больного имелся разрыв внутрипечёночного отдела нижней полой вены и полный поперечный разрыв портальной вены (рис. 11). Попытка добиться гемостаза ушиванием разрывов печени, как правило, множественных, предпринята 11 пострадавшим; 5 умерли на операционном столе, 4 — в ближайшем послеоперационном перио-
Рис. 8. Компьютерная томография печени больной К., 24 года, через 12 дней после травмы (описание в тексте)
Рис. 9. Компьютерная томография печени той же больной через 1,5 мес после травмы (описание в тексте)
Рис 10 Компьютерная томограмма печени больного В, 37 лет Видна огромная субкапсулярная гематома печени — закрытая травма живота за 3 недели до исследования. При вскрытии гематомы удалено около 1 л инфицированной крови и сгустков, полость дренирована двумя силиконовыми трубками для проточного промывания; выздоровление
Рис 11 Печень погибшего во время операции больного С, 34 года (21 05 79 г) размозженная правая доля печени, левая — оторвана, виден полный поперечный разрыв воротной вены, в просвет которой введен пинцет де. 3 больным для остановки кровотечения разрыв печени тампонирован марлей; 2 погибли из-за продолжающегося кровотечения. Один из пострадавших оперирован в городском хирургическом отделении по поводу профузного внутрибрюшного кровотечения вследствие прорыва субкапсулярной гематомы печени; травма печени произошла при сдавлении между двумя вагонетками В течение 9 ч хирурги пытались остановить кровотечение из большой размозженной раны в проекции V, VI, VII сегментов К моменту прибытия консультанта объем только реинфузированной крови составил 30,5 л. В данной ситуации резекция печени была непереносимым по объему вмешательством. Перевязана печеночная артерия; струйное кровотечение прекратилось. Рана тампонирована прядью сальника, который дополнительно был еще прижат марлевой салфеткой. Установлены дренажи, наложена холецистостома. Больной умер через сутки после операции от синдрома массивной инфузии. Резекция печени выполнена 8 пострадавшим; 4 погибли Особую сложность для вмешательства представляет повреждение в области кавальных ворот Приводим наблюдение. Больной Г, 23 года, поступил в клинику 29 04 91 г с закрытой сочетанной травмой живота и таза — на работе был придавлен грунтом Состояние тяжелое, шок 3-й степени тяжести Клиника внутрибрюшного кровотечения не вызывала сомнений Срединная лапаротомия В брюшной полости около 3 л крови, продолжающееся кровотечение из размозженной раны заднедиафрагмальной поверхности правой доли печени. Печень сдавлена руками и прижата к позвоночнику; аспирирована кровь из брюшной полости. Переднебоковая торакотомия по VIII межреберью с рассечением реберной дуги и диафрагмы. Произведена субтотальная резекция VII сегмента. В ране печени прошиты и лигированы поврежденные сосуды и желчные ходы. Продолжающееся диффузное кровотечение остановлено тампонадой прядью сальника. Наложена холецистостома. Ушита диафрагма. Дренированы плевральная полость, поддиафрагмальное и подпеченочное пространство. Операционная кровопотеря — 8 л; реинфузировано 5 л, перелито «теплой» цитратной крови — 1,3 л, свежезамороженной плазмы — 0,9 л, криопреципитата — 2,7 л. Выздоровление. Лечение ножевых ранений печени обычно не представляет сложности, если нет сопутствующих ранений магистральных сосудов брюшной полости, элементов гепатодуоденальной связки, а также тяжелых повреждений органов груди. Рана печени не ушивалась 54 пострадавшим с остановившимся кровотечением из поверхностных ран. У 318 (84,8%) человек объем вмешательства заключался в ушивании раны; предпочтение отдаем двойному петлистому шву А. И. Мариева (1975). У 24 пострадавших шов раны сочетали с тампонадой сальником на питающей ножке. Ушивание раны не на всю глубину является причиной образования внутрипечёночной гематомы и гемобилии; такое осложнение развилось у 2 раненых. Приводим наблюдение оказания помощи пострадавшему со сквозным ножевым ранением печени. Больной Р.,25лет, госпитализирован в клинику 02 01 91 г в состоянии геморрагического шока 4-й степени тяжести через 30 мин после ножевого ранения в живот. Экстренно оперирован В брюшной полости более 2 л крови и сгустков — продолжающееся кровотечение из сквозной раны V сегмента Взята на турникет и пережата гепатодуоденальная связка; рана расширена рассечением через край печени Прошиты и перевязаны пересеченные концы срединной печеночной вены. Вскрыта большая забрюшинная гематома справа от позвоночника Началось струйное кровотечение из сквозной раны нижней полой вены. Вена в месте повреждения отжата, обе раны ушиты. Обнаружено сквозное ранение нисходящей части двенадцатиперстной кишки, раны ушиты Послеоперационный период протекал без осложнений У двух больных сквозное ранение печени сопровождалось пересечением собственной печеночной артерии. Одному пострадавшему артерия перевязана, другому наложен циркулярный шов. Желчный пузырь удален у обоих больных, так как и после восстановления кровотока по артерии не исключалась опасность тромбоза анастомоза с последующим некрозом пузыря. Такое осложнение возникло после наложения сосудистого шва на пересеченную при резекции желудка печеночную артерию в одном из отделений областного центра; холецистэктомия выполнена уже во время релапаротомии. Огнестрельные ранения печени представляли собой неоднородную группу: пулевые ранения получили 20 человек, дробовые — 6. Множественные повреждения органов выявлены у 24 пострадавших, причем у 8 из них ранение было торакоабдоминальным. У 5 больных раны печени 2-й степени тяжести ушиты. У 10 пострадавших при периферической локализации сквозной раны печени после временного гемостаза пережатием гепатодуоденальной связки раскрывали раневой канал через край печени, затем отсекали нежизнеспособные ткани, удаляли инородные тела с последующим ушиванием раны двойным петлистым швом А. И. Мариева. У больной со сквозным пулевым ранением II сегмента гемостаз достигнут проведением через раневой канал пряди сальника на ножке с фиксацией его к диафрагме. У 7 пострадавших с продолжающимся кровотечением из больших размозженных ран гемостаз осуществлялся лигированием сосудов непосредственно в ране по методике, не отличающейся от применяемой при разрывах печени такой же степени тяжести. Компьютерная томограмма больного со сквозным пулевым ранением обеих долей печени через неделю после операции представлена на рис. 12. Резекция печени произведена 5 пострадавшим при размозжении части органа, повреждении сосудисто-секреторной ножки; 2 умерли. Из 107 оперированных больных с травмой печени 3—4-й степени тяжести желчевыводящие пути дренированы 44 (41,1%); обычно ограничивались инвагинационной холецистостомой, а если желчный пузырь подлежал удалению, то дренировали холедох по Холстеду — Пиковскому. Оптимальным доступом при выполнении корригирующих вмешательств на поврежденной печени была срединная лапаротомия — у 547 из 564 (96,9%) оперированных. Ушивание ран в области VII— VIII сегментов становилось возможным после мобилизации печени пересечением ее связочного аппарата с последующей тракцией орга-
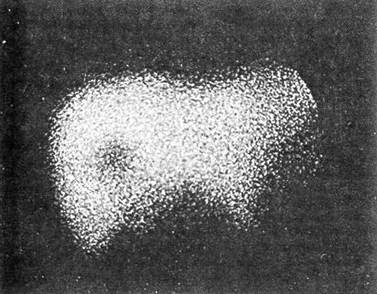
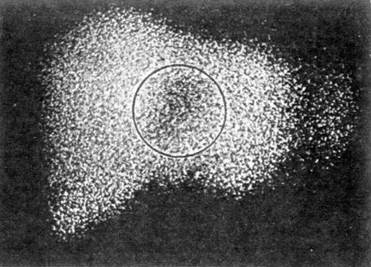
Рис. 12. Компьютерная томография печени больного В., 34 года, через неделю после оперативного вмешательства по поводу пулевого ранения обеих долей печени Печень увеличена в размерах, по ходу раневого канала, проходящего через обе доли, определяется обширная зона отека, в центре которой овально-продолговатой формы гематома на за культю круглой связки (методика С. А. Гешелина, 1960). Трансдиафрагмальной лапаротомией ограничились у 8 из 73 пострадавших с правосторонним торакоабдоминальным ранением. К лапароторакофренотомии пришлось прибегнуть в 6 случаях с повреждением печени в области кавальных ворот. Так, у больного 22 лет, получившего пулевое абдоминоторакальное ранение со сквозным ранением правой доли печени, во время лапаротомии установлено, что продолжается интенсивное кровотечение из размозженной раны VII—VIII сегментов. Временный гемостаз достигнут сжатием печени. Лапаротомный доступ переведен в лапароторакофренотомический. Резецирован поврежденный участок печени с прошиванием сосудов в ране; дренированы рана печени и подпеченочное пространство. Послеоперационный период осложнился формированием желчного свища, чему способствовало то обстоятельство, что не были дренированы желчевыводящие пути — следовало наложить холецистостому. При повторном вмешательстве прошит поврежденный желчный проток. Послеоперационные осложнения возникли у 24,1% пострадавших с закрытой травмой и у 12,7% с ранениями печени. Наиболее частым осложнением был перитонит — у 31 пострадавшего, причем у 17 из них причиной перитонита являлась травма печени. Развитие этого грозного осложнения было обусловлено отказом от дренирования желчевыводящих путей при тяжелых повреждениях печени (7), а также размозженных ран (3), некрозом ткани печени в окружности раны после ее ушивания (2), тампонадой раны печени марлей (2), посттравматическим деструктивным холециститом (2), поздним вмешательством (1). У 14 больных перитонит явился следствием травмы желудочно-кишечного тракта. Специфичными для травмы печени осложнениями были посттравматический гепатит (13), поддиафрагмальный (7) и подпеченочный (5) абсцессы, гемобилия (7), желчный свищ (5), абсцесс печени (5), острая печеночно-почечная недостаточность (3), продолжающееся (2) и возобновляющееся (2) кровотечение. Тяжелым осложнением травмы печени является гемобилия. Мы располагаем 7 наблюдениями: после ранений — у 5 (1,2%), закрытой травмы — у 2 (1,1 %). У 6 больных развитие гемобилии констатировано уже в послеоперационном периоде. Для уточнения локализации внутрипечёночной гематомы использовали гепатосцинтиграфию, ультразвуковое исследование, компьютерную томографию, целиакогепатографию. Консервативная терапия с применением гемостатических средств, включая препараты крови, содержащие факторы сгустка, оказалась эффективной при лечении двух пострадавших. Приводим наблюдение. Больной К., 18 лет, оперирован 15 10.89 г в одной из больниц областного центра по поводу правостороннего ножевого торакоабдоминального ранения с повреждением печени. При лапаротомии в V сегменте печени обнаружена рана длиной 4 см, которая ушита П-образными швами; реинфузировано 1400 мл крови. Через двое суток после операции появилась желтуха, интенсивность которой быстро возрастала В клинику больной переведен в тяжелом состоянии. Кожа и склеры ярко желтушны. Живот впалый, мягкий, печень не увеличена Стул 2 раза в сутки, кал неоформленный, черного цвета Билирубин общий — 495,0 мкмоль/л (связанный - 405,0, свободный — 90,0), эритр.— 2,7х1012, Hb — 108 г/л. При сцинтиграфии в правой доле печени выявлен «холодный» очаг размером 2,8x2,5 см с неровными контурами (рис. 13). После консервативной терапии прекратились кишечные кровотечения, стал быстро снижаться уровень билирубина крови Выписан через месяц в удовлетворительном состоянии. Оперативное вмешательство, заключающееся в перевязке печеночной артерии или одной из ее ветвей, произведено двум пострадавшим. Одно из этих наблюдений, когда с целью гемостаза лигирована печеночная артерия, описано ранее. У второго больного стойкая гемобилия развилась после ушивания ножевой раны печени в области IV сегмента. При гепатосцинтиграфии в междолевой зоне обнаружен «холодный» очаг размером 5,0x4,0 см (рис. 14). Во время операции установлено, что раствор контраста, будучи введенным только в левый печеночный проток, попадает во внутри-печеночную полость, что и послужило основанием к перевязке левой печеночной артерии. Послеоперационный период протекал благоприятно; выздоровление.
Рис 13. Гепатосцинтиграмма больного К, 18 лет, в передней проекции. Положение печени обычное. Форма сохранена, размеры умеренно увеличены, контуры четкие, распределение радиофармпрепарата очагово-неравномерное: в проекции правой доли — на границе V—VII сегментов — определяется «холодный» очаг размером 2,8x2,5 см с неровными контурами
Рис. 14 Гепатосцинтиграмма больного К., 20 лет, в передней проекции. Положение печени обычное, размеры несколько увеличены за счет левой доли; в проекции IV сегмента определяется «холодный» очаг размером 5,0x4,0 см Перевязку печеночной артерии и ее ветвей для лечения гемобилии мы применяли в тот период, когда в клинике не было возможности предпринять рентгеноэндоваскулярную суперселективную эмболизацию ветвей печеночной артерии. Суперселективная рентгеноэндоваскулярная эмболизация ветвей печеночной артерии, повреждение которых явилось источником кровотечения, произведена двум пострадавшим; достигнут хороший гемостатический эффект. Эндоваскулярную эмболизацию предполагалось выполнить еще одному больному, у которого при гепатографии в бассейне левой печеночной артерии выявлена ложная аневризма размером 5,0x4,0 см, овальной формы, с неоднородным контрастированием — частичный тромбоз. Суперселективно катетеризирована левая печеночная артерия, но ввести спираль Гиантурко в артерию не удалось из-за выраженного спазма сосуда. На следующий день предпринята повторная попытка эндоваскулярной эмболизации, однако при целиакогепатографии выяснилось, что левая печеночная артерия не контрастируется, а полость аневризмы не заполняется контрастом. После проведенных манипуляций прекратились кишечные кровотечения, а уровень билирубина крови снизился до нормальных показателей. Очевидно, у данного больного катетеризация левой печеночной артерии сопровождалась травмой интимы с последующим тромбозом просвета сосуда, что привело к прекращению поступления крови в желчные ходы. Наш небольшой опыт лечения посттравматической гемобилии все же позволяет сделать следующие выводы: — лечение больных следует начинать с комплексной консервативной терапии, которая может оказаться достаточной для достижения стойкого гемостаза; — отсутствие эффекта от консервативной терапии является показанием к суперселективной эмболизации поврежденных внутри — предварительно выполненная ангиогепатография позволяет убедиться, что источник кровотечения — именно артериальный сосуд, а — достоинством рентгеноэндоваскулярных вмешательств является также минимальный отрезок времени между установлением топического диагноза и проведением лечебных мероприятий; — перевязка печеночной артерии допустима в экстремальной ситуации, каковой может быть профузное внутрибрюшное кровотечение вследствие прорыва гематомы печени, а также когда невозможно выполнить суперселективную эндоваскулярную эмболизацию Желчный свищ сформировался у 3 пострадавших с огнестрельным ранением и у 2 — с разрывом печени; 3 из них потребовалось оперативное вмешательство. Больному с желчно-плевральным свищом и эмпиемой плевры выполнены торакотомия, плеврэктомия с декортикацией легкого, ушит дефект в диафрагме, а затем разрезом Федорова вскрыта брюшная полость, дренировано поддиафрагмальное пространство и наложена холецистостома; свищ закрылся через 3 недели. 2 больным предпринято иссечение свищевого хода с последующим послойным ушиванием раны печени. Выбор оперативного доступа для вскрытия поддиафрагмального абсцесса печени зависел от локализации гнойника, которую уточняли с помощью ультразвукового исследования, компьютерной томографии. Задний внеплевральный доступ по А. В. Мельникову применен 3 больным; при этом у одного из них была нарушена целостность плеврального листка, однако это не привело к развитию воспалительного процесса в плевральной полости. У 4 больных применен передний внебрюшинный доступ по Клермону. Чрезбрюшинный доступ — срединную релапаротомию или подреберный разрез — применяли с учетом наличия еще других внутрибрюшных осложнений и характера доступа при первичном вмешательстве. Считаем целесообразным поделиться опытом лечения одного из таких больных. Больной Ч, 30 лет, оперирован в центральной районной больнице 16.05.98 г. по поводу огнестрельного (дробового) торакоабдоминального ранения справа с повреждением печени, правой почки, грудной стенки с переломом ребер с IX по XII, эвентрацией петель тонкой кишки, шоком 3-й степени тяжести. Выполнена ати-
Рис. 15. Ангиогепатография больного Ч., 30 лет. В бассейне правой печеночной артерии — ее передневерхнего сегмента — визуализируется гематома диаметром 2 см пичная резекция правой доли печени, наложена холецистостома, ушита рана почки, диафрагмы, грудной стенки, дренирована плевральная и брюшная полости. Хирург использовал комбинированный доступ — срединный разрез дополнил подреберным, справа 21.05 санавиацией больной доставлен в клинику. Состояние тяжелое, бледен, склеры субиктеричны, живот умеренно вздут, болезненный, печень выступает из-под реберной дуги на два поперечника пальца. Стул 2 раза в сутки; кал неоформленный, черного цвета. Гипертермия. На обзорной рентгенограмме живота отмечено высокое стояние правого купола диафрагмы. Наличие поддиафрагмального абсцесса подтверждено компьютерным исследованием Оперирован Сняты швы с послеоперационной раны в правом подреберье Из подпеченочного и поддиафрагмального пространства выделяются гной, старая кровь в смеси с детритом печени. Установлено, что резецированный край V сегмента прошит П-образными швами, а в области VII—VIII сегментов имеется рана размером 8,0x6,0 см, с рваными краями, заполненная гноем и сгустками крови. При ревизии раны возникло артериальное кровотечение Рана тампонирована «сигарообразными» тампонами. При ушивании раны брюшной стенки возникло кровотечение по дренажам. При ревизии — интенсивное кровотечение из раны печени. Рана повторно тампонирована четырьмя салфетками, которые стали пропитываться кровью; больной транспортирован в отделение рентгенохирургии. Трансфеморальным доступом справа выполнена аорто-, целиако- и селективная ангиогепатография. На ангиограммах: патологии в бассейне верхней брыжеечной и почечной артерий не выявлено; в артерии передневерхнего сегмента правой печеночной артерии обнаружена экстравазация раствора контраста в полость диаметром 2 см с длительной задержкой в ней контраста (рис 15). В поврежденный сосуд подведен катетер, через который введены спирали Гиантурко: дистальнее и проксимальнее гематомы. Контрольная гепатография гематома не заполняется (рис. 16). Послеоперационное течение благоприятное. Больной выписан из клиники 22.06 в удовлетворительном состоянии. Возникновению послеоперационных осложнений, а иногда и летальному исходу, способствовали ошибки, допущенные при обследовании и лечении 27 (15,3%) пострадавших с разрывом и 15
Рис. 16. Контрольная ангиогепатография больного Ч., 30 лет, после рентгеноэндоваскулярной эмболизации поврежденной ветви печеночной артерии спиралями Гиан-турко. Гематома контрастом не заполняется (3,7%) — с ранениями печени. Диагностические ошибки заключались не только в позднем распознавании внутрибрюшной катастрофы (11), но и внутриплевральных осложнений (4). Тактическими ошибками были затрата времени на противошоковые мероприятия при продолжающемся внутрибрюшном кровотечении (2), «силовое» удаление тампонов из раны печени (1), что привело к рецидиву кровотечения. Несомненно, не у всех погибших на операционном столе от продолжающегося кровотечения техника гемостаза была адекватной тяжести повреждения печени. Так, у пострадавшего с практически полным поперечным междолевым разрывом («переломом») печени остановить кровотечение пытались ушиванием, а не резекцией органа. У 2 пострадавших при разрыве печени 3-й степени тяжести гемостаз достигнут прошиванием ткани «ad massam»; при этом оказались лигированными сегментарные сосуды и желчные протоки, что явилось причиной секвестрации паренхимы с образованием абсцессов. Возможно, что еще у 10 пострадавших удалось бы избежать развития гнойных осложнений, если бы оперативное вмешательство было дополнено дренированием желчевыводящих путей. Из 174 пострадавших с закрытой травмой печени погибли 53 (30,5%), причем в течение часа пребывания в стационаре, не будучи оперированными, умерли 16 больных; все они получили сочетанную травму и находились в предельно тяжелом состоянии. После опера- ции умерли 37 (23,4%). Сочетанным характером повреждений объясняется смерть 10 (11,8%) пострадавших с повреждениями печени 1—2-й степени тяжести; 6 из них погибли от тяжелой травмы груди, 4 — головы. Все 13 (25,5%) погибших после операции с повреждениями печени 3-й степени тяжести также имели сочетанную травму. Особенно большая летальность наблюдалась в случаях с травмой печени 4-й степени тяжести — из 22 оперированных умерли 15 (68,2%). И все же у 35 из 53 погибших травма печени оказалась ведущим по тяжести повреждением. Именно из-за массивной кровопотери 12 больных умерли на операционном столе и 5 — в ближайшие часы после операции. При кровопотере до 1 л летальность составила 11,3%, от 1 до 2 л — 19%, от 2 до 3 л — 30%, более 3 л — 63,9%. Учитывая, что при повреждениях печени 3—4-й степени тяжести кровотечение интенсивное и, в отличие от травмы селезенки, не имеет тенденции к самопроизвольной остановке, фактор времени приобретает особую значимость. Практически все пострадавшие (94,3%) с массивным кровотечением (свыше 3 л) оперированы не позже 3 ч с момента травмы. И хотя летальность среди пострадавших с массивным кровотечением, даже при этих сроках вмешательства, была высокой, ранняя операция являлась единственным шансом благоприятного исхода. Летальность при ножевых ранениях печени составила 4%, при огнестрельных — 26,9%. Высокая летальность при огнестрельных ранениях обусловлена значительной травмой печени, множественностью повреждений органов у большинства (91,5%) раненых; кроме того, у каждого третьего пострадавшего ранение имело торакоабдоминальный характер. Следует также отметить, что особой тяжестью травмы отличались дробовые ранения, полученные обычно с близкого расстояния, сопровождающиеся разрушением грудной и брюшной стенок, эвентрацией органов, массивным наружным и внутренним кровотечением, шоком и острой дыхательной недостаточностью. Обсуждение По поводу повреждений печени в клинику госпитализировано 575 пострадавших: ранения печени получили 401 человек (ножевое — 375, огнестрельное — 26), закрытую травму — 174 человека. При распознавании повреждений печени у пострадавших с закрытой травмой живота мы, как и большинство хирургов (Г. Ф. Николаев, 1955; С. А. Боровков, 1975; А. А. Бураков и соавт., 1986; Б. И. Альперович и соавт., 1997; A. Fritsch et al., 1985), учитывали прежде всего обстоятельства травмы, клинику внутрибрюшного кровотечения, данные физикальных методов исследования. Ценную информацию удавалось получить с помощью обзорной рентгенографии груди и живота. Артериографию применяли редко, преимущественно пострадавшим с гемобилией, для уточнения локализации гематомы и последующей эндоваскулярной эмболизации соответ- ствующей ветви печеночной артерии. Мы разделяем мнение хирургов, считающих артериографию сложным, трудоемким исследованием, требующим к тому же значительной затраты времени, что делает ее малоприемлемой для пострадавших с нестабильной гемодинамикой (С. 3. Горшков, 1978; В. С. Шапкин и соавт., 1987; А. Е. Борисов и соавт., 2000; J. Lenriot et al., 1984). Большинство (71,3%) пострадавших с закрытой травмой печени имели сочетанное повреждение еще и других анатомических областей, состояние их при поступлении в клинику было крайне тяжелым. Поэтому, не умаляя значимость физикальных методов исследования, мы разделяем точку зрения А. Е. Романенко (1985), что при наличии сочетанной травмы информативность местных и общих клинических симптомов повреждений печени резко снижается, а ситуация критическая и требуется предельно быстрая диагностика. Поэтому в 43,7% случаев применены инструментальные методы исследования: лапароцентез и лапароскопия. Несомненно, будущее за неинвазивными методами, прежде всего ультразвуковым, сочетающим большую информативность с доступностью освоения и выполнения. Во время операции тяжесть повреждения внутриорганных структур уточняли с помощью холангиографии, прокрашивания желчевыводящих путей раствором метиленовой сини, трансумбиликальной портогепатографии. Наиболее часто применяемым оперативным вмешательством при повреждениях печени было ушивание раны (разрыва) — у 420 (73%), причем у 28 из них предварительно лигировали сосуды в ране; у 43 больных шов раны сочетали с тампонадой сальником на питающей ножке. У 75 человек с поверхностными разрывами и ранениями печени при остановившемся кровотечении ограничились только санацией и дренированием брюшной полости. Совершенно правы хирурги (Ю. В. Бирюков и соавт., 1998; А. Е. Борисов и соавт., 2000), утверждающие, что такой объем вмешательства можно выполнить и под контролем лапароскопии, если бы степень тяжести повреждения печени и количество излившейся в брюшную полость крови были предварительно уточнены. Преимущества малоинвазивного вмешательства в сравнении с лапаротомией особенно значимы у пострадавших с сочетанной травмой, жизненные ресурсы которых на пределе. У 10 пострадавших с разрывом и у 7 с огнестрельной раной печени неправильной формы, размозжением ткани в окружности и продолжающимся массивным кровотечением прошили поврежденные сосуды непосредственно в ране с последующей бережной хирургической обработкой. В условиях «сухой» раны проверяли целостность внутрипечёночных желчных протоков прокрашиванием их раствором метиленовой сини. Достигнув гемо- и холестаза, дренировали рану силиконовой перфорированной трубкой и для отграничения от свободной брюшной полости выполняли переднюю гепатодиафрагмопексию. Наши наблюдения подтверждают данные ученых, утверждающих, что такая хирургическая обработка раны позволяет избежать интоксикации продуктами распада и гнойных осложнений (С. А. Боровков, 1975; D. Lawrence, S. Dawson, 1982). Мы также разделяем мнение хирургов, полагающих, что благоприятному течению послеоперационного периода у пострадавших с тяжелой травмой печени способствуют декомпрессия желчевыводящих путей и внутрипортальная Для достижения гемостаза у 4 больных с разрывом печени нами предпринята перевязка печеночной артерии. Погибли 2: один — на операционном столе от продолжающегося диффузного кровотечения из раны печени и забрюшинного пространства, второй — через сутки после операции от синдрома массивной трансфузии; у обоих пострадавших артерия лигирована, когда кровопотеря превысила 5 л и развился гипокоагуляционный синдром. После перевязки печеночной артерии желчный пузырь во избежание некроза удаляли, а холедох дренировали по Холстеду — Пиковскому. В. С. Шапкин, Ж. А. Гриненко (1977, 1988) отрицательно относятся к перевязке печеночной артерии, считая ее порочной и вредной, как к воздействию «вслепую» — хирург должен остановить кровотечение в ране, убрать обреченные, аваскулярные участки печени, а не лишать орган артериальной крови. Однако мы перевязывали печеночную артерию именно тогда, когда остановить кровотечение прошиванием сосудов непосредственно в ране не удавалось, а также при центральном разрыве печени, причем при условии, что временное пережатие сосуда с помощью турникета приводило к прекращению или существенному уменьшению интенсивности кровотечения, а резекция печени для пострадавшего была непереносима. Допустимость такой тактики признается и другими хирургами (Т. Т. Тунг, 1973; L. Flint, H. Polk, 1979; E. Ledesma et al, 1981; Е. Moore, 1984). Наши данные не подтверждают мнения хирургов о том, что гемобилия без оперативного вмешательства неизлечима (И. 3. Козлов, 1988; G. Reinhardt, С. Hubay, 1971). У 2 из 7 больных консервативная терапия, включающая инфузию препаратов крови, содержащих факторы сгустка, оказалась эффективной, гемобилия прекратилась. Эндоваскулярное вмешательство произведено трем больным: предварительно селективной ангиогепатографией выявлялась поврежденная ветвь печеночной артерии, а затем осуществлялась ее эмболизация спиралями Гиантурко. Ранее, когда такой возможности в клинике еще не было, во время лапаротомии лигировалась соответствующая локализации внутрипечёночной гематомы ветвь артерии. Мы полностью разделяем тактику хирургов, которые не исключили из арсенала оперативных пособий по достижению гемостаза и тампонаду раны печени марлевыми салфетками (Ю. Г. Шапошников и соавт., 1986; К. К. Козлов и соавт., 1998; Е. Moore, 1984, и др.). Этот метод мы использовали при лечении 12 пострадавших с повреждениями печени 3—4-й степени тяжести в критической ситуа- ции, когда резекция органа была для больного непереносима или связана с большими техническими сложностями, а добиться гемостаза другими способами оказалось невозможным. Несомненно, данный метод гемостаза далеко не идеален. Во-первых, не всегда с его помощью удается остановить кровотечение; такая неудача постигла нас в случаях с 3 больными. Во-вторых, кровотечение может возобновиться при удалении тампонов, что мы также наблюдали у 2 больных. Наконец, сама тампонада раны печени часто сопровождается развитием тяжелых осложнений, чаще гнойных; гнойные осложнения имели место у 6 из 9 выживших больных. С учетом «теневых сторон» тампонады кровоточащей раны печени некоторые хирурги исключили ее из арсенала оперативных пособий (Н. В. Мерзликин, В. Ф. Цхай, 1997; А. Е. Борисов и соавт., 2000). Еще более категоричны В. С. Шапкин и Ж. А. Гриненко (1988), которые отказались от тампонады раны печени сальником, марлей или любыми другими материалами на том основании, что, по их данным, тампон не дает надежного гемостаза и служит закупоривающей пробкой, под которой скапливается внутриорганная гематома, а впоследствии могут возникнуть свойственные ей осложнения — вторичные кровотечения, инфекция. Однако мы не можем игнорировать тот факт, что из 12 пострадавших с профузным кровотечением из раны печени, состояние которых было критическим, 9 больным именно тампонадой марлей нам удалось обеспечить гемостаз. Уменьшить опасность развития в послеоперационном периоде воспалительного процесса можно, погружая салфетки полностью в брюшную полость, так как если даже концы салфеток и выводятся наружу, то для их удаления все равно целесообразна релапаротомия. Кроме того, во время релапаротомии представляется возможным осторожно, с меньшей тракцией удалить салфетки, что снижает риск возобновления кровотечения. Такой же точки зрения придерживаются А. А. Гринберг и соавт. (1998). Мы считаем преждевременным отказ от тампонады марлей раны печени с целью гемостаза, но ограничиваем показания к применению данного метода только критическими ситуациями. Резекция печени произведена нами 19 пострадавшим (атипичная — 13): при закрытой травме — 14 (умерли 5), огнестрельном ранении — 5 (умерли 3). О высокой летальности после резекции печени — от 19 до 70% — свидетельствуют данные многих авторов (С. Smadia et al, 1982; R. Bourgeon, 1984; Н. Bismuth et al, 1985). Поэтому мы, как и большинство хирургов (С. А. Афендулов и соавт., 1995; А. Е. Борисов и соавт., 2000, и др.), резекцию печени выполняем по строгим показаниям, каковыми являются размозжение части органа, повреждение сосудисто-секреторной ножки сегмента или доли. Оставление нежизнеспособных тканей неизбежно ведет к развитию тяжелых осложнений: секвестрации с образованием абсцессов, гемобилии, аррозивному кровотечению, сепсису. Несомненно, существенным резервом улучшения исходов резекции печени является совершенствование инструментария и аппарату- ры, которые могли бы обеспечить минимальную травматичность и кровопотерю при этом объеме вмешательства (Н. А. Ефименко, В. С. Розанов, 2000). Таким образом, объем оперативного вмешательства при травме печени должен быть строго дифференцированным и предусматривать прежде всего обеспечение гемостаза с минимальным для пострадавшего жизненным риском. При повреждениях печени 1—2-й степени тяжести адекватным вмешательством является ушивание раны; при незначительном по объему и уже остановившемся кровотечении можно ограничиться санацией и дренированием брюшной полости. У пострадавших с глубокими и размозженными ранами прошивание ткани печени «ad massam» с целью гемостаза чревато опасностью лигирования крупных сосудов и желчных протоков, вследствие чего нарушаются кровообращение и отток желчи от соответствующих сегментов печени с последующим их некрозом, секвестрацией; возможно абсцедирование, вторичное кровотечение, формирование желчных свищей, развитие сепсиса, тяжелого гепатита с исходом в острую печеночную недостаточность. При наличии такого повреждения целесообразно прошить кровоточащие сосуды и поврежденные желчные ходы непосредственно в ране печени, после чего выполняется бережная хирургическая обработка раны, ее дренирование, гепатодиафрагмопексия, декомпрессия желчевыводящих путей; лигированию сосудов в ране предшествует временный гемостаз пережатием гепатодуоденальной связки. Размозжение ткани печени, повреждение сосудисто-секреторной ножки обязывает предпринять резекцию органа. В критической ситуации может быть применена с целью гемостаза тугая тампонада раны печени марлей, однако данное пособие не следует считать завершающим этапом вмешательства; через четверо суток показана релапаротомия, во время которой тампоны осторожно извлекаются, дренируются рана печени и желчевыводящие пути, если они не были дренированы во время первичного вмешательства, а тампоны оказались пропитаны желчью. С целью гемостаза в исключительных ситуациях может применяться перевязка печеночной артерии, при условии, что лигирование поврежденных сосудов в ране печени не увенчалось успехом, а пережатие печеночной артерии с помощью турникета ведет к прекращению кровотечения из раны; после перевязки печеночной артерии желчный пузырь во избежание некроза подлежит удалению. Отсутствие эффекта от консервативной терапии гемобилии является показанием к суперселективной эмболизации поврежденных внутриорганных ветвей печеночной артерии; этот способ гемостаза менее опасен и травматичен в сравнении с перевязкой печеночной артерии и ее основных стволов. В своевременном распознавании послеоперационных осложнений травмы печени велика разрешающая способность ультразвукового исследования, компьютерной томографии, ангио-гепатографии, чресфистульной холангиографии. СПИСОК ЛИТЕРАТУРЫ Борисов А. Е., Левин Л. А., Аяганов С. А. идр. Лапароскопические операции у ранее оперированных больных. Изолированная и сочетанная травма печени: Учеб. пособие для врачей.— СПб., 2000.— 117 с. Бураков А. А., Дедерер Ю. М., Кунаковский А. В., Шель А. И. Хирургическая тактика при травмах печени // Хирургия.— 1986.— № 7.— С. 9—12. Владимирова Е. С., Абакумов М. М. Хирургическая тактика при закрытых повреждениях печени // Хирургия.— 1997.— № 5.— С. 53—57. Журавлев В. А. Большие и предельно большие резекции печени.— Саратов, 1986.— 196 с. Зайцев Е. И., Куц В. И. О перевязке печеночной артерии // Вестник хирургии,— № 10.-С. 137-142. Мариев А. И., Ревской А. К. Хирургия травм печени.— Томск, 1993.— 141 с. Мерзликин Н. В., Цхай В. Ф. Травмы печени // Хирургия печени и желчных путей/ Под ред. Б. И. Альперовича.— Томск, 1997.— С. 379—398. Николаев Г. Ф. Закрытые повреждения печени.— Л.: Медгиз, 1955.— 164 с. Новые технологии оперативного лечения очаговых поражений и травмы печени // Новые технологии в хирургической гепатологии: Матер. IIIконф. хирургов-гепатологов,- СПб., 1995. - С. 80-157. Повреждения печени // Очаговые поражения печени и гилюсные опухоли печеночных протоков // Матер. IIконф. хирургов-гепатологов.— Киров, 1994.— С. 186-197. Травма печени // Анналы хирургической гепатологии: Матер. VI Междунар. конф. хирургов-гепатологов стран СНГ.— 1998.— Т. 3.— № 3.— С. 174—211. Тунг Т. Т. Опыт лечения повреждений печени // Хирургия, 1972.— № 7.— С. 58-61. Шапкин В. С., Гриненко Ж. А. Закрытые и открытые повреждения печени.— М.: Медицина, 1977,—182 с. Шапошников Ю. Г., Решетников Е. А., Михопулос Т. А. Повреждения живота.— М.: Медицина, 1986.— 254 с. Lucas С., Walt A. Critical decisions in liver trauma. Experience bas on 604 cases // Arch. Surg.- 1970.- Vol. 10.- № 2.- P. 277-283. Eisner L., Ackermann C, Regazzoni P., Harder F. Management des Lebertraumas // Actuel. Chir.- 1989.- Vol. 24.- № 5.- P. 194-199. Smadia C, Traynor O., Blumgart L. Delayed hepatic resection for major liver injury // Brit. J. Surg.- 1982.- Vol. 69.- № 7.- P. 361-364. Wasowski J. Drainage of the common bile duct in the experimental injury to the liver // Amer. J. Surg.- 1968.- Vol. 115.- № 6.- P. 787-794. ГЛАВА 2 ПОВРЕЖДЕНИЯ ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ Повреждения желчного пузыря среди повреждений других органов брюшной полости при закрытой травме живота составляют 1,9% (Е. Farthmann, R. Kirchner, 1985). Различают ушибы желчного пузыря с интрамуральными гематомами, отрыв пузыря от печени — частичный и полный, разрывы: внутри- и внебрюшинные — в сторону печени (Г. Н. Хорев, Ю. И. Макаренко, 1976; А. С. Раренко, 1978). Возможно повреждение слизистой при целом серозном покрове, так как разрыв пузыря происходит под влиянием силы, направленной не извне, а со стороны просвета,— гидравлический удар; при этом происходит имбибиция стенки пузыря желчью; желчь может распространяться по клетчатке гепатодуоденальной связки и в забрюшинное пространство с последующим развитием перитонита, флегмоны забрюшинного пространства, стриктуры общего желчного протока (Э. И. Гальперин, Ю. М. Дедерер, 1987; О. Г. Цой и соавт., 1989). Разрывы пузыря обычно сочетаются с разрывами печени и до операции не диагностируются. При изолированном разрыве желчного пузыря с истечением желчи в свободную брюшную полость непосредственно после травмы возникает сильная боль, преимущественно в правой половине живота, возможен даже болевой шок, после чего развивается картина перитонита (М. Франк, И. Самбат-хели, 1960). Однако и в этой ситуации предполагается повреждение любого полого органа, но не желчного пузыря. И только во время операции устанавливается истинная причина внутрибрюшной катастрофы (И. 3. Козлов и соавт., 1988). При повреждении желчного пузыря обычно предпринимается холецистэктомия (Ю. Г. Шапошников и соавт., 1986). Пузырь удаляют даже при его ушибе из-за опасности развития посттравматического деструктивного холецистита, диагностировать который в раннем послеоперационном периоде крайне сложно (О. Г. Цой и соавт., 1989; Е. Farthmann, R. Kirchner, 1985). И все же, если разрыв пузыря небольшой, а стенка его не изменена, то считается допустимым ушивание разрыва (А. Е. Романенко, 1985; Н. В. Мерзликин, В. Ф. Цхай, 1997). При ушивании разрыва пузыря следует использовать атравматическую иглу, захватывать только серозную, мышечную оболочки и подслизистый слой, но не прокалывать стенку насквозь, чтобы нить не проникала в просвет желчного пузыря и не стала источником образования конкрементов (Э. И. Гальперин, Ю. М. Дедерер, 1987). Иногда подшивают желчный пузырь к ложу (А. С. Раренко, 1978). О разрывах внепеченочных желчных путей в литературе встречаются лишь казуистические сообщения (Е. Farthmann, R. Kirchner, 1985; P. Cavaliere et al., 1987). Чрезвычайно редко описываются и ранения внепеченочных желчных протоков. Повреждения протоков обычно сочетаются с травмой других органов брюшной полости: печени, двенадцатиперстной кишки, головки поджелудочной железы. Выявить повреждение протоков сложно даже во время оперативного вмешательства. Прокрашивание гепатодуоденальной связки желчью служит показанием к чреспузырной холангиографии или к введению в просвет пузыря раствора метиленовой сини с последующим сдавлением желчного пузыря. Однако, к сожалению, чаще повреждение протоков распознается уже в послеоперационном периоде, когда через контрольный дренаж, установленный под печенью, выделяется желчь. Уровень повреждения желчных протоков уточняется ультразвуковым исследованием, эндоскопической ретроградной панкреатохолангиографией, чрескожной чреспеченочной холангиографией, фистулохолангиографией (А. С. Ермолов и соавт., 2000). Хирургическая тактика при нарушении целостности внепеченочных желчных путей, возникшей при травме живота, особенно вследствие проникающих ранений и ятрогенных интраоперационных повреждений протоков, не имеет принципиальных отличий. Поэтому мы решили учесть также и опыт хирургов по коррекции повреждений в случаях травмы желчных путей при выполнении холецистэктомии, резекции желудка. Несомненно, на объеме оперативного вмешательства при травме живота не может не сказаться тяжесть состояния пострадавшего, обусловленная кровопотерей, повреждением других органов брюшной полости и анатомических областей. Лечебная тактика зависит от характера, уровня, протяженности повреждения протоков, времени, прошедшего с момента травмы. При полном перерыве гепатикохоледоха восстановление пассажа желчи обычно предпринимается в первые 24 ч с момента травмы; в более поздние сроки, когда уже картина перитонита отчетлива, ограничиваются наружным дренированием протока, а если это не удается, то дренируют только подпеченочное пространство (Н. А. Майстренко и соавт., 2000; А. В. Упырев, 2000; В. Л. Хальзов и соавт., 2000). М. В. Данилов и соавт. (1996) акцентируют внимание хирургов на важности реконструктивной операции с целью восстановления желчеоттока во время первичного вмешательства, так как если упустить эту возможность, то благоприятные условия для наложения билиодигестивного анастомоза возникнут не ранее, чем через 3 мес после травмы. Кроме того, по данным Н. А. Тогонидзе и соавт. (1996), больным, которым уже была сделана попытка восстановления целостности протоков или наложения билиодигестивного анастомоза, технически легче выполнить повторную реконструкцию; ограничение вмешательства дренированием проксимального участка желчного протока ведет к его сморщиванию и дегенеративным изменениям слизистой. М. Е. Ничитайло и А. В. Скумс (1999) являются сторонниками более ранней реконструктивной операции больным с наружными желчными свищами, а именно спустя 2—4 недели после повреждения протоков при достижении компенсации пострадавшего, так как в более поздние сроки из-за развившегося рубцово-склеротического процесса в области гепатодуоденальной связки и ворот печени затрудняется выделение неизмененных стенок желчных протоков. При краевом ранении общего желчного протока Э. И. Гальперин (2003) рекомендует наложить 1—2 прецизионных шва проленовой или викриловой нитью 5—6/0, а при ранении на '/2 диаметра ввести Т-образный дренаж через отдельное отверстие в холедохе так, чтобы его верхняя бранша проходила через поврежденную проксимальную часть протока, и на дренаже ушить место повреждения отдельными швами, причем дренаж следует держать не менее 6 мес, перекрыв горизонтальное колено трубки для восстановления пассажа желчи в двенадцатиперстную кишку. В случае выявления повреждения протока в пределах '/3 диаметра А. С. Ермолов и соавт. (2000) считают обязательным после ушивания раны дренирование холедоха вне зоны наложения швов, т. е. дистальнее. Аналогичной тактики придерживаются А. Е. Борисов и соавт. (2000); дренаж из общего желчного протока они удаляют не ранее, чем через 3 недели. При полном поперечном разрыве общего желчного протока — обычно это ретродуоденальный отдел протока — предпринимают первичный шов по типу «конец в конец» на Т-образном дренаже Кера (В. С. Шапкин, Ж. А. Гриненко, 1977; Н. В. Мерзликин, В. Ф. Цхай, 1997; P. Cavaliere et al., 1987). Между тем В. В. Виноградов (1980) считал, что показания к билиобилиарным анастомозам весьма ограничены и они должны применяться только с использованием микрохирургической техники; предпочтение он отдавал билиодигестивным соустьям. Э. И. Гальперин и Н. Ф. Кузовлев (1996) также полагают, что при «свежей» травме желчных протоков целесообразнее реконструктивная операция с наложением прецизионного желчно-кишечного анастомоза; при дренировании билиобилиарного анастомоза Т-образным дренажем очень велика вероятность рубцового стеноза соустья. Такого мнения придерживаются многие хирурги (И. Н. Гришин, В. Н. Сташевич, 1996; R. Hart et al, 2000). По их данным, восстановление пассажа желчи путем наложения холедохохоледохоанастомоза «конец в конец» обычно в среднем через 6 мес осложняется стриктурой и требуется повторная коррекция, а именно — гепатикоеюностомия. Однако, если пересеченный проток оказался малого диаметра — менее 4 мм, а хирург не имеет достаточного опыта в наложении билиодигестивных анастомозов или нет необходимого шовного материала, то в такой ситуации рациональнее двухэтапное лечение: во время первичного вмешательства следует ограничиться наружным дренированием протока, отложив реконструктивный этап на 2—3 мес (Э. И. Гальперин, 2003). При дефекте холедоха большинство хирургов накладывают анастомоз между центральным концом протока и отключенной по Ру петли кишки на сменном транспеченочном дренаже по Гетцу — Сейпол — Куриану (А. Е. Борисов и соавт., 2000; Е. Farthmann, R. Kirchner, 1985; М. Mercado et al., 2000). Применение сменного транспеченочного стентирования упрощает технику наложения анастомоза с нерасширенным протоком, уменьшает опасность стриктуры анастомоза, несостоятельности швов (Я. Н. Шойхет и соавт., 2000). В. Н. Климов и Б. М. Браташ (1983) при разрывах общего желчного протока в ретродуоденальной части советуют лигировать дистальный его отрезок и сформировать холедоходуоденоанастомоз с проксимальным отделом протока, а при размозжении части холедоха перевязать оба конца протока и наложить холецистодуоденоанастомоз. В. С. Шапкин и Ж. А. Гриненко (1977) при разрыве общего желчного протока в ретродуоденальном его отделе выполняют дуоденотомию, ретроградное дренирование холедоха со швом на дренаже; необходимость именно такой тактики авторы аргументируют сложностями поиска дистального отдела разорванного протока. О применении гепатикохоледоходуоденоанастомоза пишут и другие хирурги (Д. Л. Пиковский, 1996; С.И. Шевченко и соавт., 2000; В. Л. Хальзов и соавт., 2000). А. С. Ермолов и соавт. (2000), напротив, считают такой вид билиодигестивного соустья неоправданным, так как впоследствии развивается рефлюкс-холангит и стеноз анастомоза. Более того, по данным Я. Н. Шойхет и соавт. (2000), вполне реальна опасность холангита и при создании гепатикоеюноанастомоза на отключенной по Ру петли, если ее длина менее 50 см. Оптимальная длина отключенной по Ру петли тонкой кишки должна быть в пределах 80 см (Э. И. Гальперин, Н. Ф. Кузовлев, 1996; А. С. Ермолов и соавт., 2000). М. Е. Ничитайло, А. В. Скумс (1999) располагают опытом формирования бескаркасных желчно-кишечных анастомозов; необходимая ширина соустья достигается за счет продольного рассечения передней стенки гепатикохоледоха, а при высоких уровнях повреждения — левого или обоих долевых печеночных протоков. По поводу повреждений желчного пузыря в клинике находился на лечении 51 пострадавший: ранение получили 35 (ножевое — 30, огнестрельное — 5) человек, закрытую травму — 16. Ранение пузыря у всех пострадавших было проникающим в просвет органа. У большинства (28) были повреждены еще и другие органы — чаще печень (22), желудок (9), двенадцатиперстная кишка (8). Картина внутрибрюшной катастрофы была отчетливой, поэтому все пострадавшие оперированы в течение часа с момента госпитализации. Резаная рана желчного пузыря ушита 18 больным. Наличие сквозного ранения не было противопоказанием к органосохраняющей операции (4). Ушивание раны у 8 больных сочетали с холецистостомией; при ранении дна пузыря дренаж вводили в его просвет через уже имеющуюся рану. Осложнений после ушивания раны желчного пузыря не наблюдали. Холецистэктомию считали обоснованной при внебрюшинном — со стороны печени — ранении пузыря (5), огнестрельном ранении (5), а также в случае пропитывания желчью стенки пузыря (4) или гепатодуоденальной связки (3) — рана у этих пострадавших локализовалась в области кармана Гартмана. После холецистэктомии, предпринятой в связи с внебрюшинным ранением пузыря, для профилактики желчеистечения из ложа пузыря считаем обязательным дренирование общего желчного протока по Холстеду — Пиковскому; холедохостомию применяли и при пропитывании желчью гепатодуоденальной связки. Тяжесть повреждения желчного пузыря при закрытой травме была такой: ушиб — 3, отрыв от печени — 6 (полный — 3, частичный — 3), разрыв всех слоев — 3 (внутр Дата добавления: 2015-11-25 | Просмотры: 992 | Нарушение авторских прав |