|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Частота повреждений органов при травме живота
мя операции, как сложно и чрезвычайно важно в экстремальной обстановке быстро принять оптимальное для данного конкретного пострадавшего решение, обычно и определяющее исход вмешательства. В данной работе автор не ставил себе цель дать исчерпывающие сведения по всем вопросам этой сложной, многогранной проблемы и тем более рекомендации на все случаи жизни; изложены только основные принципы диагностики и лечебной тактики при повреждениях живота. В связи с этим хотелось бы привести высказывание классика отечественной медицины Г. А. Захарьина: «Кто усвоил метод и навык индивидуализировать, тот найдется и во всяком новом для него случае — случае, представляющем невиданные прежде особенности; а таких новых случаев всегда довольно даже для самых опытных врачей и несравненно более для начинающих: такова особенность врачебной, как и всякой другой, «практики», т. е. деятельности в реальных условиях — условиях действительности» *. Автор надеется, что его труд будет прежде всего полезен врачам, оказывающим ургентную помощь больным хирургического профиля.
ГЛАВА 1 ПОВРЕЖДЕНИЯ ПЕЧЕНИ Печень благодаря значительным размерам, нежности паренхимы, особенностям кровоснабжения, локализации и фиксации по частоте повреждения уступает только кишечнику (В. С. Шапкин, Ж. А. Гриненко, 1972; А. И. Мариев, 1977; Н. В. Мерзликин, B. Ф. Цхай, 1997). Между тем летальность при повреждениях печени C. А. Афендулов и соавт., 1995; Б. Г. Чирицо, 1995; A. Priitsc et al., 1985; L. Eisner et al, 1989). Погибшие с повреждениями печени составляют 15—20% всех погибших от травм (D. Lawrence, S. Dawson, 1982). И все же следует отметить, что данные клиницистов о частоте и исходе при закрытых травмах печени занижены, так как значительная часть пострадавших погибает на месте происшествия или во время транспортировки. Так, согласно сообщению С. В. Боровкова и С. А. Атаева (1978), из 384 пострадавших с сочетанной закрытой травмой печени 280 погибли на месте происшествия, 45 — во время транспортировки и только 58 оперированы. Согласно данным G. Mentha et al. (1988), 21,4% пострадавших с закрытой травмой печени умирают вскоре после госпитализации из-за крайней тяжести состояния и сложности распознавания на этом фоне внутрибрюшной катастрофы. Аналогичные сведения приводят А. А. Гринберг и соавт. (1998), а именно: из 363 госпитализированных оперированы 294 (ранения — 223, закрытая травма — 71), а 69 пострадавших с сочетанной травмой погибли в течение часа в отделении реанимации от травматического и геморрагического шока. Однако авторы учитывают только послеоперационную летальность, которая составила при закрытой травме 67%, ранениях — 22,8%, общая — 33,6%. Если же еще учесть погибших без оперативного вмешательства, большинство которых, очевидно, были пострадавшие с закрытой травмой, то летальность среди данного контингента оказалась бы в пределах 80%, а общая — 46,3%. Основной причиной смерти является профузное, не имеющее тенденции к самопроизвольной остановке кровотечение, тем более что у большинства пострадавших травма, полученная при транспортных происшествиях (64,5%) или при падении с высоты (20,6%), сочетанная (Е. С. Владимирова, М. М. Абакумов, 1997); лишь в 13,7% наблюдений причиной повреждения печени является удар в живот тупым предметом (А. И. Мариев, А. К. Ревской, 1993). Не являются редкостью случаи, когда из-за сложности достижения гемостаза пострадавшие погибают на операционном столе или в течение суток после операции (А. В. Русаков и соавт., 1979; М. Giacomantonio et al., 1984). Крайне неблагоприятны исходы огнестрельных ранений печени, частота которых при проникающих огнестрельных ранениях живота достигает 34,5% (А. В. Пырлик, 2001), а летальность — 46,1% (С. А. Афендулов и соавт., 1995) и даже 73,3% (А. Ю. Анисимов и соавт., 1998). Уже только в раннем послеоперационном периоде летальность от геморрагического и травматического шока и невосполненной кровопотери при огнестрельных ранениях печени составляет 29,2% (С. М. Ахмедов, Т. Г. Гильмурадов, 1995). Во многих публикациях (Б. И. Альперович, В. Б. Цхай, 1998; С. А. Гешелин и соавт., 1998; Ю. В. Бирюков и соавт., 1998; Н. Н. Милица и соавт., 1998, и др.) приводятся показатели летальности без учета характера повреждения печени, согласно которым она находится в пределах 9,2—24,9%. Улучшение исходов повреждений печени при такой «валовой» статистике кажущееся, в основном за счет пострадавших с колото-резаными ранениями органа, при которых летальность действительно значительно ниже — 1,7—7,3% (Н. П. Кондратьев и соавт., 1981; В. В. Федоровский, 1998; С. Lucas, A. Walt, 1970). В послеоперационном периоде наблюдаются тяжелые осложнения: продолжающееся кровотечение и шок, аррозивное кровотечение, желчный перитонит, посттравматический гепатит с исходом в острую печеночную недостаточность. Среди пострадавших с огнестрельными ранениями печени частота послеоперационных осложнений достигает 84,8% (М. В. Гринев и соавт., 1996). Развитие осложнений обусловлено несовершенностью гемостаза, секвестрацией ткани печени в окружности раны, желчеистечением (A. Fritsch et al., 1985). При огнестрельных ранениях ткань печени вокруг раневого канала может казаться нормальной, а позже возникает некроз с возможным инфицированием и образованием внутрипечёночного или поддиафрагмального абсцесса и аррозивным кровотечением (В. А. Журавлев, 1986). Закрытая травма вызывает разнообразные повреждения — от небольших разрывов свободного края печени до разделения органа на фрагменты с различной степенью жизнеспособности. Возможны также большие внутрипечёночные гематомы и даже отрыв печени от нижней полой вены. Предложено множество классификаций тяжести повреждений печени (И. А. Криворотов, 1949; Г. Ф. Николаев, 1955; Г. А. Баиров, А. П. Шапкина, 1970; В. С. Шапкин, Ж. А. Гриненко, 1977; Ю. Г. Шапошников, 1984; А. Е. Романенко, 1985; П. Г. Брюсов и соавт., 1994; А. С. Ермолов и соавт., 1998; J. Aldrete et al., 1979; Т. Strawn et al., 1980; J. Lenriot et al., 1984; A. Fritsch et al., 1985, и др). Отечественные хирурги чаще используют классификацию В. С. Шапкина, Ж. А. Гриненко (1977), согласно которой различают: I. Поверхностные трещины и разрывы глубиной до 2 см. II. Разрывы глубиной от 2—3 см до половины толщи органа. III. Разрывы глубиной более половины толщи органа и сквозные разрывы. IV. Размозжение частей печени или расчленение на отдельные фрагменты. Предположить повреждение печени можно на основании изучения обстоятельств травмы, жалоб пострадавшего, данных осмотра и физикального исследования. Клиника внутрибрюшного кровотечения является ведущей. Величина кровопотери зависит от тяжести травмы органа, локализации повреждения; при разрывах нижней поверхности печени из-за поверхностного расположения сегментарных сосудов отмечается более интенсивное кровотечение, нежели при разрыве купола (С. А. Боровков, 1975). При разрыве задней поверхности печени профузное кровотечение является следствием повреждения нижней полой вены или отрыва печеночных вен (А. А. Бураков и соавт., 1986). Сразу после травмы возможна кратковременная потеря сознания, иногда рвота. Пострадавших беспокоят сильные боли в верхних отделах живота, причем при разрывах нижней поверхности печени боли распространяются по направлению к пупку, а травма купола печени сопровождается иррадиацией болей в плечо и лопатку, дорзальной поверхности — в поясничную область (Г. А. Баиров, А. П. Шапкина, 1970). При осмотре пострадавшего отмечается выраженная бледность кожных покровов, а в области правой половины грудной клетки и подреберья можно выявить ссадины, гематому. Передняя брюшная стенка ограниченно участвует в дыхании. При массивном кровотечении живот вздут, пальпация болезненна, больше в правом подреберье; при перкуссии отмечается притупление в отлогих местах живота. Часто выявляются симптомы раздражения брюшины. Гемодинамика неустойчивая; необходимо учитывать даже кратковременное улучшение показателей гемодинамики под воздействием инфузионной терапии (R. McCellaid, Т. Shires, 1970). Брадикардия как классический симптом травмы печени имеет малую диагностическую ценность (М. Mercadier et al., 1972). Брадикардия при низком артериальном давлении обычно является предвестником остановки сердца (Г. А. Баиров, А. П. Шапкина, 1970). Менее отчетлива клиника постепенно нарастающего внутрибрюшного кровотечения. Диагностическую ценность может представить обзорная рентгеноскопия живота, при которой констатируется ограничение подвижности правого купола диафрагмы. Полезную информацию может дать обзорная рентгенография живота; «смазанность» нижнего контура печени и кажущееся увеличение ее размеров обычно являются следствием наличия сгустков крови в подпеченочном пространстве. Ультразвуковое исследование как скрининговый метод диагностики особенно важен для распознавания субкапсулярных и центральных гематом, контроля за течением репаративного процесса и своевременного выявления послеоперационных осложнений. Достоинствами метода, кроме высокой информативности, являются неинвазивность, доступность, мобильность оборудования, позволяющего выполнить исследование даже пострадавшим в шоковом состоянии в условиях операционной или реанимационного отделения (Н. В. Мерзликин, В. Ф. Цхай, 1997; А. Е. Борисов и соавт., 2000). Велика разрешающая способность компьютерной томографии, которую можно проводить больным со стабильными показателями гемодинамики. Это исследование позволяет выделить группу больных, при лечении которых можно ограничиться консервативной терапией или малоинвазивным вмешательством (Е. Grisoni et al., 1984; A. Meyer et al., 1985). С целью диагностики используется и сцинтиграфия (М. Giacomantonio et al., 1984), но это исследование трудоемкое и по значимости уступает компьютерной томографии и ультрасонографии (Р. Curet et al., 1984). Ангиографию в экстремальной ситуации для диагностики разрыва печени большинство хирургов не применяют, хотя ранее это практиковалось (М. К. Щербатенко и соавт., 1973; Л. С. Зингерман, Т. А. Ахадов, 1986). Напротив, при гемобилии, когда вследствие повреждения одной из ветвей печеночной артерии формируется гематома, сообщающаяся с просветом внутрипечёночного желчного протока, артериография является наиболее информативным методом исследования; более того, после уточнения локализации гематомы эта манипуляция из диагностической трансформируется в лечебную — выполняется эндоваскулярная эмболизация поврежденной ветви печеночной артерии (W. Lambeth, В. Rubin, 1979; Р. Curet et al., 1984). Классическими симптомами гемобилии являются приступы болей в правом подреберье, желтуха интермитирующего характера, кишечные кровотечения (R. Hermann, S. Hoerr, 1967). В сложных для диагностики ситуациях, особенно применительно к пострадавшим с сочетанной травмой, используется лапароцентез (А. Н. Беркутов и соавт., 1971, 1976; В. В. Тищенко, 1987; A. Fritsch et al., 1985). Несомненно, более информативна лапароскопия с применением видеоаппаратуры, позволяющая уточнить тяжесть повреждения печени и необходимую лечебную тактику, но она противопоказана при нестабильной гемодинамике, острой дыхательной недостаточности, предположении о возможном разрыве диафрагмы (Ю. В. Бирюков и соавт., 1995; А. Е. Борисов и соавт., 2000; Н. В. Лебедев и соавт., 2000). Распознанное внутрибрюшное кровотечение вследствие повреждения печени является показанием к экстренному оперативному вмешательству, даже в случае, если у пострадавшего тяжелый гемор- рагический шок. Операция противопоказана лишь при явно несовместимых с жизнью повреждениях других областей тела, которые являются ведущими в определении тяжести состояния пострадавших в сравнении с травмой печени. Специально затрачивать время на инфузионно-трансфузионную терапию с целью улучшения показателей гемодинамики не следует, так как при продолжающемся кровотечении операция является самым эффективным противошоковым мероприятием. Учитывая частый сочетанный характер травмы, перед операцией возникает необходимость в коррекции по поводу поврежденных смежных анатомических областей, в частности, дренирование плевральной полости при выявленном гемопневмотораксе, временной иммобилизации конечностей при переломах и т. д. (А. И. Мариев, 1977). Важное значение для выполнения адекватного объема вмешательства, причем в предельно сжатые сроки, имеет правильно выбранный операционный доступ. Большинство хирургов начинают операцию с верхней срединной лапаротомии. При повреждении диафрагмальной поверхности печени, задних ее отделов, срединный разрез дополняют поперечным с пересечением правой прямой мышцы (В. С. Шапкин, Ж. А. Гриненко, 1977), расширяют рану по типу «клюшки» (С. А. Афендулов и соавт., 1995), применяют торакофренолапаротомный доступ по VIII межреберью (С. А. Боровков, 1968). Между тем в этой ситуации можно ограничиться только срединным доступом, если пересечь круглую связку печени непосредственно у брюшной стенки и, подтягивая за нее вниз и влево, рассечь серповидную, треугольную и венечную связки, что позволяет «вывихнуть» печень в рану (С. А. Гешелин и соавт., 1960, 1998; Н. В. Мерзликин, В. Ф. Цхай, 1997; А. Е. Борисов и соавт., 2000). А. А. Бураков и соавт. (1986) считают целесообразным применение «комбинированного» доступа только при травме дорзальных отделов печени с повреждением печеночных вен или внутрипечёночного отдела нижней полой вены, причем первоначально они срединный разрез превращают в доступ Рио Бранка, а последний, в случае необходимости, продлевают на грудную клетку, пересекая реберную дугу. Согласованность в действиях хирурга и анестезиолога чрезвычайно важна во время операции. При интенсивном продолжающемся кровотечении хирург должен прежде всего обеспечить временный гемостаз, а анестезиолог в предельно сжатые сроки восстановить объем циркулирующей крови и стабилизировать показатели гемодинамики, после чего уже выполняется окончательный гемостаз (Н. А. Ефименко, В. Е. Розанов, 2001). Планируя объем оперативного вмешательства, хирург обязан знать состояние внутриорганных структур печени. Внешний осмотр недостаточен для суждения о тяжести повреждения органа. При глубоких разрывах и ранениях печени внутриорганные сосуды и желчные ходы могут оказаться интактными, и, напротив, целостность их может быть нарушенной при, казалось бы, незначительной травме (В. С. Шапкин, Ж. А. Гриненко, 1978; 1988; В. А. Журавлев, 1986). Поэтому нельзя оперировать «вслепую», полагаясь только на визуальную оценку поврежденной печени. С помощью операционной холангио- и ангиографии представляется возможным уточнить состояние трубчатых структур печени. Технически легче выполнить холангиографию, а информативность ее не уступает информативности ангиографии, так как желчные ходы повторяют ветвление сегментарных сосудов и обычно повреждаются одновременно с ними. Кроме того, при холангиографии отчетливо контрастируется раневой канал, что позволяет судить о его размерах и направлении (С. Д. Попов и соавт., 1980; В. А. Журавлев, 1986; М. Mercadier et al., 1972; J. Lenriot et al., 1984; M. Caron et al, 1985). При разрывах (ранениях) печени глубиной до 3 см адекватным вмешательством является наложение гемостатических швов. Рана ушивается на всю глубину, что служит профилактикой гемобилии. Применяют швы: узловой, матрацный, П-образный (А. Е. Романенко, 1978), двойной петлистый (А. И. Мариев, 1975), восьмиобразно-П-образный (Н. А. Телков и соавт., 1974), послойный (О. Б. Милонов и соавт., 1984), блоковидный (Б. И. Альперович и соавт., 1987). Для профилактики прорезывания швов многие хирурги предпочитают ушивать рану печени через сальник на питающей ножке (В. С. Шапкин, Ж. А. Гриненко, 1977; С. А. Афендулов и соавт., 1995; С. В. Лохвицкий и соавт., 1998). С этой же целью используют круглую связку печени и даже лоскут диафрагмы (С. А. Гешелин, 1998), ксеногенную брюшину (В. Н. Бордуновский, 1998). Для гемостаза, герметизации раневой поверхности печени применяют «ТахоКомб» — пластину, содержащую кроме компонентов свертывания крови еще и коллаген, а также клеевые композиции (А. Е. Ермолов и соавт., 1994; Н. А. Ефименко, В. Е. Розанов, 1998; Г. Г. Ахаладзе, 2001). Если при вскрытии брюшной полости установлено, что рана печени уже не кровоточит, то достаточно обеспечить только дренирование места повреждения; при значительных размерах раны целесообразно сблизить ее края несколькими швами (J. Amerson, H. Stone, 1970; Е. Мооrе, 1984). Уточненное лапароскопией поверхностное повреждение печени, при отсутствии продолжающегося кровотечения, позволяет ограничиться санацией брюшной полости с подведением контрольного дренажа в подпеченочное пространство (Ю. В. Бирюков и соавт., 1995, 1998; А. Е. Борисов и соавт., 1998, 2000). В последние годы расширились возможности использования ультразвукового исследования для распознавания травм паренхиматозных органов, уточнения тяжести их повреждения, объема кровопотери. Так, по данным А. С. Ермолова и соавт. (2002), ультразвуковое исследование, которое проводилось в первые сутки после травмы каждые 2 часа, позволяло своевременно распознавать накопление жидкости в брюшной полости и следить за течением репаративного процесса поврежденной ткани печени; авторы располагают опытом консервативного лечения 52 пострадавших с повреждениями печени на фоне сочетанной травмы. При выявлении глубокой, особенно размозженной, раны прошивание ее «ad massam» опасно из-за возможности лигирования внутриорганных трубчатых структур; желательно провести гемостаз непосредственно в ране, для чего необходимо предварительно добиться временной остановки кровотечения пережатием гепатодуоденальной связки с помощью турникета, сосудистого зажима или сжатием пальцами. Допустимые сроки пережатия связки в условиях нормотермии — от 10—15 мин (А. Н. Беркутов, 1973; В. С. Земсков и соавт., 1985) до 30 мин (В. А. Журавлев, 1972; С. А. Шалимов и соавт., 1980; S. Роlliсе et al., 1985). Гипотермия путем обкладывания печени мешочками со льдом улучшает прогноз пережатия и дает возможность продлить время обескровливания (В. С. Шапкин и соавт., 1971, Е. В. Якубовский, 1971). Такой же эффект обеспечивают стероидные гормоны (R. Grundman, Н. Pichimaier, 1983). В. П. Сухоруков и соавт. (1995) при резекциях печени пережимали гепатодуоденальную связку до 60 мин, но при этом считали обязательным инфузионный «подпор» реополиглюкином. Если В. С. Шапкин и соавт. (1971) рекомендуют прерывистое пережатие связки, то А. В. Муратов (1999) считает, что для печени вредны такие «гемодинамические и токсические удары». Он предложил атравматичное устройство для пережатия гепатодуоденальной связки, мелкий шаг резьбы выкручивающего винта сдавливающей бранши которого не позволяет быстро устранить окклюзию связки. И все же некоторые хирурги (А. И. Мариев, А. К. Ревской, 1993; М. В. Гринев и соавт., 1996) ограничивают время обескровливания печени всего 2—3 мин, считая, что безопаснее сдавление органа проксимальнее нахождения раны рукой, эластическим жгутом или пластинчатыми зажимами, что не вызывает последующих дегенеративных изменений паренхимы и осложнений, обусловленных стазом в портальной системе. Пережатие гепатодуоденальной связки вызывает повышение портального давления в 4—5 раз. Следствием портальной гипертензии являются субсерозные кровоизлияния и даже сливные гематомы в стенке кишечника, скопление в его просвете жидкой крови, а в свободной брюшной полости — геморрагического выпота. Нарушение гемодинамики проявляется снижением артериального давления, тахикардией, уменьшением минутного и ударного объема сердца. В экспериментах на собаках установлено, что пережатие гепатодуоденальной связки при локальной гипотермии и временном портокавальном соустье (полиэтиленовый шунт из селезеночной вены в бедренную) на 70 мин не вызывает нарушений гемодинамики и морфологии печени (Е. В. Якубовский, 1971). Для предотвращения депонирования крови в бассейне воротной вены после пережатия гепатодуоденальной связки А. Е. Борисов и соавт. (2000) разработали способ временного портокавального шунтирования, суть которого состоит в том, что берется система для забора крови и иглой на одном конце пунктируется любая крупная ветвь воротной вены — обычно правая желудочно-сальниковая, а после заполнения системы кровью иглой на противоположном ее конце пунктируют нижнюю диафрагмальную или внутреннюю подвздошную вену; завершив хирургический гемостаз, систему удаляют, а вены лигируют. Отсутствие эффекта от пережатия гепатодуоденальной связки свидетельствует о ретроградном кровотечении по лишенным клапанов печеночным венам. В такой ситуации для достижения временного гемостаза рекомендуется пережатие нижней полой вены с помощью турникетов под печенью и интраперикардиально — под правым предсердием (С. А. Гешелин, 1998). Однако, как справедливо отмечает С. А. Гешелин, успешное применение данного способа на фоне продолжающегося интенсивного кровотечения следует рассматривать как счастливую случайность. Реальнее временно остановить кровотечение сдавлением печени двумя руками, и, прижав ее к позвоночнику, что поручается ассистенту, оперирующий хирург переводит абдоминальный доступ в абдоминоторакальный по VIII межреберью; этот прием обеспечивает хирургу свободу для манипуляций в области кавальных ворот печени (J. Lenriot et al., 1984). Остановив кровотечение, выполняют щадящую, но в то же время радикальную хирургическую обработку раны — отсекают явно нежизнеспособные участки печени, связанные с основной массой органа узкой ножкой, с помощью влажной марлевой салфетки удаляют со дна раны детрит, что уменьшает в послеоперационном периоде интоксикацию продуктами распада и опасность образования абсцесса (С. А. Боровков, 1975; Ж. А. Гриненко, 1979; D. Lawrence, J. Dawson, 1982). Хирургическая обработка раны включает в себя также удаление инородных тел, прежде всего крупных металлических осколков, внедрившихся в ткань печени, оставление которых вызывает в последующем деструктивно-воспалительную и репаративные реакции, следствием которых является формирование абсцесса, а иногда и множественных абсцессов, и грубого рубца (К. А. Грачев, 1972; А. И. Чалганов, 1978). Обнаружить поврежденные желчные ходы можно при введении раствора метиленового синего в желчный пузырь или непосредственно в общий желчный проток, если пришлось выполнить холецистэктомию (А. И. Мариев, 1977; А. А. Бураков и соавт., 1986; М. Balasegaram, 1969; J. Combe et al., 1981). Даже самые мелкие поврежденные желчные протоки тщательно прошиваются атравматической иглой нерассасывающимся шовным материалом. Обработанную рану печени оставляют открытой, дренируют полихлорвиниловой трубкой и производят гепатопексию: при повреждении диафрагмальной поверхности — по Хиари — Алферову — Николаеву, когда передний край печени отдельными узловыми швами подшивается к париетальной брюшине у реберной дуги, а при повреждении дорзальной поверхности — по В. С. Шапкину; при этом задний листок брюшины подшивается к нижней поверхности печени. Оригинальный способ гемостатического шва предложили С. А. Афендулов и соавт. (1995). Суть его состоит в том, что мобилизованная прядь сальника прошивается кетгутом, после чего поэтапно прошивается печень этими же нитями со стороны дна раны на неповрежденную поверхность органа; после затягивания нитей сальник плотно фиксируется ко дну и стенкам раны. В. Н. Бордуновский (1998) при ушивании кратерообразной раны печени предварительно выстилает ее ксеногенной брюшиной, поверх которой укладывается прядь сальника. В шов захватываются края раны и ксеногенная брюшина — лигатура проводится над сальником. При завязывании лигатур сальник прижимается к пластине брюшины, благодаря чему она плотно прилегает к раневой поверхности, что способствует остановке кровотечения; кроме того, ксеногенная брюшина служит опорой для швов, предотвращая прорезывание паренхимы. Если не удается остановить кровотечение прошиванием сосудов в ране печени, можно попытаться достигнуть гемостаза перевязкой печеночной артерии или ее долевых ветвей (Л. В. Авдей, В. И. Космачев, 1973; М. Г. Урман, 1981; В. Т. Кондаков и соавт., 1989; J. Combe et al, 1981; S. Pollice et al., 1985). К такому вмешательству можно прибегнуть, предварительно убедившись, что кровотечение преимущественно артериальное, для чего необходимо временно пережать взятую на турникет печеночную артерию. Если кровотечение продолжается, то это свидетельствует о повреждении венозной системы, когда перевязка артерии противопоказана (Т. Т. Тунг, 1972; С. Couinaud, 1972; L. Flint, Н. Polk, 1979; Е. Moore, 1984). После лигирования печеночной артерии необходимо выполнить холецистэктомию, чтобы предотвратить опасность некроза желчного пузыря (Т. Т. Тунг, 1973; Е. Ledesma et al., 1981). Многие хирурги перевязку печеночной артерии считают альтернативой резекции печени (В. Т. Кондаков и соавт., 1989; S. Pollice et al., 1985, и др.). Однако этот метод гемостаза все-таки не нашел широкого распространения из-за противоречивых оценок его последствий. Е. И. Зайцев и В. И. Куц (1975) собрали в литературе описание 222 наблюдений перевязки печеночной артерии по поводу разной патологии печени с 35 летальными исходами. Считается, что чем ближе к печени перевязана артерия, тем большая вероятность нарушения кровообращения органа (Е. И. Зайцев, В. И. Куц, 1975; Н. Д. Ушаков и соавт., 1987; А. Дих и соавт., 1967). Поэтому предлагается лигировать общую печеночную артерию, но идентифицировать уровень отхождения желудочно-двенадцатиперстной артерии удается не всегда (А. И. Мариев и соавт., 1994; М. Luchtman, Е. Freire, 1974). Между тем допускается перевязка и собственной печеночной артерии (Т. Т. Тунг, 1973; А. С. Ермолов и соавт., 1994; J. Jona, 1978; К. Hockerstedt et al., 1982). Согласно мнению Т. Т. Тунга (1972), опасности, связанные с наложением лигатуры на печеночную артерию, преувеличены. При учете последствий лигирования сосуда необходимо принимать во внимание тот фон, на котором производится вмешательство в таком объеме. Длительная гипотония, тяжелая травма печени с повреждением трубчатых структур органа, исходные нарушения ее функции сами по себе могут вести к развитию в послеоперационном периоде ост- рой печеночной недостаточности (D. Ют et al., 1976; Е. Mays, 1967). И все же, решаясь на перевязку печеночной артерии, даже основного ее ствола, хирург не вправе игнорировать возможность преходящего нарушения функциональной активности печени и ишемического инфаркта органа, так как коллатеральный кровоток через систему гастродуоденальной артерии может оказаться неэффективным (А. А. Пономарев, 1990; Ph. Sandblom et al., 1984). Для профилактики гипоксии печени в раннем послеоперационном периоде рекомендуется гипербарическая оксигенация или ингаляция увлажненного кислорода (К. Hockerstedt et al., 1982). Риск вмешательства значительно уменьшается при коррекции метаболического ацидоза, восстановлении адекватной гемодинамики и терапии кровопотери (S. Роlliсе et al., 1985). При посттравматической гемобилии по эффективности гемостаза не уступает перевязке печеночной артерии эндоваскулярная эмболизация ее ветвей. Источник кровотечения предварительно уточняется артериографией, затем суперселективно катетеризируется сосуд, ответственный за кровотечение, и в него вводятся окклюзирующие «агенты»: спирали Гиантурко, «Тru Fill», «MDS», гидрогель, эмбол из губки, микронизированный висмут или производится эндобаллонная окклюзия. Преимущества данного способа гемостаза: малая травматичность, меньший риск возникновения некроза печени, минимальный отрезок времени между топической диагностикой и проведением лечебных мероприятий (В. С. Шапкин, Ж. А. Гриненко, 1988; А. Е. Борисов и соавт., 1998; Г. Е. Белозеров и соавт., 2001; D. Heimbach et al., 1978; Ph. Sandblom et al., 1984). А. С. Ермолов и соавт. (1998) считают, что показанием к ангиографическому исследованию и последующему рентгеноэндоваскулярному гемостазу является доказанное с помощью допплеровского исследования наличие признаков кровотока в полости гематомы. Отсутствие допплеровских признаков кровотока и клиники артериожелчного свища, малые размеры гематомы свидетельствуют о возможности чрескожной лечебной пункции под ультразвуковым контролем; при гематомах более 5 см выполняют чрескожное дренирование (В. А. Вишневский, А. В. Гаврилин, 1998). Есть сторонники оперативного вмешательства при внутрипечёночных разрывах с образованием полости: гематома вскрывается, осуществляется гемо- и холестаз с последующим послойным ушиванием полости (В. А. Рудаков и соавт., 1998). Сторонники этого способа гемостаза считают его более надежным, так как источником кровотечения могут быть также и поврежденные ветви воротной вены; при невозможности лигирования сосудов в полости гематомы рекомендуется резекция печени (Н. В. Мерзликин, В. Ф. Цхай, 1997). Более того, В. С. Шапкин и Ж. А. Гриненко (1974, 1988) не советуют перевязывать печеночную артерию даже при ангиографически подтвержденном повреждении одной из ее ветвей как источника гемобилии, так как при плохих коллатералях возможны некрозы, а при хороших — лигирование артерии не дает ожидаемого эффекта. В то же время в двух наблюдениях В. С. Шапкина и Ж. А. Гриненко вскрытие гематомы и попытка провести локальный гемостаз не увенчались успехом — вмешательство пришлось закончить тампонадой полости марлей; оба больных погибли. Поэтому резекцию печени авторы считают наиболее адекватной операцией при гемобилии. Однако данную точку зрения многие хирурги не разделяют (D. Heimbach et al., 1978; S. Pollice et al., 1985). К резекции печени как способу гемостаза большинство хирургов относятся сдержанно, предпочитая менее травматичные вмешательства, а если и возникает такая необходимость, то выполняют обычно атипичные — экономные, или так называемые резекции-обработки, при которых удаляется только нежизнеспособная, лишенная кровообращения и желчеоттока ткань. Границу такой резекции определяют не анатомические ориентиры, а демаркационная линия, отграничивающая участок с нарушенным питанием, отличающийся синюшностью и дряблостью (В. А. Журавлев, 1986; С. А. Гешелин, 1998; J. Lenriot et al., 1984; F. Giuliano et al., 1987). Показания к анатомической резекции печени (сегментэктомии, лобэктомии, гемигепатэктомии) возникают при массивном разрушении доли или сквозных огнестрельных ранах, проходящих по ее центру и сопровождающихся сильным кровотечением, повреждением печеночных вен, позадипеченочного отдела нижней полой вены, трубчатых структур портальной триады на сегментарном или большем уровне (В. А. Журавлев, 1986; Н. В. Мерзликин, В. Ф. Цхай, 1997; С. А. Афендулов, Б. А. Богожанов, 1998; А. Е. Борисов и соавт., 2000; С. Lucas, A. Walt, 1970; С. Smadia et al, 1982; Н. Bismuth et al., 1985). Есть сторонники расширения показаний к резекции печени при 3-й степени тяжести ее повреждения как к способу окончательного гемостаза. Так, Н. А. Ефименко и В. Е. Розанов атипичную резекцию печени произвели 44,7% пострадавшим, сегмент- или лоб-эктомию — 55,3%. Поверхность резецированного участка обрабатывают криодеструкцией, бесконтактной коагуляцией лазерным или плазменным потоком, обеспечивающими быстрый и надежный гемостаз при минимальной глубине некроза, с последующим закрытием биодеструктируемой синтетической пленкой, прядью большого сальника, пластиной «ТахоКомб» или волокнистым фибринозным клеем «Тиссукол». Выполненная по строгим показаниям резекция печени избавляет больного от опасности тяжелых послеоперационных осложнений: некроза ткани, вторичных кровотечений, формирования внутрипечёночных гнойников, гемобилии и др. (А. С. Ермолов и соавт., 1994; Н. В. Мерзликин, В. Ф. Цхай, 1997; Г. Е. Белозеров и соавт., 2001; Н. А. Ефименко, В. Е. Розанов, 2001). На сегодняшний день из арсенала оперативных пособий по достижению гемостаза при тяжелой травме печени нельзя исключить необходимость прибегнуть к тампонаде раны марлей (А. С. Ермолов и соавт., 1994; А. А. Гринберг и соавт., 1998; К. К. Козлов и соавт., 1998; Е. Moore, 1984; F. Giuliano et al., 1987). Этот способ гемостаза имеет теневые стороны: следствием тугой тампонады являются ише- мия и последующий некроз ткани в окружности раны, при удалении тампонов возможен рецидив кровотечения, в случаях повреждения внутрипечёночных желчных протоков тампоны вскоре пропитываются желчью, которая затекает и в подпеченочное пространство, что приводит к развитию перитонита (А. И. Мариев, А. К. Ревской, 1993). И все же при всех перечисленных недостатках в экстремальной ситуации — при продолжающемся профузном кровотечении, когда общепринятые меры гемостаза оказываются неэффективными, особенно у пострадавших с сочетанной травмой,— тампонада раны печени марлей может спасти больше жизней, чем резекция органа (G. Mentha et al., 1988). Тампонада находит применение при билобарной травме печени, огромной субкапсулярной гематоме, коагулопатическом кровотечении, отсутствии условий для выполнения радикальных операций — прежде всего при отсутствии опытной бригады хирургов. При этом тампонаду раны печени многие хирурги рассматривают только как временный метод остановки кровотечения, обеспечивающий возможность транспортировки пострадавшего в специализированный центр, где при необходимости ему будет оказана помощь в полном объеме — вплоть до резекции органа, т. е. реализуется принцип двухэтапного хирургического лечения травм печени (А. Н. Беркутов, 1973; Н. К. Голобородько, 1983; F. Fekete, R. Parc, 1973; С. Smadia et al., 1982). Разноречивы мнения о сроках удаления тампонов: одни хирурги удаляют тампоны постепенно, по мере их «ослизнения», с 5-го по 10-й день (R. Hermann, S. Hoerr, 1967), другие приступают к их удалению уже через двое суток (К. Lautering et al., 1987). Некоторые хирурги категорически возражают против применения этого способа остановки кровотечения, считая, что он не обеспечивает надежного гемостаза, нарастающая гематома выталкивает тампон и кровотечение рецидивирует, и, кроме того, по их мнению, марлевая тампонада всегда сопровождается гнойно-септическими осложнениями (С. А. Гешелин, 1998; А. Е. Борисов и соавт., 2000). При тяжелой травме печени часто повреждаются внутрипечёночные желчные протоки, что может привести к развитию желчного перитонита, поддиафрагмального абсцесса, желчного свища. Развитию этих осложнений способствует гипертензия в желчных ходах, неизбежно возникающая после травмы, вследствие чего пассаж желчи осуществляется по пути наименьшего сопротивления, а именно — ретроградно в рану печени, ухудшая условия ее заживления (С. Д. Попов и соавт., 1980). Поэтому большинство хирургов считают показанной при тяжелых повреждениях печени декомпрессию желчевыводящих путей (П. Н. Зубарев, С. А. Анденко, 1990; А. И. Мариев и соавт., 1995; М. В. Гринев и соавт., 1996; С. Lucas, A. Ledgerwood, 1978). Согласно сообщению J. Amerson и Н. Stone (1970), ни у кого из 31 пострадавшего, которым дренировали желчевыводящие пути, не сформировался желчный свищ. Однако дренирование тонкостенного, не расширенного общего желчного протока Т-образным дренажем, да к тому же еще в экстремальной ситуации, превращается в технически сложное вмешательство, и, кроме того, не исключается опасность рубцовой стриктуры протока в отдаленном периоде (С. Lucas, 1970; J. Aragon et al, 1974), хотя некоторые хирурги предпочитают именно такой метод дренирования (А. А. Бураков, 1986; R. Byrne, 1964; М. Mercadier et al., 1972). Гораздо проще наложить холецистостому, которая также обеспечивает адекватную разгрузку желчевыводящих путей. Таким образом, гемостаз при травме печени может осуществляться: а) в очаге повреждения (применение гемостатической губки, клеевых композиций, ушивание раны, лигирование кровоточащих сосудов в ране, тампонада раны сальником, марлей); б) перевязкой печеночной артерии или ее ветвей, а также рентгеноэндоваскулярной эмболизацией сегментарных артерий; в) резекцией печени. Выбор способа гемостаза зависит от тяжести и характера повреждения печени, состояния пострадавшего, опыта хирурга и материального обеспечения лечебного учреждения. Учитывая тяжесть состояния пострадавших, обусловленную кровопотерей, а часто еще наличием сочетанных повреждений, целесообразно ограничиться минимальным объемом вмешательства, направленным на спасение жизни больного. Наш опыт лечения повреждений печени основан на 575 наблюдениях: 401 пациент с ранениями (ножевое — 375, огнестрельное — 26), 174 пострадавших с закрытой травмой. Ранение печени оказалось изолированным у 192 (47,9%) человек. У 113 (28,2%) больных обнаружено сочетанное ранение груди, причем у 95 пострадавших оно носило торакоабдоминальный характер, а у 18 было раздельное проникающее ранение груди и живота; еще 96 (23,9%) раненых оперированы по поводу множественных повреждений органов брюшной полости. Разрыв печени оказался изолированным только у 32 (18,4%) пострадавших. Сочетанная травма других анатомических областей имела место у 124 (71,3%) человек, чаще груди (101) и головы (85). Она обычно являлась следствием автодорожных происшествий (62,8%) или падения с высоты (19,5%), тогда как изолированный разрыв печени у большинства (68,3%) пострадавших произошел из-за бытовой травмы. Диагностика повреждений печени основывалась на анализе обстоятельств травмы, жалоб пострадавшего, наличия клинической картины внутрибрюшного кровотечения, интерпретации данных физикального и инструментальных методов исследования. В состоянии шока госпитализировано 26,4% пострадавших с изолированным разрывом печени и 84,2% имевших сочетанную закрытую травму живота; превалировал (61,9%) шок III—IV степени тяжести. При изолированных ранениях печени шок наблюдали у 29,5% больных, а среди госпитализированных с торакоабдоминальным ра- нением — у 61,7%. Следует учесть, что истинная тяжесть шока у данного контингента пострадавших еще выше, так как проводимая на догоспитальном этапе инфузионная терапия способствовала улучшению показателей гемодинамики. Болевой синдром служил диагностическим подспорьем для относительно небольшого числа пострадавших с повреждениями печени. При изолированном разрыве печени на боли в правом подреберье жаловался только каждый второй больной (48,7%), а симптом Кера отмечен у 20,5% больных. При множественных повреждениях органов боль, как правило, носила «разлитой» характер. Что касается пострадавших с сочетанной травмой, то жалобы были в состоянии предъявить только 30% пострадавших. С такой же частотой (30,6%) боль в правом подреберье — самопроизвольная или при пальпации — отмечена у пострадавших с ранениями печени. Симптомы раздражения брюшины выявлены у 27,3% пострадавших с изолированным разрывом и у 23,2% — с ранением печени, а симптом Куленкампфа — соответственно у 19,1 и 4,5% больных. Большую значимость в распознавании внутрибрюшного кровотечения придавали обнаружению притупления перкуторного звука в боковых отделах живота. Однако и этот симптом не следует абсолютизировать, так как он отсутствовал у каждого третьего пострадавшего (28,1%) с кровопотерей в брюшную полость, объем которой превышал 1 л и нередко (10,4%) оказывался ложноположительным. Ценную информацию удавалось получить с помощью рентгенологического исследования — прежде всего обзорной рентгенографии груди и живота, которую выполнили 72,1% пострадавших с разрывом печени. Придавали значение наличию переломов нижних ребер справа (49,7%), высокому стоянию правого купола диафрагмы (28,5%), отсутствию четкости контуров нижнего края печени (13,1%), что свидетельствовало о наличии сгустков крови в подпеченочном пространстве. Проведение данного исследования у раненых (выполнено 37,9% больных) также чрезвычайно важно, особенно при локализации раны на груди или в проекции реберной дуги, для распознавания торакоабдоминального характера ранения и развившихся внутриплевральных осложнений, а возможно, и решения вопроса о последовательности оперативного вмешательства. Целиакогепатографию выполнили 9 пострадавшим с травмой печени (рис. 1, 2). У 3 пострадавших с клиникой гемобилии после уточнения локализации гематомы данное исследование из диагностического трансформировалось в лечебное. В экстремальной ситуации применение артериографии с целью распознавания внутрибрюшного кровотечения и тем более его источника считаем нецелесообразным; потеря драгоценного времени может оказаться невосполнимой. Хирургу прежде всего необходимо знать, следует ли экстренно оперировать пострадавшего. Этот вопрос при неотчетливой клинической картине у 49 человек решен путем лапароцентеза, а у 27 — лапароскопии. Однако, несомненно, даже осмотр печени еще не позволяет судить о сохранности ее внутриорганных структур. Между
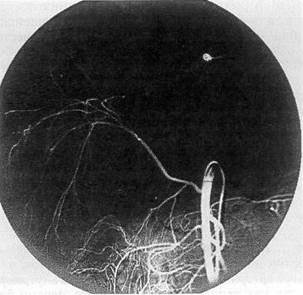
Рис. 1. Ангиогепатография больного Ф., 26 лет; артериальная фаза ветви правой печеночной артерии, отходящей от верхней брыжеечной артерии, дугообразно смещена бессосудистым образованием в правой доле печени. В поздней артериальной фазе определяется экстравазация контраста. 3x4 см. Паренхима печени контрастирована равномерно
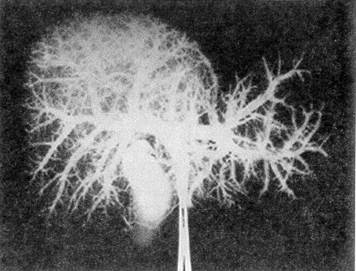
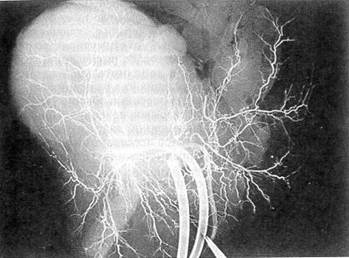
Рис. 2. Портальная система печени того же больного. Контрастирование верхней брыжеечной и воротной вен на 9—11 сек (норма). Заключение: гематома правой доли печени — IV сегмент тем без такой информации невозможно адекватное оперативное вмешательство при закрытой травме, сопровождающейся глубокими разрывами или «растрескиванием» печени, при огнестрельных ранах, колото-резаных ранениях в проекции крупных трубчатых структур органа, а также при наличии гемобилии. В таких ситуациях уже на операционном столе возникает необходимость в рентгеноконтрастном исследовании. Операционная холангиография проведена 44 пострадавшим. Обычно ограничивались чреспузырной холангиографией (32), тем более что тяжелая травма печени обязывала к наложению разгрузочной инвагинационной холецистостомы Если желчный пузырь подлежал удалению при разрывах или ранениях, проходящих через ложе пузыря, при отрывах пузыря, имбибиции его стенки желчью, а также после перевязки с целью гемостаза печеночной артерии, дренировали холедох по Холстеду — Пиковскому и контрастное вещество вводили непосредственно в общий желчный проток. Контрастирование портальной и артериальной систем изолированных препаратов печени 12 погибших подтверждает, что портография отчетливее артериографии отражает тяжесть внутриорганного повреждения, так как венозная сосудистая сеть печени более развита (рис 3, 4) Сосудистый рисунок при введении раствора контраста в воротную вену был идентичным полученному при контрастировании портальной системы через пупочную вену Поэтому у 13 пострадавших во время операции была разбужирована и катетеризирована пупочная вена. Трансумбиликальная портография позволяла судить
Рис. 3. Трансумбиликальная портограмма изолированного препарата печени
Рис. 4. Артериограмма изолированного препарата печени
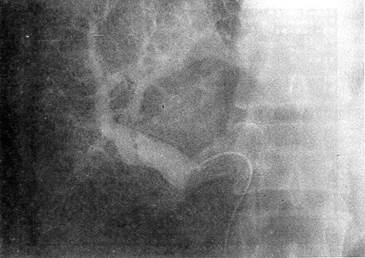
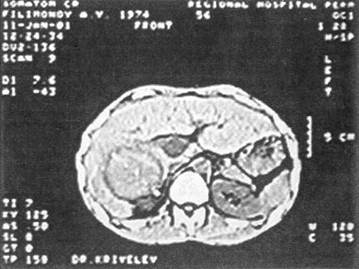
Рис. 5. Трансумбиликальная портограмма больного 3, 45 лет, оперированного 13 10 80 г по поводу разрыва печени в области VII сегмента, повреждения сегментар ной вены не выявлено о тяжести внутриорганного повреждения печени (рис. 5). В послеоперационном периоде через катетеризированную пупочную вену проводилась инфузионно-трансфузионная терапия, включая гепатотропные и антибактериальные препараты, что стимулировало репаративные процессы в ране, благоприятствовало разрешению травматического гепатита; необходимости в дополнительной катетеризации центральной вены у этих пострадавших уже не возникало. Компьютерную томографию до операции обычно применяли для распознавания субкапсулярных разрывов печени, а в послеоперационном периоде — с целью своевременной диагностики развившихся осложнений (рис. 6). Ультразвуковое исследование по разрешающей диагностической способности практически не уступало компьютерной томографии. С учетом того, что основной причиной неблагоприятного исхода травм печени является тяжелое внутрибрюшное кровотечение, своевременность вмешательства и выбор адекватного способа гемостаза приобретают особую значимость. В течение 3 ч с момента травмы госпитализировано 125 (72,1%) человек с разрывом и 335 (83,5%) с ранением печени. Высокий процент ранней госпитализации пострадавших с закрытой травмой печени объясняется не только совершенствованием службы «скорой помощи», но и тем обстоятельством, что до более поздних сроков большая часть пострадавших с разрушениями печени, возникшими
Рис 6. Компьютерная томография печени больного Ф, 26 лет Массивная подкапсульная гематома с медиальной стороны правой доли печени размером 14x9 см. Во время операции (01 02.01 г.) в области IV сегмента вскрыта гематома, содержащая около 300 г сгустков крови преимущественно при автодорожных происшествиях и падении с высоты, не доживает. Поэтому и в стационаре не тратили время на противошоковую терапию при клинике внутрибрюшного кровотечения. По мере готовности бригады хирургов к работе и до вскрытия брюшной полости в две, а иногда и в три вены осуществлялась инфузия кристаллоидных солевых и синтетических коллоидных растворов, обладающих высоким волемическим коэффициентом. При ранениях печени кровопотеря полностью компенсирована реинфузией излившейся в брюшную полость крови у 75,5% пострадавших, тогда как при разрывах — лишь у 36,9% из-за безвозвратной кровопотери при наличии сочетанных травм других анатомических областей и большей тяжести повреждения печени. Средний объем реинфузированной крови при ранениях печени составил 1,1 л, при разрывах — 3,1 л. Оптимальным доступом при повреждениях печени считаем срединную лапаротомию и никогда не дополняем ее косопоперечными разрезами. Вмешательство на VII—VIII сегментах становилось возможным после пересечения связочного аппарата печени с последующей тракцией за культю круглой связки. У 6 пострадавших с травмой области кавальных ворот, сопровождающейся массивным кровотечением, срединный разрез трансформировали в лапароторакофренотомию по VIII межреберью. Трансдиафрагмальная лапаротомия применена у 8 из 73 (11%) пострадавших с правосторонним торакоабдоминальным ранением. Объем оперативного вмешательства был обусловлен прежде всего тяжестью повреждения печени (табл. 4). У 18 из 49 пострадавших с закрытой травмой печени 1-й степени тяжести при отсутствии продолжающегося кровотечения ограничились санацией брюшной полости и дренированием подпеченочного пространства: возобновления кровотечения не наблюдали. Рана печени ушита 31 больному. Ушивание разрыва печени было основным оперативным пособием (91,7%) при 2-й степени тяжести травмы печени. Такой же объем вмешательства предпринят у 20 из 60 (33,3%) оперированных пострадавших с травмой печени 3-й степени тяжести, причем у 8 из них — в сочетании с биологической тампонадой сальником на сосудистой ножке. У 10 пострадавших с разрывами печени неправильной формы, размозжением ткани в окружности разрыва и продолжающимся интенсивным кровотечением, достигнув временного гемостаза пережатием гепатодуоденальной связки, прошивали поврежденные сосуды непосредственно в ране, после чего производили щадящую хирургическую обработку: отсекали участки печени, связанные с основной массой органа тонким мостиком ткани, влажной салфеткой удаляли детрит. В условиях «сухой» раны проверяли целостность внутрипечёночных желчных протоков. Мы считаем, что прокрашивание протоков раствором метиленовой сини имеет преимущество перед контрастной холангиографией. Операционная холангиография констатирует сам факт травмы протоков — затек контрастного вещества в рану печени, но не облегчает их по- Таблица 4 Дата добавления: 2015-11-25 | Просмотры: 735 | Нарушение авторских прав |
 * Захарьинъ Г. А Клиническiя лекцiи и избранным статьи / Под ред. В. 0. Снегире -М., 1909.- С. 3.
* Захарьинъ Г. А Клиническiя лекцiи и избранным статьи / Под ред. В. 0. Снегире -М., 1909.- С. 3.