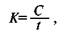|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Оперативные доступы и последовательность вмешательства при торакоабдоминальных ранениях
Таким образом, у 75,8% пострадавших с ТАР удалось ограничиться лапаротомным доступом с ушиванием раны диафрагмы со стороны брюшной полости; для устранения развившихся внутриплевральных осложнений у большинства раненых оказалось достаточным только дренирование плевральной полости. Ошибки в выборе доступа и последовательности вмешательства допущены у 11 пострадавших: у 5 больных операцию следовало начать с торакотомии, а у 6 — с лапаротомии, что позволило бы у 8 человек избежать одновременного вскрытия двух серозных полостей, уменьшив тем самым травматичность операции, а также быстрее выполнить корригирующее вмешательство при повреждении жизненно важного органа, когда дорога каждая минута. Такая критическая ситуация возникла у больного, доставленного в клинику в крайне тяжелом состоянии с наличием раны в области левой реберной дуги. Хирург, предположив, что тяжесть состояния больного обусловлена массивным внутрибрюшным кровотечением, выполнил лапаротомию, а не обнаружив внутрибрюшной катастрофы, не ушивая операционной раны, торакотомным доступом вскрыл плевральную полость; оказалось, что имеется ранение сердца, с развитием острой тампонады; восстановить работу сердца не удалось. Причиной ошибочного выбора доступа являлись не распознанный до операции торакоабдоминальный характер ранения (3), неправильная оценка тяжести повреждений органов груди и живота (8). Послеоперационный период имел осложненное течение у 62 (25,4%) больных. Наиболее частым осложнением был травматический серозно-геморрагический плеврит — у 17 человек. У всех больных плеврит был излечен плевральными пункциями. Эмпиема плевры развилась у 8 больных, из них 5 раненых первично оперированы в районах области. Оперированы двое больных: у одного эмпиема сочеталась с травматической диафрагмальной грыжей, у другого — с желчно-плевральным свищом; оба больных выздоровели. Со свернувшимся инфицированным гемотораксом оперированы трое больных, доставленных из районов области; вмешательство выполнялось на следующие сутки после госпитализации и заключалось в удалении инфицированных сгустков крови, декортикации легкого, санации и дренировании плевральной полости. Травматический серозный перикардит развился у трех больных. Больных лечили ежедневными пункциями перикарда из точки Лар-рея; количество удаляемого экссудата составляло 100—120 мл; требовалось 3—4 пункции. Грозным осложнением ТАР был перитонит, развитие которого нередко являлось следствием неадекватно выполненной коррекции поврежденных органов брюшной полости. Приводим одно из наблюдений. Больной С, 48 лет, оперирован 16 03 94 г в ЦРБ по поводу огнестрельного (пулевого) ТАР слева, с клиникой внутрибрюшного кровотечения и перитонита Во время операции установлено, что в брюшной полости около 1 л крови, имеется ранение левой доли печени, желудка, двенадцатиперстной и поперечной ободочной киш- ки, общего желчного протока, правой желудочной артерии. Ушиты раны поврежденных органов, реинфузировано 450 мл крови, перелито 1,5 л донорской крови. К концу третьих суток по дренажам стала поступать желчь. Дежурным хирургом санавиации предпринята релапаротомия. Выявлена несостоятельность швов ушитой раны двенадцатиперстной кишки; рана повторно ушита. Кроме того, обнаружено, что ниже ранее ушитой раны общего желчного протока имеется еще дефект на передней стенке протока, который был тоже ушит, наложена инвагинационная холецистостома Через двое суток, 21.03, больной доставлен в клинику. Состояние тяжелое. Интоксикационный психоз, обусловленный общим перитонитом. Через правую контрапертуру выделяется дуоденальное содержимое. Релапаротомия — 2. Обнаружены множественные межпетлевые абсцессы, скопление инфицированной желчи под печенью, несостоятельность швов ушитой раны холедоха в его супрадуоденальном отделе, а также раны двенадцатиперстной кишки — на уровне гепатодуоденальной связки и раны печеночного изгиба ободочной кишки. Двенадцатиперстная кишка пересечена ниже раны, ушивание культи открытым способом Резекция желудка, гастроэнтероанастомоз на длинной петле с межкишечным соустьем по Брауну. В рану общего желчного протока введен дренаж Кера. Сформирована колостома на месте несостоятельности швов раны ободочной кишки. Больной умер через сутки после операции В лечении раненого допущено несколько ошибок. Хотя мы и считаем, что повреждение полого органа не является абсолютным противопоказанием к реинфузии, но в данной конкретной ситуации ее применение является грубейшей ошибкой и дискредитирует метод. Далее, при огнестрельном ранении двенадцатиперстной кишки ушивание раны следовало дополнить выключением кишки из пассажа, а рану общего желчного протока ушить на Т-образном дренаже Кера; к сожалению, этого не сделано и при релапаротомии, выполненной хирургом санавиации. Из 244 лечившихся в клинике пострадавших с ТАР умерли 20 (8,2%); после ножевых ранений — 13 (5,7%), огнестрельных — 6 (27,3%). От шока и кровопотери погибли 11 человек, из них 4 — во время операции. Причиной смерти 9 больных были тяжелые гнойные осложнения: перитонит (7) и эмпиема плевры (2). Обсуждение В клинике находились на лечении 244 пострадавших с ТАР: ножевыми — 228 (93,4%), огнестрельными — 16 (6,6%). До операции торакоабдоминальный характер ранения распознан в 78,7% наблюдений, что соответствует сведениям из литературы (О. М. Авилова и соавт., 1989; Р. М. Нурмухамедов и соавт., 1998). При диагностике учитывали локализацию раны в области возможного повреждения диафрагмы, анамнез, клиническую картину, информацию, полученную на основе данных физикального, рентгенологического исследований, ревизии раневого канала; в диагностически неясных случаях применяли инструментальные методы исследования. Мы разделяем тактику хирургов (А. П. Колесов, Л. Н. Бисенков, 1986), которые при отсутствии клиники продолжающегося кровотечения в плевральную или брюшную полость, тампонады сердца проводят кратковременную предоперационную подготовку больных, включающую такие лечебные мероприятия, как герметизация раны груди, дренирование плевральной полости, обезболивание, восстановление гемодинамики адекватной инфузионной терапией, декомпрессия желудка. Критерием выбора оперативного доступа служило доминирующее повреждение. У 185 (75,8%) пострадавших лапаротомный доступ оказался достаточным для коррекции выявленных повреждений. При наличии гемопневмоторакса лапаротомии предшествовало дренирование плевральной полости. У 15 раненых продолжающееся кровотечение в плевральную полость, не устраняемый дренированием напряженный пневмоторакс явились показанием к последующей торакотомии. Лапароторакофренотомия обоснованна только при повреждении кавальных ворот печени; такой доступ применен 1 больному. 43 (17,6%) больным с ведущим симптомокомплексом повреждений органов груди операция начата с переднебоковой торакотомии по VII—VIII межреберью, а не расширением имеющейся раны груди, как это еще практикуется (М. П. Постолов и соавт., 1977; С. А. Афендулов, 1985). 29 раненым после коррекции повреждений органов груди расширили рану диафрагмы по типу трансдиафрагмальной лапаротомии, что позволило провести ревизию верхнего этажа брюшной полости и требуемый объем вмешательства 22 пострадавшим. Показаниями к последующей лапаротомии являлись перитонит, большое количество крови в животе и огнестрельный характер ранения. Необходимость в торакотомии возникла у 24,2% раненых. Для сравнения Р. М. Нурмухамедов и соавт. (1998) прибегли к торакотомии у 77,9% пострадавших, а И. П. Дуданов и соавт. (2000) считают, что «при наличии сочетанного повреждения органов грудной клетки целесообразнее одновременно с лапаротомией выполнить торакотомию». Между тем, изменение хирургической тактики при проникающих ранениях груди в пользу сберегательной, в соответствии с концепцией которой торакотомия должна выполняться только по строгим показаниям, не могла не отразиться на выборе оптимального объема вмешательства при торакоабдоминальных ранениях. Согласно данным П. Г. Брюсова (1998), при проникающих огнестрельных ранениях груди торакотомия предпринята 9,6% раненых, а при использовании видеоторакоскопии частоту торакотомий удалось снизить до 2,4%. Таким образом, при выборе оперативного доступа основным критерием должно быть выявление доминирующего повреждения. У большинства пострадавших лапаротомный доступ достаточен для коррекции полученных повреждений; наличие гемопневмоторакса обязывает к предварительному дренированию плевральной полости. Не устраняемая дренированием плевральной полости патология — прежде всего продолжающееся кровотечение, признаки повреждения крупных воздухоносных путей — является показанием к последующей торакотомии. Если в клинической картине ведущим является симптомокомплекс повреждений органов груди, а именно: большой гемоторакс, напряженный пневмоторакс или обоснованное по- дозрение на ранение сердца, то операция должна быть начата с торакотомии. После устранения обнаруженных повреждений следует расширить рану диафрагмы по типу трансдиафрагмальной лапаротомии, что позволяет провести ревизию органов верхнего этажа брюшной полости и выполнить необходимый объем вмешательства. При наличии значительного количества крови в животе, картине общего перитонита, а также пострадавшим с огнестрельным ранением после ушивания раны диафрагмы и дренирования плевральной полости показана лапаротомия. Своевременная госпитализация, адекватно проведенная противошоковая терапия во время транспортировки и в стационаре, применение эндоскопической технологии для уточнения тяжести травмы органов груди и живота, а также с целью коррекции выявленных повреждений позволят улучшить исход у пострадавших с торакоабдоминальными ранениями. СПИСОК ЛИТЕРАТУРЫ Абакумов М. М. Клиника, диагностика и лечение абдоминоторакальных ране-ний//Вестник хирургии.— 1988.— № 4.— С. 79—82. Авилова О. М., Макаров А. В., Ватлин А. В. Торакоабдоминальные ранения мирного времени // Хирургия. — 1989.— № 8.— С. 60—64. Арапов Д. А., Хорошко Н. В. Хирургическая тактика при торакоабдоминальных ранениях мирного времени // Хирургия.— 1970.— № 8.— С. 73—77. Вагнер Е. А. Хирургия повреждений груди.— М.: Медицина, 1981.— 286 с. Вагнер Е. А., Брунс В. А., Урман М. Г., Срыбных С. И. Грудобрюшные ранения.— Пермь: Изд-во Перм. ун-та, 1992.— 87 с. Чиковани О. Торакоабдоминальные ранения мирного времени.— Тбилиси: Саб-чота Сакартвело, 1967.— 218 с. Шапошников Ю. Г., Михопулос Т. А., Николаев Н. М. Хирургическая тактика при торакоабдоминальных ранениях // Хирургия.— 1985.— № 5.— С. 24—29. Moore J., Moore Е., Tompson J. Abdominal injuries associated with penetrating trauma in the lower chest // Amer. J. Surg.-1980.- Vol. 140.- № 6.- P. 724-730. Trinkle J., Grover F. Diaphragmatic injuries // The Management of Thoracic Trauma Victims (Philadelphia - Toronto).- 1980.- Vol. 20.- № 4.- P. 47-51. ГЛАВА 12 ЛЕЧЕНИЕ ОСТРОЙ КРОВОПОТЕРИ ПРИ ТРАВМЕ ЖИВОТА Среди причин смерти пострадавших с травмой живота, особенно сочетанной, наиболее частой является острая массивная кровопотеря (М. В. Гринев, Б. Н. Саламатин, 1986; А. Б. Сингалевский и соавт., 2002). Поэтому своевременное обеспечение хирургического гемостаза и адекватная терапия геморрагического шока во многом способствуют улучшению исхода травмы у данного контингента пострадавших. Целью инфузионно-трансфузионной терапии при острой кровопотере, обусловленной, в частности, повреждением паренхиматозных органов брюшной полости, является восполнение объема и состава циркулирующей крови, быстрая коррекция гемодинамических расстройств, нормализация коллоидно-осмотического давления, улучшение реологических свойств крови, профилактика агрегации ее форменных элементов и микроэмболизации капилляров, что обеспечивает восстановление тканевой перфузии — до развития необратимых изменений в органах и системах (И. Ф. Бородин и соавт., 1986). Является установленным факт, что при острой кровопотере человек погибает не от нехватки эритроцитов, депонируемых в зоне микроциркуляции, — он умирает вследствие дефицита плазменного объема и обусловленных им гемодинамических нарушений, затрудняющих нормальный транспорт эритроцитов по сосудам (В. А. Климанский, 1983; Ю. Н. Шанин, М. И. Лыткин, 1985). Продолжительность гипотензии должна быть минимальной, что позволяет предупредить развитие декомпенсированного и необратимого шока. Поэтому инфузионную терапию у пострадавших с острой кровопотерей следует начинать на месте происшествия и продолжать во время транспортировки. При массивной кровопотере инфузионно-трансфузионная терапия должна быть быстрой по темпу и многокомпонентной по составу; нет и не может быть единственного препарата для лечения массивной кровопотери (Е. А. Вагнер, В. С. Заугольников, 1986; Е. С. Золотокрылина, 1986). В качестве стартовых растворов могут использоваться и изоосмо-лярные кристаллоиды — 0,9% раствор натрия хлорида, раствор Рин-гера, дисоль. Струйная инфузия кристаллоидных растворов способна восстановить сердечный выброс. Однако достигнуть стойкого увеличения объема циркулирующей крови только за счет введения солевых растворов невозможно, так как они быстро покидают сосудистое русло. Так, через 0,5 ч в сосудистом русле остается 1/3, а через 1 ч — 1/4 перелитого раствора Рингера (Е. С. Горобец, 2001). Поэтому при наличии большой и тем более массивной кровопотери целесообразно начинать инфузию с введения коллоидных кровезаменителей, обладающих выраженными и стойкими гемодинамическими свойствами. Коллоидные растворы длительно циркулируют в сосудистом русле, поддерживают онкотическое давление и тем самым удерживают жидкость в кровеносном русле (Н. А. Кузнецов, 2003). Коллоидные растворы также превосходят кристаллоиды по способности повышать сердечный выброс и оксигенацию тканей (И. П. Назаров, Ю. С. Винник, 1999). В критических ситуациях инфузию следует проводить струйно со скоростью 250—500 мл в 1 мин, используя две-три вены, причем в одну вену вводятся коллоидные, а в другую — кристаллоидные растворы. Такой темп инфузии продолжается до достижения артериального давления 80—90 мм рт. ст. (В. А. Климанский, Л. И. Тараканова, 1986). Лечебный эффект вводимых трансфузионных сред зависит от стойкости их заместительного действия, способности поддерживать динамическое равновесие между сосудистым и интерстициальным пространствами, обеспечивать оптимальную перфузию органов и тканей (Н. И. Атясов, М. Д. Романов, 1985). Казалось бы, что с этих позиций изоосмолярные растворы малопригодны, но следует учитывать, что изоосмолярные растворы улучшают реологические свойства крови, а следовательно, микроциркуляцию. И все же если использовать только солевые растворы для лечения гиповолемии и шока при острой кровопотере, то неизбежно наступает снижение осмо-лярности плазмы, что влечет за собой интерстициальный отек, сдавливающий капилляры и снижающий эффективность капиллярного кровотока, доставку кислорода и диффузию питательных веществ в ткани (И. В. Молчанов и соавт., 1999); снижение сывороточного альбумина более чем на 50% приводит к интерстициальному отеку легких (К. М. Лисицин и соавт., 1981). Кроме того, инфузия большого объема растворов кристаллоидов снижает сократимость левого желудочка, вызывает отек миокарда, электролитный сдвиг и образование свободных радикалов (И. В. Молчанов и соавт., 1992). Инфузионно-трансфузионная терапия при острых кровотечениях зависит не только от величины кровопотери, но и от ее интенсивности, степени и стадии гемодинамических расстройств, длительности кровотечения, реактивности организма. Большинство врачей предпочитают при любых объемах кровопотери начинать трансфузию с пе- реливания коллоидных плазмозамещающих растворов реологического действия, быстро устраняющих дефицит ОЦК и улучшающих текучие свойства крови (И. П. Назаров, Ю. С. Винник, 2002). Для восстановления дефицита ОЦК и центральной гемодинамики широко и успешно используют кровезаменители на основе декстрана с ММ 60 000—80 000: полиглюкин, полиглюсоль, полифер, рондекс, неорондекс. Кровезаменители на основе декстрана обладают выраженным волемическим коэффициентом, так как увеличивают ОЦК не только на величину объема вводимого раствора, но и благодаря притоку в сосудистое русло интерстициальной жидкости. Полиглюкин — 6% раствор среднемолекулярного декстрана в 0,9% растворе натрия хлорида — обладает продолжительной циркуляцией (5 дней) в кровеносном русле, что обеспечивает постоянство притока тканевой жидкости в кровоток (Г. Т. Черненко, 1999). Устранение или уменьшение гиповолемии за счет увеличения плазменного объема создает плацдарм для коррекции кровотока в микроциркуляторном русле. После повышения артериального давления необходимо подключать реологически активные препараты (В. А. Климанский, 1983, 1986). Кровезаменители с ММ 30 000—40 000: реополиглюкин, реополиглюкин с глюкозой, реоглюман — также гиперонкотичны и при внутривенном введении существенно увеличивают объем циркулирующей крови и, кроме того, оказывают дезагрегирующее влияние на эритроциты, способствуя редепонированию крови из капиллярной системы, увеличивают диурез (Г. Т. Черненко, 1999) В то же время в больших дозировках (более 1,2 л) декстраны нежелательны, так как провоцируют развитие гипокоагуляционного синдрома; возможны аллергические реакции — вплоть до развития анафилактического шока. Введение больших количеств полиглюкина может быть причиной ошибок при определении группы крови и резус-принадлежности из-за индуцированных им панагглютина-ционных свойств сыворотки крови (А. Л. Левит и соавт., 1999; Г. Т. Черненко, 1999). Кровезаменители на основе оксиэтилкрахмала (волекам) и гидроксиэтилированного крахмала (инфузол), обладая высокой эффективностью при лечении острой кровопотери благодаря своим волемическим свойствам, сходным с полиглюкином, выгодно отличаются от последнего значительно меньшей степени тяжести побочными реакциями. Эти препараты улучшают микроциркуляцию, существенно увеличивают сердечный выброс, что приводит к значительному улучшению снабжения органов и тканей кислородом. Кроме того, добавление коллоидных растворов на основе гидроксиэтилированного крахмала к изотоническим растворам существенно продлевает длительность удержания воды и увеличения объема плазмы (И. В. Молчанов и соавт., 1999; Г. Т. Черненко, 1999). Особенно высокоэффективны растворы на основе гидроксиэтилированного крахмала второго поколения, в частности Инфукол ГЭК 6% и 10%; они не блокируют синтез белка, не оказывают побочного действия на функции иммунной и лимфоидной систем, не влияют на систему свертываемости крови (Н. А. Кузнецов, 2003). Хорошо себя зарекомендовали при лечении шока и острой кровопотери плазмозаменители на основе желатина (гелофузин, гелофун-дин), которые имеют высокое коллоидно-осмотическое давление и низкие иммуногенные свойства. Гелофузин (4% раствор модифицированного жидкого желатина) — кровезаменитель гемодинамического действия, эффективно корригирует гиповолемию, нормализует показатели центральной гемодинамики и микроциркуляции; волемическое действие препарата сохраняется 3—5 ч (желатиноля — не более 2 ч). Применение гелофузина даже в больших дозировках (1,5—3 л) не вызывает расстройств гемостаза, отсутствует риск объемной перегрузки, отека легких, гипергидратации интерстиция, быстрее восстанавливается диурез, что способствует более раннему выходу пострадавшего из шока (Р. Ф. Бакеев, 1999). Включение гелофузина в программу инфузионно-трансфузионной терапии снижает расход альбумина (В. А. Руднов, Н. С. Давыдова, 1999). Между прочим, возникли мотивированные сомнения относительно целесообразности использования альбумина в качестве коллоидного плазмозаменителя. Установлено, что при многих критических состояниях, сопровождающихся повреждением эндотелия, альбумин переходит в межклеточный сектор сосудистого русла, притягивая к себе воду, что усугубляет интерстициальный отек тканей и может спровоцировать развитие отека легких (Е. С. Горобец, 2001). Что касается свежезамороженной плазмы, то ее следует использовать только для профилактики и лечения коагулопатических кровотечений, а не как источник коллоидов, тем более что волемическое действие плазмы незначительно и непродолжительно (И. В. Молчанов и соавт., 1992, 1999). Необходимо с помощью объективных тестов контролировать адекватность проводимой инфузионно-трансфузионной терапии. Измерение центрального венозного давления не всегда достоверно отражает тяжесть гиповолемии (Е. А. Вагнер, В. С. Заугольников, 1986). Следует чаще ориентироваться еще и на такой простой и доступный метод, как катетеризация мочевого пузыря с целью определения почасового диуреза; в норме фильтрационная способность почек 1 мл/кг массы тела/ч (С. Mathewson, 1972). Контроль почасового диуреза позволяет судить о степени волемии и состоянии ренальной перфузии; снижение его менее 0,5 мл/кг массы тела/ч является надежным индикатором неадекватной инфузионно-трансфузионной терапии (И. П. Назаров, Ю. С. Винник, 2002). Учет обоих показателей позволяет более надежно корригировать темп инфузии и состав инфузионной среды. Так, если центральное венозное давление и диурез остаются низкими, то наиболее вероятна гиповолемия, что служит показанием к увеличению темпа инфузии; значительный подъем центрального венозного давления без увеличения диуреза свидетельствует о сердечной недостаточности (Е. С. Горобец, 2001). У пострадавших с сочетанной травмой живота и груди часто встречаются контузионные поражения сердца, и гиповолемия может сочетаться с миокардиальной недостаточностью. Поэтому инфузионную терапию у этих больных следует проводить под контролем гемодинамического мониторинга с помощью как неинвазивных, так и инвазивных методов исследования, что позволяет корригировать объем и состав инфузионных сред, оценивать эффективность кардиотонической терапии, предупреждать и своевременно устранять жизнеопасные осложнения — прежде всего острую сердечную недостаточность. Вести инфузионную терапию в строго ограниченном объеме заставляет также наличие у многих пострадавших ушиба легких (С. А. Плаксин, 1995). У пострадавших с сочетанной травмой живота, тяжесть состояния которых обусловлена безвозвратной кровопотерей (в мягкие ткани или наружной), а не внутрибрюшным кровотечением, что подтверждается и инструментальными методами исследования, оперативному вмешательству должна предшествовать интенсивная противошоковая терапия с полноценной компенсацией кровопотери (М. Г. Урман, 1998). Такая тактика обязательна у пострадавших с повреждениями костей таза и конечностей; им необходимо обеспечить полное восполнение ОЦК, в том числе и за счет введения в программу лечения острой кровопотери донорской эритромассы. При этом следует принимать во внимание тот факт, что в течение первых 4—6 ч после травмы анализ крови не отражает истинную тяжесть кровопотери, так как мы изучаем клеточный состав крови, оставшийся в сосудистом русле после кровотечения; эритроциты являются наиболее стабильным компонентом крови, не подверженным быстрым количественным изменениям (П. Г. Брюсов, 1986). И только по мере компенсаторного восстановления ОЦК за счет транспорта в сосуды тканевой жидкости по анализу крови можно судить об истинной тяжести постгеморрагической анемии. В эти сроки показания к трансфузии донорской эритромассы возникают при показателях: эритроциты — 2,5x1012, Hb — 70— 80 г/л, Ht — 25% (Е. С. Горобец, 2001; С. Paul et al., 1999). В то же время следует учесть, что при сохранении достаточного сердечного выброса и хорошей микроциркуляции и при более низких цифрах гемоглобина (60 г/л) снабжение тканей кислородом может быть достаточным (И. П. Назаров, Ю. С. Винник, 2002). Однако при более выраженной гемодилюции доставка кислорода к тканям заметно снижается. Напротив, у пострадавших, доставленных в стационар с клиникой продолжающегося кровотечения в брюшную, плевральную полости или в забрюшинное пространство, время на проведение противошоковой терапии не затрачивается. Больной из приемного покоя транспортируется в операционную, где инфузионная терапия продолжается параллельно с подготовкой бригады хирургов к работе. В такой ситуации оперативное вмешательство, цель которого достижение окончательного гемостаза, является самым действенным противошоковым фактором. Активная хирургическая тактика даже при критических ситуациях с развитием терминального состояния дает лучшие резуль- таты, чем выжидательная, приводящая к дальнейшей потере крови и расстройству защитных механизмов (В. И. Парменов, 1974; П. Г. Брюсов, 1986). В годы Великой Отечественной войны лапаротомия рассматривалась как элемент противошоковой терапии, срочность которой возрастала тем больше, чем тяжелее был шок (К. М. Лисицин, 1985). Необходимость немедленной операции подтверждается еще и тем обстоятельством, что при интенсивном внутреннем кровотечении обычно отсутствует эффект даже от струйного введения жидкостей или он кратковремен (С. Mathewson, 1972). Пока не выполнена лапаротомия и не решен вопрос о возможности реинфузии излившейся в брюшную полость крови, донорскую кровь переливать не следует. У 70% пострадавших с внутрибрюшным кровотечением кровопотеря может быть возмещена только за счет реинфузии (М. Г. Урман, 1993). Аутокровь имеет неоспоримые преимущества перед донорской кровью. Аутокровь является всегда готовой к применению средой, обладающей хорошим гемодинамическим действием (Е. А. Вагнер и соавт., 1977; М. М. Абакумов и соавт., 1985). Переливание аутокрови не сопровождается осложнениями, встречающимися при трансфузии донорской крови, особенно массивной и повторной, связанной с опасностью развития синдрома гомологичной крови из-за иммунологической агрессии аллогенных эритроцитов и плазменных белков, а также метаболическими нарушениями вследствие побочного действия содержащихся в консервированной крови цитрата натрия, калия, аммиака и других веществ (К. М. Лисицин, 1981; В. А. Климанский, 1983). Следует всегда помнить, что переливание донорской крови представляет собой трансплантацию живой консервированной ткани (Ю. А. Пытель и соавт., 1980), и прогнозировать реакцию больного на эту трансфузию практически невозможно (Ю. С. Гилевич, В. К. Го-беджишвили, 1981; Г. Н. Цыбуляк, М. М. Федосеев, 1985; С. И. Емельянов и соавт., 2001). Риск, связанный с гемотрансфузией, может превысить ее лечебный эффект; частота осложнений от переливания донорской крови достигает 10%, а летальный исход наблюдается в 0,1— 1% случаев (И. П. Назаров, Д. В. Островский, 2000). Наиболее часто осложнения возникают при переливании больших доз крови и при повторных трансфузиях, тем более что под наркозом невозможно проведение биологической пробы. Известны посттрансфузионные осложнения негемолитического типа, обусловленные несовместимостью тканей реципиента и донора по антигенам лейкоцитов, тромбоцитов, белков плазмы (В. Н. Шабалин, Л. Д. Серова, 1982; Т. Н. Данилова и соавт., 1986). На переливание донорской крови возникает иммуносупрессивная реакция макрофагов, что увеличивает восприимчивость организма к инфекционным осложнениям (J. Waymack, 1989); переливание эритроцитов провоцирует развитие осложнений, связанных с иммуносупрессией и нарушением микроциркуляции (С. Paul et al., 1999). Имеется риск заражения вирусным гепатитом, сифилисом, токсоплазмозом, бруцеллезом, лейшманиозом, мононуклеозом; возросла опасность заболевания ВИЧ-инфекцией (Ю. А. Пытель и соавт., 1980; Ю. Л. Шевченко, В. В. Данильченко, 1996; D. Surgenor, 1987). Риск инфицирования населения возрастает в экстремальных ситуациях. Когда поступление пострадавших массовое, допускается применение программы - минимум обследования доноров и исследования донорской крови, обеспечивающей получение крови в наикратчайший срок (А. П. Ржанович и соавт., 1996). Таким образом, переливание донорской крови является довольно опасным вмешательством, проведение которого должно основываться на очень строгих и ограниченных показаниях (С. И. Емельянов и соавт., 2001). Между тем, аутокровь содержит полный набор защитных факторов, которые «не потребляются» в реакциях взаимоотторжения, повышают сопротивляемость организма к инфекции, благоприятствуют репаративным процессам, предупреждая развитие послеоперационных осложнений (Ф. X. Кутушев и соавт., 1989). Аутокровь обладает высоким заместительным эффектом: быстрее устраняется дефицит ОЦК и послеоперационная анемия, так как собственные эритроциты больного не депонируются и функционируют в пределах их физиологического срока жизни, тогда как 25—30% перелитых донорских эритроцитов секвестрируются из циркуляции и депонируются в различных органах и тканях (Е. А. Вагнер и соавт., 1981; Н. В. Лебедев и соавт., 1985; И. Ф. Бородин и соавт., 1986; И. П. Назаров, Ю. С. Винник, 1999, 2002; S. Emminizeretal, 1981). Преимущества использования аутокрови в еще большей степени проявляются на фоне тяжелого продолжающегося кровотечения, а в условиях массового поступления пострадавших реинфузия крови может стать единственным способом лечения кровопотери. Во время боевых действий восполнение кровопотери донорской кровью ограничено из-за трудности ее доставки в лечебные учреждения передового района и сложности хранения (П. Н. Зубарев, 1986; А. Л. Левчук, 1996). Существен и экономический эффект. Кроме того, в экстремальной обстановке имеет значение упрощение организационного процесса: нет необходимости в определении групповой и резус-принадлежности, проведении проб на индивидуальную совместимость. И все же этот ценный метод лечения кровопотери во многих хирургических стационарах не применяется или к нему прибегают в исключительно редких ситуациях, продолжая считать консервированную кровь главным компонентом возмещения острой кровопотери травматического генеза. Сбор крови удобнее всего осуществлять с помощью электроотсоса, при разряжении не более 150 см водн. ст. (Л. Ф. Рачинский и соавт., 1975). Кровь аспирируют в банку от аппарата Боброва и стабилизируют раствором ЦОЛИПК-76 из расчета 50 мл на 250 мл крови или гепарином — 1000 ЕД на 1000 мл крови (Е А. Вагнер и соавт., 1977; В. А. Климанский, Я. А. Рудаев, 1984, М. Ф. Заривчацкий, 1995). Преимущество гепарина состоит в том, что его применение улучшает микроциркуляцию, предупреждает тромбоэмбо- лические осложнения, исключает цитратную интоксикацию, которая обычно развивается, если объем реинфузии превышает 3 л, так как печень не метаболизирует цитрат (И. С. Колесников и соавт., 1979; Е. А. Войновский, А. Г. Рустамов, 1986; P. Klaue, 1979). После заполнения сосуда последний передают анестезиологу, который перед аутоинфузией фильтрует кровь через воронку с 8 слоями стерильной марли, смоченной раствором ЦОЛИПК-7б. Переливание крови осуществляется через стандартную систему с фильтром. Данная методика, несомненно, уже устарела, имеет много недостатков: значительная травма форменных элементов крови, несовершенная асептика и фильтрация (Е. П. Сведенцов, 1999). Совершенствование методики реинфузии связано с созданием аппаратов, позволяющих совместить процесс сбора и возврата крови по замкнутому контуру (В. П. Сухоруков и соавт., 1991, 1996). Разработанная авторами конструкция аппарата значительно уменьшает травматизацию эритроцитов, о чем свидетельствует лишь незначительное увеличение содержания в реинфузируемой крови свободного гемоглобина; упрощается процедура возврата крови. Для сбора излившейся в серозные полости крови зарубежные фирмы выпускают аутотрансфузионные установки — так называемые СЕЛ-СЕЙВЕРЫ (CELL SAVER), позволяющие аспирировать кровь с минимальной травматизацией форменных элементов, стабилизировать, центрифугировать, разделяя на плазменную и клеточную части, а затем отмытые эритроциты возвращать больному, что обеспечивает высокий показатель гематокрита (А. И. Марчук и соавт., 1995; Н. А. Ефименко, В. Е. Розанов, 2001). Кроме того, такая техника реинфузии сводит до минимума содержание в реинфузируемой крови активированных факторов свертывания, свободного гемоглобина, продуктов деградации фибрина, вазоактивных веществ и микросгустков (Н. А. Кузнецов, 2003). Однако значительная стоимость этих аппаратов и необходимого расходного материала ограничивает их применение. Аутокровь, собранная из серозных полостей, по составу отличается от циркулирующей в сосудистом русле разрушением части эритроцитов, резким снижением количества тромбоцитов, отсутствием фибриногена при одновременном повышении ее тромбопластиче-ской и фибринолитической активности; как следствие частичного гемолиза, повышено содержание калия в плазме. Поэтому гипофиб-риногенемия типична для больных, у которых объем реинфузии превысил 3,5 л; при реинфузии переливается дефибринированная, активизированная ферментами фибринолиза кровь, что провоцирует развитие коагулопатии (Е. А. Вагнер, В. М. Тавровский, 1976; J. Glover, Т. Broadia, 1987). Риск коагулопатии потребления возрастает пропорционально количеству как аутотрансфузии, так и перелитой донорской крови (С. Kieninger, 1981). Однако если коагулопатия при реинфузии обусловлена преимущественно эффектом разведения крови больного большим объемом полостной крови, в которой отсутствует фибриноген, снижены фак- торы свертывания и фибринолиза, то при трансфузии донорской крови — развитием ДВС-синдрома (Н. В. Лебедев и соавт., 1986, 1988). После массивной реинфузии возможна также острая дыхательная недостаточность из-за накопления в микроциркуляторном русле легких агрегатов фибрина, «осколков» разрушенных эритроцитов (J. Glover, Т. Broadia, 1987). Считается, что существует два противопоказания к реинфузии: гемолиз и инфицирование излившейся в полость крови. Гемолиз реинфузируемой крови неизбежен и обусловлен не только травмой эритроцитов при аспирации и последующей фильтрации аутокрови, но и гемолизирующим действием раневой поверхности и серозных оболочек (М. Ф. Зиньковская, 1966; J. Glover, Т. Broadia, 1987). Гемолиз усиливается по мере увеличения срока от травмы до оперативного вмешательства. У пострадавших с повреждениями груди и живота реинфузия обычно проводится в первые 6 ч после травмы. В более поздние сроки показанием к реинфузии является возобновившееся по ходу вмешательства кровотечение или двухмоментный разрыв паренхиматозного органа. Гемолиз крови выявляется проведением проб Гемпеля (при наличии гемолиза после центрифугирования плазма окрашивается в розовый цвет) или И. С. Колесникова (1 мл крови разводят в 20 мл физиологического раствора, центрифугируют и проводят визуальную оценку). Для более точного суждения о степени гемолиза определяют содержание свободного гемоглобина с помощью гемоглобинометра Сали. Наименьший показатель по прибору — 2 г%. Меньшие величины гемоглобина можно обнаружить, если взять крови не 0,02, а 0,2 мл, а затем показатель гемоглобинометра уменьшить в 10 раз (Б. О. Мильков и соавт., 1982). Отношение клиницистов к возможности использования частично гемолизированной крови неоднозначно. Большинство считают это переливание безопасным (Е. А. Вагнер, В. М. Тавровский, 1976; М. М. Абакумов и соавт., 1985; С. Kieninger, 1981). Некоторые хирурги с большой осторожностью подходят к использованию такой крови, полагая, что реинфузия гемолизированной крови опасна развитием гемолитического шока, и допустимой концентрацией свободного гемоглобина считают 4—6 г/л (Б. О. Мильков и соавт., 1982; Е. П. Сведенцов, 1999) и даже 1 г/л (П. Н. Нурмедов и соавт., 1986). Чем дольше контакт излившейся в брюшную или грудную полость крови с поверхностью серозных оболочек и раневой поверхностью поврежденных органов, чем травматичнее методика сбора, фильтрации крови, тем больше выражен ее гемолиз; содержание свободного гемоглобина в крови больного будет зависеть и от объема реинфузии. М. М. Абакумов и соавт. (1985) считают, что кровь, излившаяся в брюшную или плевральную полость, стерильна и нетоксична в течение суток, хотя уровень свободного гемоглобина в ней превышал норму в 80 раз (300 мг в 100 мл крови). Через 1—2 дня после аутотрансфузии такой крови концентрация свободного гемоглобина в крови больного значительно снижается, приближаясь к нормальным величинам. Достоверных доказательств, что высокий уровень свободного гемоглобина плазмы вызывает поражение почек, нет. Гораздо важнее для предупреждения почечной недостаточности своевременное и адекватное возмещение ОЦК, устранение циркуляторной гипоксии, реологических и микроциркуляторных расстройств, ацидоза (Е. С. Золотокрылина, 1986). Во всяком случае, можно не проводить пробу на гемолиз при массивном кровотечении, если операция выполняется в первые часы после травмы, и тем более в этом нет практического смысла в условиях продолжающегося по ходу вмешательства кровотечения. Если же спросить хирурга, допустима ли реинфузия крови при нарушении целостности желудочно-кишечного тракта, то ответ, скорее всего, будет отрицательным. За этим стоит не столько знание сути проблемы, сколько стереотип мышления и привычки. Между тем, микробное загрязнение излившейся в серозные полости крови имеет место не только при повреждении полых органов, а практически при каждом проникающем ранении груди и живота (В. А. Климанский и соавт., 1984). Более того, никем не отрицается возможность инфицирования крови при плановых вмешательствах, когда, казалось бы, соблюдаются все меры асептики (И. С. Колесников и соавт., 1979). В тех же немногочисленных случаях, когда переливалась кровь, загрязненная кишечным содержимым, при ее посеве не всегда наблюдался рост микрофлоры (С. Д. Попов и соавт., 1980, 1986; Е. А. Войновский, А. Г. Арустанов, 1986; С. В. Лохвицкий и соавт., 1991). Если он все же выявлялся, то последующие посевы крови из вены реципиента роста флоры не давали (Д. А. Рыбак и соавт., 1987), а в послеоперационном периоде не возникали гнойные осложнения (В. А. Климанский, Я. А. Рудаев, 1984; Г. Л. Александрович и соавт., 1986; S. Emminizer et al., 1981), что трактуется как следствие бактерицидного действия крови (И. С. Колесников и соавт., 1979; Ю. С. Гилевич, В. К. Гобеджишвили, 1981; Э. И. Шин-каревский и соавт., 1989). Кроме того, по данным некоторых исследователей (В. Г. Петровская, О. П. Марко, 1976; А. П. Колесов и соавт., 1987), у здоровых людей микрофлора в желудке, тощей кишке и даже в проксимальном отделе подвздошной кишки либо отсутствует, либо скудна — сказываются бактерицидные свойства пищеварительных соков. При решении вопроса о целесообразности использования излившейся в брюшную полость крови при одновременном повреждении паренхиматозных и полых органов учитывают уровень и тяжесть травмы желудочно-кишечного тракта, экстремальность обстановки. Большое значение придают учету времени от момента травмы до операции, так как для больного опасность представляет не попадание в кровеносное русло бактерий, а интоксикация продуктами распада крови и микробными токсинами (Д. А. Арапов, О. А. Ставров-ская, 1970). Так, иммунизация кроликов бактериальной культурой не предупреждала осложнений, связанных с переливанием инфицированной крови, а иммунизация бактериальными токсинами умень- шала число и тяжесть этих осложнений (И. Р. Петров, В. А. Бонди-на, 1966). Некоторые хирурги прибегают к реинфузии контаминированной (бактериально-загрязненной) крови лишь пострадавшим, находящимся в терминальном состоянии (П. Н. Зубарев, С. А. Анденко, 1990). Основным же аргументом в пользу реинфузии контаминированной крови считается отсутствие достаточного количества донорской крови. Среди описанных в литературе 200 наблюдений реинфузии инфицированной крови, несомненно, значительное их количество относится к «случайным», о чем свидетельствует тот факт, что реинфузию осуществляли в объеме от 200 мл (Б. А. Рыжов, 1980; С. Д. Попов и соавт., 1986; К. Н. Цацаниди, А. И. Черепанов, 1989; С. В. Лохвицкий и соавт., 1991), хотя имеются единичные публикации, авторы которых пропагандируют данную тактику и при незначительной кровопотере (А. М. Антонов и соавт., 1995). Большинство же клиницистов считают, что реинфузия контаминированной крови оправдана только в экстремальной ситуации, которая возникает при массивном и, особенно, продолжающемся кровотечении (Я. Р. Бялик и соавт., 1986; Е. А. Вагнер и соавт., 1987; М. Г. Урман и соавт., 1989, 1997; М. П. Королев и соавт., 1996; И. А. Ерюхин, П. Г. Алисов, 1998). Не надеясь на бактерицидную активность крови, некоторые хирурги назначают большие дозы антибиотиков широкого спектра действия (В. Н. Ковалев, 1984; П. Н. Зубарев, 1986). Для очищения инфицированной крови от микробных тел и эндотоксина предлагается применять сорбционный метод (Э. И. Шинкаревич, 1989). Предельно четко по вопросу о возможности использования для реинфузии контаминированной крови высказался А. П. Зильбер (1999): «Разумеется, мы не призываем читателя пренебрегать правилами асептики, а лишь подчеркиваем достоинства реинфузии и принципиальные, практически неустранимые недостатки донорской крови». Краткий литературный экскурс свидетельствует о проявленном клиницистами интересе к реинфузии крови, контаминированной, в частности. Однако очевидно, что количество фундаментальных исследований, посвященных данной проблеме, недостаточно. Согласно проведенному анализу, кровотечение как ведущий патогенетический фактор, определяющий тяжесть состояния пострадавших, при изолированной закрытой травме живота с повреждением внутренних органов имел место в 54,6% наблюдений, а при сочетанной закрытой травме — в 77,7%. Это объясняется прежде всего тем обстоятельством, что при сочетанной закрытой травме живота паренхиматозные органы повреждались в два раза чаще, чем при изолированной травме живота, а тяжесть их повреждения была большей. Кроме того, травма смежных анатомических областей нередко сопровождалась кровотечением в плевральную полость, забрюшинное пространство, мягкие ткани конечностей или наружной кровопотерей. Поэтому от эффективности лечения острой кровопотери у пострадавших с травмой живота в значительной мере зависит исход травмы. Нами изучена эффективность реинфузии крови у 493 пострадавших с травмой живота; закрытые повреждения имели место у 248, ранения — у 245 пострадавших. Суммарная величина кровопотери в свободную брюшную полость у этих больных составила 1366,5 л, из которых реинфузировано 971,2 (77,1%). Обратное переливание крови в объеме до 1 л предпринято у 135, от 1 до 3 л — у 215, более 3 л — у 142 пострадавших. Средняя величина реинфузии на одного больного при ранениях (преимущественно колото-резаных) и закрытых травмах оказалась равной — в пределах 2 л; наибольшей она была при повреждениях крупных сосудов брюшной полости — средний объем возвращенной крови у этих пострадавших составил 4,3 л. Исследование показателей красной крови в послеоперационном периоде показало, что если внутрибрюшное кровотечение не превышало 1 л, то при изолированной закрытой травме и ранении живота одной только реинфузии достаточно для восполнения кровопотери, тогда как при сочетанной закрытой травме живота из-за безвозвратной кровопотери у 19% пострадавших требовалось переливание донорской крови. При кровопотере от 1 до 3 л частота использования донорской крови при изолированной травме живота составила 35%, а при сочетанной — 62%. Переливание донорской эритромассы при кровопотере, превышающей 3 л, считали обязательным. Это было необходимо прежде всего потому, что практически невозможно поддержать адекватную по темпу и объему реинфузию, да и часть крови при ее сборе неизбежно теряется. Кроме того, учитывали, что оставшаяся в сосудистом русле больного кровь разбавляется большим количеством дефибринированной крови, что способствует развитию гипокоагуляционного синдрома. Поэтому применяли также препараты крови, содержащие факторы сгустка (свежезамороженная плазма, криопреципитат); по жизненным показаниям и тем более при недостаточном количестве донорской эритромассы переливали «теплую» донорскую кровь. Если содержащаяся в свободной брюшной полости кровь оказывалась непригодной к реинфузии, то при дефиците ОЦК, не превышающем 20%, обходились только инфузией кристаллоидных растворов; лишь у немногих пострадавших возникла необходимость еще и в коллоидных растворах. Большая по объему кровопотеря требовала включения в программу инфузионно-трансфузионной терапии препаратов крови. При массивном внутрибрюшном кровотечении повреждение полого органа мы не считаем абсолютным противопоказанием к проведению реинфузии. Реинфузия крови при повреждении полых органов применена нами у 84 пострадавших: чаще повреждались тонкая кишка (34), желудок (25) и ободочная кишка (17), реже — двенадцатипер- стная кишка (6) и желчный пузырь (2). У 12 человек реинфузия была «случайной», т. е. аутокровь перелита до тщательной ревизии брюшной полости; объем реинфузии у этих больных не превышал 1 л. У остальных 72 пострадавших при средней кровопотере 5,2+3,5 л объем реинфузии составил 3,5±2,52 л. Источником кровотечения являлись преимущественно поврежденные сосуды (52 чел.). Большинство пострадавших оперировано в первые 3 ч с момента травмы. Несомненно, при видимой примеси кишечного содержимого кровь не использовали; осуществив временный гемостаз пальцевым прижатием кровоточащего сосуда или с помощью сосудистого зажима, санировали брюшную полость, но если и в последующем, по ходу вмешательства, кровотечение возобновлялось, то приступали к сбору крови, а решение о целесообразности реинфузии принимали с учетом тяжести кровопотери и быстроты достижения окончательного гемостаза. При оперативных вмешательствах в поздние сроки реинфузия контаминированной крови применялась лишь в ситуациях, когда кровотечение возникало после уже выполненной коррекции поврежденных полых органов и санации брюшной полости — обычно при ревизии напряженной забрюшинной гематомы, обусловленной повреждением магистрального сосуда. Бактериологические исследования контаминированной крови проведены у 22 больных; микробные культуры выделены у 8 человек. Тот факт, что не во всех посевах обнаружен рост микрофлоры, зависит прежде всего от незначительного загрязнения крови. Согласно нашим данным, при ножевых ранениях различных отделов желудочно-кишечного тракта, когда отсутствовало внутрибрюшное кровотечение и, следовательно, достоверность визуальной оценки не вызывала сомнений, содержимое желудка в свободной брюшной полости обнаружено у 11,3%, тонкой кишки — у 6,2%, ободочной — у 3,4% пострадавших. Антибактериальная терапия у больных, которым реинфузирована контаминированная кровь, не имела отличительных особенностей и тем не менее через сутки контрольный посев крови констатировал отсутствие роста микрофлоры. Нами не отмечено зависимости между реинфузией контаминированной крови и развившимися послеоперационными осложнениями, так же как между уровнем повреждения желудочно-кишечного тракта и летальностью. Так, из 25 больных с повреждением желудка, которым реинфузирована кровь, умерли 7 (28%), а из 17 с травмой ободочной кишки — 4 (23,5%). Не отмечено также возрастания летальности среди пострадавших, которым реинфузия проводилась позже 3 ч с момента травмы в связи с возобновившимся во время вмешательства кровотечением, — из 18 человек умер один. Из 27 (32,1%) умерших у 20 основной причиной смерти было тяжелое продолжающееся кровотечение, причем 15 больных умерли на операционном столе. Среди других осложнений с летальным исходом встречались: перитонит вследствие несостоятельности швов межки- шечных анастомозов (2 чел.) и ушитой раны кишки (1 чел.), аррозивное кровотечение (1 чел.), острая печеночно-почечная недостаточность и шоковое легкое (1 чел.), как следствие массивной инфузионно-трансфузионной терапии — только объем реинфузии у этой больной с множественными огнестрельными повреждениями органов брюшной полости составил 24,5 л. Отсутствие четких установок о возможности и показаниях к реинфузии контаминированной крови послужило основанием к проведению экспериментальных исследований. В этой связи представляет интерес изучение антибактериальной активности крови и функции макрофагальной системы — ведущих факторов защиты организма от инфекции. Объектом исследования служила кровь человека и лабораторных животных (линейные мыши-гибриды и крысы-самцы популяции Ви-стар). Антибактериальные свойства крови оценивали по результатам совместной инкубации с микробной тест-культурой — штамм М-17 Е. coli — при температуре 37°С. С этой целью асептически взятую кровь человека и лабораторных животных стабилизировали гепарином (2 ЕД на 1 мл), разливали по 0,05 мл в стерильный планшет для иммунологических реакций и добавляли 0,05 мл микробной взвеси (20 000 клеток на 1 мл физиологического раствора). Посев материала (0,01 мл) осуществляли на среду Левина сразу после инфицирования и спустя 1, 3, 6, 24 ч инкубации в термостате. Число выросших колоний подсчитывали через 24 ч. При анализе бактериостатического резерва крови, т. е. способности препятствовать размножению бактерий, оказалось, что у человека она сохраняется в течение 24 ч, у крыс — 6 ч, у мышей — 3 ч. Эксперименты продемонстрировали достаточно выраженные антибактериальные свойства крови in vitro, однако ни в одном случае не наблюдался эффект полного самоочищения ее от Е. coli. Значит, если кровь, загрязненную содержимым кишечника, реинфузировать, то возможна бактериемия. Закономерно возникает вопрос: насколько опасно данное явление? Представлялось, что оценка микробного клиренса — скорости выведения бактерий из кровотока — поможет дать ответ на этот вопрос. Скорость выведения бактерий из кровотока мышей (масса 16 г) оценивали на фоне различных экспериментальных воздействий. Животные были разделены на 5 групп (по 8 мышей в каждой): 1-я группа — интактные мыши; 2-я группа — неоперированные животные, которым в хвостовую вену вводили 0,1 мл микробной взвеси (50 000 бактерий); 3-я группа — животные, которым введена аналогичная микробная взвесь через 5 мин после лапаротомии; 4-я группа — мыши, у которых вызывали острую кровопотерю в объеме 0,3 мл пункцией задней полой вены, а через 5 мин после ушивания лапаротомной раны реинфузировали такое же количество свежей сингенной крови, содержащей 50 000 микробных тел; 5-я группа — животные, у которых кровопотерю возмещали консервированной в течение 8 дней при температуре 4°С сингенной кровью. Непосредственно перед инфузией кровь подогревали до 37°С и добавляли к ней такое же количество микробных тел. Животных оперировали под эфирным наркозом. Кровь для посева забирали из ретроорбитального синуса только в два срока — через 2 и 10 мин, поскольку изменение логарифма концентрации бактерий во времени имело линейный характер. С помощью уравнения регрессии первого порядка вычисляли фагоцитарный показатель (К) по формуле:
где: С — изменение логарифма концентрации бактерий в кровотоке; t — время, в течение которого произошло это изменение (В. Altura, 1980). Контролем служили 1-я и 2-я группы мышей. Выведение бактерий из кровотока неоперированных мышей протекало интенсивно (табл. 25). Через 1,5 мин число микробов в русле уменьшилось в 2 раза, а через 30 мин кровь была стерильной. Между тем, одна только лапаротомия замедлила элиминацию микробов — период полувыведения увеличился до 3,1 мин (Р<0,001). Еще большее угнетение микробного клиренса отмечено при сочетании лапаротомии с кровопотерей и последующей реинфузией — у животных с реинфузией свежей крови — до 5,1 мин, а при возмещении кон- Таблица 25 Клиренс Е. coli на фоне различных экспериментальных воздействий
сервированной крови — до 7,1 мин. Тем не менее, уже в течение 1 ч после введения бактерий в кровоток наступило полное очищение крови. Ни одно животное не погибло от сепсиса. Результаты экспериментов свидетельствуют о том, что различные хирургические вмешательства, механические повреждения угнетают функцию макрофагальной системы, причем тем значительнее, чем тяжелее травма. И все же активность макрофагальной системы, даже под влиянием депрессивных факторов, является более продуктивным механизмом защиты по сравнению с антибактериальным потенциалом крови. Так, ни в одном из наших опытов по исследованию антибактериальных свойств крови у мышей не было отмечено даже 50% снижения концентрации Е. coli в течение часа после инкубации при температуре 37°С, а если это время увеличивалось, то начинался уже процесс размножения бактерий. Между тем, у мышей, которым на фоне лапаротомии и кровопотери выполнена реинфузия, количество кишечных палочек в кровотоке уменьшилось в два раза всего за 5 мин. В отдельной серии экспериментов изучали выживаемость мышей после реинфузии крови, инфицированной Е. coli. Под эфирным наркозом 18 мышам-самцам массой 20 г выполнена срединная лапаротомия, кровопускание в объеме 0,5 мл пункцией задней полой вены. Через несколько минут после ушивания раны брюшной стенки погибли два животных. Оставшихся в живых 16 мышей разделили на две равные группы. Животным первой (контрольной) группы спустя 5 мин после окончания операции ввели в хвостовую вену 0,5 мл инкубированной в течение 6 ч стерильной сингенной крови, а животным второй группы — такое же количество крови, инкубированной с микробной культурой; в предварительных опытах было определено, что в 1 мл крови после 6 ч инкубации содержится 60 000 микробных клеток. Оказалось, что после реинфузии инфицированной крови К составил 0,239, период полувыведения — 2'9". Контрольное исследование крови через сутки уже не выявило в кровеносном русле микрофлоры. В последующие 7 дней отличительных особенностей в состоянии животных контрольной и опытной групп не отмечено. Исследовали также выживаемость мышей после реинфузии крови, загрязненной содержимым толстой кишки. У линейных мышей забирали 20 мл стерильной крови. Кровь стабилизировали гепарином и разделили в две пробирки: 10 мл стерильной крови и 10 мл крови, загрязненной содержимым толстой кишки, в соотношении 1: 10. Инфицированную кровь фильтровали через 8 слоев марли и мелкопористый фильтр от системы переливания крови. Подопытным животным (4 группы, в каждой по 8 мышей) вводили в хвостовую вену 0,2 мл инфицированной крови — сразу после фильтрации и спустя 1, 3, 6 ч после инкубации в термостате при температуре 37°С. Контрольная партия мышей (4 группы) получала в таком же количестве свежую и инкубированную в течение 1, 3, 6 ч сингенную стерильную кровь. За 5 суток наблюдения в контрольных группах умерли 2 из 32 мышей, а среди подопытных — 3 из 24 мышей после инфузии инфицированной крови, срок инкубации которой не превышал 3 ч, и все 8 мышей, которым перелита инкубированная в течение 6 ч кровь; животные погибли на 3—4-е сутки. У умерших животных проводили бактериологическое исследование органов и крови, а также микроскопию кляч-препаратов. У мышей, которым была перелита загрязненная содержимым толстой кишки кровь, инкубированная в течение 6 ч, в свободной брюшной полости обнаружен мутный выпот желтого цвета с резким гнилостным запахом, кишечник был вздут, селезенка увеличена, а под капсулой печени и в толще ее паренхимы обнаружены множественные абсцессы диаметром 1—2 мм; в посевах ткани печени, селезенки, крови и в мазках-отпечатках из органов выявлены мелкие грамотрицательные палочки, покрывающие все поле зрения (Е. coli). Иная картина наблюдалась у погибших мышей контрольных групп после инфузии инфицированной крови, инкубация которой не превышала 3 ч. В отлогих местах живота обнаруживали прозрачный, без запаха выпот, печень, селезенка были обычных размеров и цвета. В мазках и посевах отсутствовала Е. coli, т. е. смерть животных не была обусловлена воспалительным процессом. При постановке данного эксперимента для реинфузии использована кровь, загрязненность которой в десятки раз превышала загрязненность крови, реинфузируемой у пострадавших с одновременным повреждением паренхиматозных и полых органов. Однако даже после переливания такой массивно загрязненной содержимым толстой кишки крови, инкубация которой была не более 3 ч, большинство (87,5%) животных выжили, хотя никакой антибактериальной терапии им не проводили. Инфузия загрязненной содержимым толстой кишки крови 6-часового периода инкубации вызвала гибель мышей от сепсиса. Об этом свидетельствовали данные бактериоскопического, бактериологического и патологоанатомического исследований, а также время наступления смерти. Несомненно, что после переливания крови более продолжительных сроков инкубации животные погибли бы еще раньше из-за одномоментного массивного инфицирования и тяжелой интоксикации микробными токсинами и продуктами распада крови. В крови, излившейся в брюшную полость, в результате дефицита кислорода и питательных веществ снижаются обменные процессы между форменными элементами крови и плазмой, существенно меняется окислительно-восстановительный потенциал клетки. Прекращение выработки энергии аэробным путем побуждает клеточную «метаболическую машину» для сохранения эффективной работы биологических «насосов» активизировать анаэробный путь обмена. Единственным источником энергии в анаэробных условиях является гликолиз. Однако гликолиз обеспечивает лишь 1/4 количества энергии, которая требуется для поддержания мембранных процессов клет- ки (В. И. Шумаков и соавт., 1975). Следствием гипоксии является разрушение биологических мембран и накопление недоокисленных продуктов (первичных токсинов), ведущих к изменениям окружающей клетку среды (М. Я. Малахова, 2000). Следует ожидать, что при попадании в излившуюся кровь содержимого желудочно-кишечного тракта эти процессы должны усугубляться. И все же какова их тяжесть с учетом уровня повреждения желудочно-кишечного тракта, времени экспозиции? Ответа на эти вопросы в доступной литературе мы не нашли. Из-за сложности проведения клинических исследований, главным образом потому, что большинство пострадавших поступали в клинику в вечернее и ночное время, нами поставлена серия стендовых опытов с кровью экспериментальных животных — белых беспородных крыс-самцов. Исследовалась интактная кровь и кровь, смешанная с содержимым желудка, тонкой и слепой кишки в соотношении 1: 20 до и после инкубации в течение 1, 3 и 6 ч в термостате при температуре 37°С. О токсичности крови судили по содержанию «средних молекул» (Н. Е. Савченко и соавт., 1980), считающемуся универсальным маркером эндогенной интоксикации (Н. П. Макарова, И. Н. Коничева, 1995). Установлено, что инкубация интактной крови в течение 6 ч не сопровождается достоверно значимым возрастанием содержания «средних молекул» (табл. 26). Между тем, всякое изменение гомеостаза ведет к перестройке метаболического ответа и процессов энергетического обеспечения клеток крови при ее инкубации. Оказалось, что уже одно только взаимодействие крови с содержимым желудочно-кишечного тракта вызывает существенное увеличение уровня «средних молекул», пик которого отмечается через час инкубации. Этот факт свидетельствует, что повышение токсичности крови обусловлено преимущественно мембранодеструктив- Таблица 26 Содержание «средних молекул» (ед) в интактной и контаминированной крови крыс при ее инкубации
ными процессами под воздействием ферментов желудочно-кишечного тракта, а не накоплением продуктов жизнедеятельности микрофлоры. Следует отметить, что и в данной серии экспериментов количество содержимого желудочно-кишечного тракта, добавленного в кровь, несравненно выше, чем это встречается в клинике, когда решается вопрос о целесообразности реинфузии контаминированной крови. Дата добавления: 2015-11-25 | Просмотры: 698 | Нарушение авторских прав |