|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Частота повреждений органов брюшной полости у пострадавших с травмой поджелудочной железы
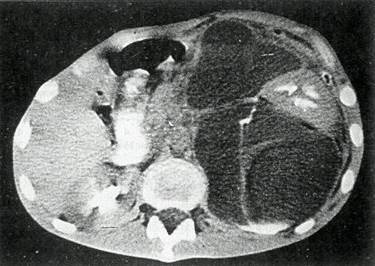
Насколько может быть сложной дифференциальная диагностика даже посттравматической кисты поджелудочной железы, свидетельствует приводимое ниже наблюдение. Больной Н., 17 лет, и. б. № 417, оперирован в ЦРБ 26.04.91 г. по поводу проникающего ножевого ранения живота. Ушито сквозное ранение поперечной ободочной кишки, желудочно-ободочной связки, наложена цекостома Вскоре после операции в левом подреберье стало определяться образование, температура в вечернее время повышалась до 38,5°С С диагнозом «поддиафрагмальный абсцесс слева» больной 10 05 переведен в клинику При осмотре отмечено, что левая половина живота «выбухает» за счет пальпируемого плотноэластической консистенции безболезненного тела, верхний полюс которого уходит в подреберье, а нижний определяется на уровне гребня подвздошной кости. Так как во время операции сальниковая сумка не ревизовалась, то казалось логичным предположение, что не было распознано ранение поджелудочной железы с последующим формированием кисты Данное заключение подтверждалось ультразвуковым исследованием и при рентгеноскопии желудка. Только при компьютерной томографии установлено, что расположенное забрюшинно образование связано с почкой, введенное внутривенно контрастное вещество из левой почки поступило в эту полость (рис 28). 31.05 больной оперирован. Люмботомия. Эвакуировано 4 л гнойной мочи Выявлено продольное сквозное ранение прилоханочного отдела мочеточника. Раны мочеточника ушиты на моделирующем катетере Выздоровление. Объем оперативного вмешательства при травме поджелудочной железы зависел от тяжести, характера ее повреждения, сроков выполнения операции. У 149 пострадавших с ушибом, «подкапсульной» гематомой, разрывом или ранением железы без повреждения Вирсунгова протока вмешательство заключалось в ретроперитоне-альной новокаиновой блокаде, которая осуществлялась введением
Рис. 28. Компьютерная томография больного Н, 17 лет. в забрюшинном пространстве слева больших размеров полость, содержащая жидкость Введенное внутривенно контрастное вещество поступает в эту полость из прилоханочного отдела мочеточника в перипанкреатическую клетчатку 0,25% раствора анестетика с добавлением антибиотиков и ингибиторов протеаз с последующим дренированием сальниковой сумки силиконовой трубкой. Швы накладывались только с целью гемостаза; использовали нерассасывающийся шовный материал на атравматичной игле. Мы убедились, что даже своевременно выполненная операция при, казалось бы, легкой тяжести травмы железы не всегда предотвращала развитие в ней деструктивного процесса. Более того, у каждого третьего больного с ушибом поджелудочной железы, оперированного позже 6 ч с момента травмы, уже обнаруживалась картина посттравматического панкреатита. В такой ситуации осуществляли «абдоми-низацию» поджелудочной железы по методу В. А. Козлова с проведением сквозного дренажа для проточного промывания растворами антисептиков. Аналогичная тактика применена у 21 пострадавшего с повреждениями поджелудочной железы 3-й степени тяжести. Однако, согласно нашим данным, ограничение объема вмешательства дренированием сальниковой сумки при полных перерывах железы может привести не только к развитию стойкого панкреатического свища, но и к увеличению риска расплавления задней стенки желудка, двенадцатиперстной кишки, возникновения аррозивного кровотечения, флегмоны забрюшинного пространства. Дистальная резекция поджелудочной железы в значительной степени предотвращает развитие перечисленных осложнений, но, несомненно, является травматичным вмешательством, тем более что обычно сопровождается спленэктомией — у 18 из 24 оперированных по поводу полного поперечного разрыва (пересечения) железы. Дистальную резекцию железы мы считаем целесообразной при перерыве железы на уровне тела или хвоста. Поэтому 16 пациентам с перерывом шейки железы создан инвагинационный анастомоз между дистальным отрезком поджелудочной железы и отключенной по Ру петлей тощей кишки по типу «конец в конец» на «потерянном» дренаже Вирсунгова протока. Конец проксимального отрезка железы прошивался П-образными швами с подведением к культе трубчатого дренажа. Такой объем операции обеспечивает сохранность не только значительной массы функционально полноценной ткани поджелудочной железы, но также и селезенки, что чрезвычайно важно, особенно у детей, иммунный статус которых еще несовершенен. Кроме того, дистальная резекция железы не исключает опасности развития панкреонекроза в ее оставшемся проксимальном сегменте. В этой ситуации, даже при благоприятном исходе заболевания, последующая полная реабилитация пострадавшего уже невозможна. Приводим одно из двух наблюдений развития деструктивного панкреатита в проксимальном отрезке железы. Больной У., 44 года, госпитализирован 10.08.92 г. через 20 ч после травмы (избит) Жалобы на интенсивные боли разлитого характера в животе, боли в груди Состояние средней тяжести. Пульс 96 уд./мин, АД 120/80 мм рт. ст. Живот вздут, напряжен Симптом Блюмберга — Щеткина положительный Выполнена срединная лапаротомия Аспирировано 500 мл гемолизированной крови. Имеется гематома брыжейки поперечной ободочной кишки. При ревизии сальниковой сумки выявлен полный поперечный разрыв поджелудочной железы на уровне шейки. Наложен дистальный панкреатоеюноанастомоз с отключенной по Ру петлей тощей кишки на «потерянном» дренаже; П-образные швы на культю проксимального сегмента, дренирована сальниковая сумка. Послеоперационный период протекал тяжело, энцефалопатия интоксикационного генеза. 22.08 повязка в области правой контрапертуры пропиталась дуоденальным содержимым. Раствор метиленовой сини, введенный через назогастральный зонд, выделился в повязку спустя два часа. Релапаротомия Выявлена деструкция головки поджелудочной железы с формированием абсцесса, «расплавлена» нисходящая ветвь двенадцатиперстной кишки. Панкреатоеюноанастомоз состоятелен Предпринята панкреатодуоденальная резекция. При этом двенадцатиперстная кишка пересечена в нижней горизонтальной части; дистальный ее конец ушит. Культя желудка анастомозирована с начальным отделом тонкой кишки (приводящая петля к межкишечному анастомозу), позади ободочной кишки. Холедох лигирован, а желчный пузырь анастомозирован с петлей тонкой кишки; дополнительное соустье по Брауну. Выписан 17.11 в удовлетворительном состоянии. Необходимым условием для создания панкреатоеюноанастомоза является отсутствие признаков панкреатита, перитонита, тяжелой кровопотери и травматического шока. Панкреатодуоденальная резекция выполнена 9 пострадавшим, причем у 6 из них уже при релапаротомии, что обусловлено не замеченным во время первичного вмешательства повреждением общего желчного протока или в связи с развившимися в послеоперационном периоде осложнениями. У 5 человек показанием к вмешательству такого объема служило сочетанное повреждение головки поджелудочной железы, двенадцатиперстной кишки и общего желчного протока, у 2 — повторная несостоятельность швов ушитого разрыва забрюшинного отдела двенадцатиперстной кишки и бесперспективность очередного ушивания раны кишки, у 1 больного — панкреонекроз с расплавлением стенки двенадцатиперстной кишки; у 1 больной с полным поперечным разрывом головки железы и интрамуральной гематомой двенадцатиперстной кишки такое расширение объема операции было необоснованно. Умерло 4 из 9 больных. По неотложным показаниям госпитализированы 12 больных с напряженной посттравматической кистой поджелудочной железы. Они оперированы в сроки от 4 до 5 недель с момента травмы из-за выраженного болевого синдрома, обусловленного быстрым ростом кисты с угрозой ее разрыва. Несмотря на ранние сроки вмешательства, у 8 оперируемых капсула кисты оказалась уже хорошо сформированной, что позволило выполнить внутреннее дренирование кисты: цистоеюноанастомоз с «заглушкой» по А. А. Шалимову над межкишечным соустьем на приводящей петле наложен 4 пострадавшим, на отключенной по Ру петле тонкой кишки — 3, цистогастроанастомоз при локализации кисты в головке железы — 1 пациенту. Приводим наблюдение. Больной П., 48 лет, поступил в клинику 6.12.86 г. с жалобами на боли в левом подреберье; 4 дня тому назад упал с крыши одноэтажного дома. Состояние удовлетворительное. Имеется умеренное напряжение мышц брюшной стенки в левом подребе-
A В Рис. 29. Рентгенограмма желудка в передней (А) и левой боковой (В) проекциях больного П., 48 лет, с посттравматической кистой поджелудочной железы: желудок оттеснен кверху, кпереди; имеется вдавление по большой кривизне рье Предположительный диагноз — «субкапсулярный разрыв селезенки». Однако при ультразвуковом исследовании брюшной полости, ангиографии селезеночной артерии патологии не было выявлено, и 16.12 больной выписан в удовлетворительном состоянии Повторная госпитализация 5.01.87 г. Беспокоят боли в животе распирающего характера, увеличение объема живота. Состояние средней тяжести, истощен Пульс 80 уд./мин, АД 120/90 мм рт. ст. Живот деформирован — передняя брюшная стенка «выбухает». Пальпируется тело плотноэластической консистенции, верхний полюс которого уходит в левое подреберье, а нижний определяется ниже пупка на 3 поперечника пальца. При рентгеноскопии желудка отмечено, что он оттеснен кпереди и сдавлен (рис. 29). Больной оперирован 7.01. Срединная лапаротомия. В свободной брюшной полости 400 мл прозрачной жидкости соломенно-желтого цвета Желудок распластан на большом теле эластической консистенции Через желудочно-ободочную связку пунктирована сальниковая сумка — аспирировано 5,5 л жидкости коричневого цвета с содержанием диастазы 3900 г/л ч. Толщина стенки кисты около 2 мм. Площадка для анастомоза выбрана у корня брыжейки поперечной ободочной кишки. Наложен цистоеюноанастомоз с межкишечным соустьем по Брауну и «заглушкой» на приводящей петле по А. А. Шалимову Выписан в удовлетворительном состоянии 20.01.87 г. У 4 больных отсутствовали условия для создания анастомоза: капсула кисты была истончена, или выявлена картина панкреатита, ферментативного перитонита. В такой ситуации ограничились марсупи-ализацией кисты. Инвагинационная холецистостома наложена 24 больным. Наружное дренирование желчевыводящих путей считаем целесообразным при тяжелой травме головки поджелудочной железы, тем более при одновременном повреждении двенадцатиперстной кишки. Послеоперационные осложнения развились у 39,7% пострадавших с закрытой травмой железы и у 24% — с ранением органа (табл. 9). Наиболее частым и патогномоничным осложнением травмы железы, несомненно, является панкреатит. Следует, однако, отметить, что при закрытой травме железы у 47 (33,3%) больных панкреатит констатирован уже во время первичного вмешательства и еще у 14 (9,9%) человек он развился в послеоперационном периоде. Между тем ни у одного раненого при первичном вмешательстве мы не выявили панкреатита, что обусловлено большими разрушениями поджелудочной железы при закрытой травме; сказываются также и сроки вмешательства. Так, если при ранениях железы в первые 6 ч с момента травмы оперированы 90,4% пострадавших, то при закрытой травме — только 35,5%. При выявлении посттравматического панкреатита во время первичного вмешательства объем операции заключался в «абдоминиза- Таблица 9 Послеоперационные осложнения при повреждениях поджелудочной железы
ции» поджелудочной железы по методу В А. Козлова, удалении явно нежизнеспособных, уже секвестрированных тканей и адекватном дренировании сальниковой сумки. Предпочтение отдавали «сквозному» дренированию силиконовой трубкой, внутренний диаметр которой составлял 1,5 см; дренаж проводился под зоной повреждения железы и выводился справа — через винсловово отверстие и далее наружу в контрапертуру по задней подмышечной линии; слева дренаж выводился на этом же уровне, для чего предварительно низводился селезеночный изгиб ободочной кишки; иногда проводили дренаж позади нисходящей кишки. При преимущественном поражении головки поджелудочной железы осуществляли мобилизацию двенадцатиперстной кишки по Кохеру, что позволяло осмотреть заднюю поверхность железы с последующей ее «абдоминизацией» и проведением сквозного дренажа, причем слева дренаж выводился через желудочно-ободочную связку и далее — через небольшой трансректальный разрез. В послеоперационном периоде круглосуточно промывали сальниковую сумку растворами антисептиков и гипохлорида натрия. По мере стихания деструктивного процесса в железе, уменьшения гнойного отделяемого проводилась смена дренажа проведением трубки меньшего диаметра. Сроки пребывания сквозного дренажа достигали 80 дней. Следует учесть, что в условиях плотного инфильтрата в зоне повреждения железы ее «абдоминизация» представляет сложную и небезопасную манипуляцию и может осложняться интенсивным, трудно останавливаемым кровотечением. Поэтому в такой ситуации ограничиваемся дренированием сальниковой сумки двумя «перекрещивающимися» в зоне повреждения поджелудочной железы дренажами. При наличии забрюшинной флегмоны дополнительное дренирование осуществляли через ложе поднадкостнично резецированного XI ребра слева, обеспечивающее наиболее короткий путь оттока гнойного отделяемого и отхождения секвестров. На фоне деструктивных форм панкреатита у 5 пострадавших возникло такое жизнеугрожающее осложнение, как аррозивное кровотечение, тактика в отношении которого была активной. Консервативная терапия дает временный эффект, возникают очередные эпизоды кровотечения, вынуждающие к экстренному оперативному вмешательству, но уже в менее благоприятных условиях. Операция заключалась в ревизии сальниковой сумки, прошивании кровоточащего сосуда, некрсеквестрэктомии, дренировании. Доступ в сальниковую сумку осуществлялся широким рассечением желудочно-ободочной связки. Следует, однако, учесть, что на фоне тяжелого воспалительного процесса связка может быть резко инфильтрирована, укорочена, и тогда большая кривизна желудка и стенка поперечной ободочной кишки не дифференцируются, вследствие чего возникает опасность их повреждения Не всегда возможен подход к поджелудочной железе и через малый сальник. В такой ситуации обоснован доступ через брыжейку поперечной ободочной кишки, хотя он и не позволяет хорошо осмотреть поджелудочную железу, а широкое рас- сечение брыжейки невозможно — необходимо остерегаться травмы средней ободочной артерии. И все-таки именно этим доступом нам удалось при повторной релапаротомии достигнуть гемостаза у больного с аррозивным кровотечением. В другом наблюдении на фоне панкреонекроза развилась острая язва двенадцатиперстной кишки, осложненная профузным кровотечением. Операция заключалась в дуоденотомии, прошивании кровоточащего сосуда в язве задней стенки двенадцатиперстной кишки. Послеоперационный период осложнился несостоятельностью швов раны кишки и рецидивом кровотечения. Выполнена резекция желудка; выздоровление. У 2 пострадавших, оперированных по поводу разрыва головки поджелудочной железы, в послеоперационном периоде возникли свищи двенадцатиперстной кишки. Комплексная консервативная терапия, включающая проведение назогастроеюнального зонда для энтерального питания, оказалась эффективной; отток дуоденального содержимого обеспечивала введенная в подпеченочное пространство силиконовая трубка. Несостоятельность панкреатоеюноанастомоза развилась на фоне панкреатита у 4 из 25 больных, перенесших такой вид вмешательства. После разобщения анастомоза у двух из них, оперированных по поводу полного поперечного разрыва железы, предпринята дистальная резекция органа, а двум больным, у которых данное осложнение возникло после панкреатодуоденальной резекции, дренирован Вирсунгов проток, т. е. сформирован панкреатический свищ; в ближайшем послеоперационном периоде от панкреонекроза, перитонита, забрюшинной флегмоны, сепсиса погибли двое. Частота релапаротомий в связи с развившейся внутрибрюшной катастрофой при разрывах и ранениях поджелудочной железы оказалась практически равной и составила соответственно 17,7 и 17,3%. Патогномоничным осложнением травмы поджелудочной железы часто является панкреатический свищ. Такое осложнение отмечено у 31 больного. План обследования включал прежде всего фистулографию, которая позволяла ответить на несколько важных для принятия решения о необходимой терапии вопросов, а именно: связан ли свищевой ход с главным протоком железы, а если связан, то на каком уровне, т. е. какая масса железы участвует в поддержании функционирующего свища, имеется ли парапанкреатическая полость? Проводилось также ультразвуковое исследование, при возможности — и компьютерная томография. Обязателен посев секрета с определением чувствительности микрофлоры к антибиотикам. При обнаружении парапанкреатической полости с секвестрами, выраженном интоксикационном синдроме из-за продолженного аутолиза поджелудочной железы или наличия забрюшинной флегмоны, значительном бактериальном загрязнении секрета предпринимали повторное оперативное вмешательство, которое заключалось в некрсеквестрэктомии, вскрытии забрюшинной флегмоны, проведении сквозного дренажа для проточного промывания саль- никовой сумки растворами антисептиков. Такой объем вмешательства потребовался 6 больным. В послеоперационном периоде проводилась интенсивная терапия панкреатита, включающая и экстракорпоральные методы детоксикации. Самопроизвольно закрылся свищ в сроки до 6 мес у 16 человек, спустя год — у 1 больного. Оперативное закрытие свища предпринято 5 больным: через 4 мес — 1 больной, 6—12 мес — 4. Всем оперированным наложен панкреатоеюноанастомоз на отключенной по Ру петле на «потерянном» дренаже. Судьба 9 человек неизвестна. Приводим наблюдение оперативного закрытия панкреатического свища. Больная К., 28 лет, госпитализирована 23.11.94 г через 4 ч с момента заболевания Резкую боль в животе, преимущественно в эпигастральной области, женщина почувствовала во время полового акта Вскоре возникла рвота, а боль «под ложечкой» стала иррадиировать в спину. Состояние больной при поступлении в клинику тяжелое Отмечает слабость, головокружение. Бледная. Пульс 52 уд./мин, АД 70/50 мм рт. ст. Живот болезнен и напряжен в эпигастральной области. Анализ крови: эритр.— 4,8х1012, Hb — 146 г/л, лейк.— 8,2х091, эоз.— 1, пал.— 5, сегм.— 75, лимф — 14, мон.— 5, СОЭ — 6 мм/ч, альфа-амилаза — 278 г/л ч. Диагностирован ушиб поджелудочной железы и назначена соответствующая терапия. Состояние больной улучшилось, хотя ее и продолжала беспокоить боль в эпигастральной области. При ультразвуковом исследовании от 25.11 констатировано, что контуры поджелудочной железы неровные, паренхима неоднородная. Эхогенная плотность железы неравномерно повышена, участок более низкой эхогенности — на границе головки и тела, Вирсунгов проток не расширен. Жидкость в сальниковой сумке не определяется. С 28.11 отчетливо пальпируется инфильтрат соответственно проекции железы. В последующие дни, несмотря на проводимую патогенетическую терапию посттравматического панкреатита, упорно держался болевой синдром, была умеренно выражена интоксикация, что послужило основанием к оперативному вмешательству, предпринятому 7.12 Срединная лапаротомия Аспирировано 400 мл геморрагической жидкости. Множественные бляшки стеатонекроза на париетальной и висцеральной брюшине. Выявлен полный перерыв поджелудочной железы по перешейку. Вирсунгов проток не визуализируется Дренирована сквозным дренажем сальниковая сумка. Сок по дренажу стал выделяться только через 5 дней после вмешательства с содержанием диастазы 62 600 г/л ч Количество теряемого сока в течение трех дней возросло с 350 до 800 мл Состояние оставалось тяжелым. 23.12 выполнена санационная релапаротомия, некрсеквестрэктомия. Проводился лаваж сальниковой сумки. Выписана в относительно удовлетворительном состоянии 9.02.95 г. Повторно госпитализирована 29 03 95 г Состояние тяжелое. Истощена. Суицидальные мысли. Кожа вокруг свища мацерирована Дренаж периодически выпадает или «забивается», что сопровождается подъемом температуры, усилением болей. Оперирована 18 04. Сальниковая сумка заращена. Обнажено место разрыва железы, расположенное в области формирования воротной вены. Краевая резекция дистального отрезка железы. Вирсунгов проток расширен до 5 мм Наложен панкреатоеюноанастомоз с отключенной по Ру петлей тощей кишки, проведенной позади поперечной ободочной кишки на «потерянном» дренаже Вирсунгова протока. Выписана 5 05 в удовлетворительном состоянии. С интервалом в 6 мес трижды проводилось контрольное обследование. Исход благоприятный, трудоспособность полностью восстановлена. Ретроспективно анализируя данное наблюдение, следует признать, что диагностика тяжести повреждения поджелудочной железы была не на высоте, что явилось причиной позднего оперативного вмешательства. Интенсивность болевого синдрома, типичная для по- врежцения железы, локализация боли, тяжесть общего состояния больной и данные ультразвукового исследования позволяли предположить, что имеется не ушиб, а разрыв поджелудочной железы. Необычный механизм травмы помешал сделать такое заключение. Несомненно, что ретроградная панкреатикография позволила бы своевременно диагностировать не только сам факт травмы поджелудочной железы, но и тяжесть ее повреждения. Это наблюдение подтверждает, что ограничение оперативного пособия при полных перерывах железы дренированием сальниковой сумки по своим последствиям непредсказуемо. Общая летальность при закрытой травме поджелудочной железы составила 18,4%, при ранениях — 20,2%. Зависимость исхода от тяжести повреждения поджелудочной железы отражена в таблице 10. Таблица 10 Зависимость исхода от тяжести повреждения поджелудочной железы
У значительного контингента пострадавших, прежде всего это касается госпитализированных с ранениями железы, основной причиной неблагоприятного исхода было неконтролируемое кровотечение из поврежденных магистральных сосудов брюшной полости и последующая выраженная коагулопатия, полиорганная недостаточность. Так, из 21 умершего с ранениями железы 16 (72,2%) погибли от кровопотери, причем 8 человек — на операционном столе и 8 — в первые сутки после операции; при закрытой травме поджелудочной железы массивное кровотечение явилось причиной смерти у 10 (38,5%) из 26 погибших. И все же, если при ранениях поджелудочной железы основной причиной смерти была тяжелая острая кровопотеря из-за поврежде- ния магистральных сосудов брюшной полости, то при закрытой травме железы — некротизирующий панкреатит и обусловленные им осложнения. Обсуждение Наша клиника располагает опытом лечения 245 пострадавших с травмой поджелудочной железы: закрытой — 141, ранений — 104, что составляет соответственно 10,7 и 4,7% всех пострадавших с повреждениями органов брюшной полости. Закрытая травма поджелудочной железы по частоте повреждения уступает только тонкой кишке, селезенке и печени, что согласуется с данными других авторов (А. Б. Молитвославов, 1994; В. А. Козлов и соавт., 2000). Ранняя диагностика повреждений поджелудочной железы возможна при изолированной закрытой травме органа, и то она сложна из-за отсутствия патогномоничных симптомов. С учетом механизма травмы, интенсивности болевого синдрома хирург может предположить наличие травмы железы и уточнить диагноз с помощью инструментальных методов диагностики, предпочтительно неинвазивных — ультразвукового и компьютерной томографии. Мы разделяем мнение ученых (М. П. Королев и соавт., 2000; J. Laborde et al., 1982; S. Calen et al., 1987), считающих определение содержания амилазы крови и диастазы мочи слабым подспорьем в диагностике. Г. И. Веронский и С. Г. Штофин (1999) объясняют этот факт угнетением функции поджелудочной железы в ранние сроки после травмы вследствие шока и отграничением процесса в сальниковой сумке. Возможно, что исследование не только амилазы, но еще и липазы крови позволило бы распознать травму поджелудочной железы у большего контингента пострадавших. И все же 36,8% пострадавших с изолированной закрытой травмой поджелудочной железы оперированы нами с уже уточненным диагнозом, тогда как, по литературным данным, это удается не более чем в 10% наблюдений (В. В. Виноградов, 1954; Б. А. Сотниченко, О. Б. Калинин, 1999). При ушибах, неполных разрывах и поверхностных ранениях железы мы, как и многие другие хирурги (А. Б. Молитвославов, 1994; А. К. Куликов и соавт., 1999), ограничиваем вмешательство дренированием сальниковой сумки; швы накладываем только с целью гемостаза. Не считаем необходимым вскрывать небольшие ненапряженные «субкапсулярные» гематомы, как это практикуется (В. Л. Хальзов, 1996; А. Н. Орлов, 1999; Ю. С. Винник и соавт., 1999). Необоснованной рекомендацией считаем и оментопанкреатопексию (Б. И. Альперович и соавт., 2002), которая не предотвращает возможность развития посттравматического панкреонекроза, а при присоединении инфекции — гнойного оментита. Более того, после данного объема вмешательства последующая санация сальниковой сумки крайне затруднительна. По нашим данным, из 36 пострадавших с ушибом поджелудочной железы у 11 развился панкреонекроз; 2 из них погибли. Поэтому и при тяжести травмы железы I степени необходимо своевременно принимать меры по профилактике этого грозного осложнения. При полном поперечном разрыве (пересечении) железы тактика зависит от многих факторов: уровня перерыва органа, наличия посттравматического панкреатита, перитонита, сочетанных повреждений, тяжести кровопотери, возраста пострадавшего и, конечно, опыта хирурга. При травме поджелудочной железы предпочтение следует отдавать органосохраняющим вмешательствам; наличие полного перерыва органа не должно быть исключением. Наиболее щадящим вмешательством является ограничение оперативного пособия дренированием сальниковой сумки. В такой ситуации некоторые исследователи считают его оптимальным (А. К. Ерамишанцев и соавт., 1995; А. Б. Мо-литвославов, А. Б. Копылов, 1996; А. В. Шабунин, 2000). По их данным, формирующиеся панкреатические свищи не представляют угрозы для жизни пострадавших, так как обычно закрываются самопроизвольно вследствие прогрессирующей атрофии и фиброза ацинарной ткани дистального сегмента железы и сужения свищевого хода, а этому способствует этапная смена дренажа на меньший по диаметру и его постепенное подтягивание. Однако, согласно сообщению А. С. Тутова и соавт. (2002), из 32 пострадавших с полным поперечным разрывом поджелудочной железы, у которых оперативное вмешательство заключалось только в различных вариантах дренирования сальниковой сумки, 12 (37,5%) умерли, а у остальных 20 больных сформировались сложные панкреатические свищи, причинявшие им большое беспокойство; оперативное лечение потребовалось 18 из них, и только у 2 свищ закрылся после консервативной терапии. В. П. Копчак и соавт. (1997) считали допустимым ограничиться консервативной терапией лишь у больных, у которых наружный панкреатический свищ не был непосредственно связан с главным протоком, количество отделяемого не превышало 300 мл и отсутствовала бактериальная обсемененность содержимого. Вся сложность ситуации заключается в том, что формирующиеся панкреатические свищи не всегда «управляемы». Как и другие хирурги (С. А. Афендулов и соавт., 1995; М. И. Гульман и соавт., 2000, и др.), при ограничении вмешательства у пострадавших с полным перерывом поджелудочной железы только дренированием зоны повреждения мы наблюдали тяжелые осложнения: аррозивное кровотечение, расплавление задней стенки желудка и двенадцатиперстной кишки, абсцесс сальниковой сумки, забрюшинную флегмону. Дистальная резекция поджелудочной железы при полном ее перерыве позволяет избежать осложнений, развивающихся, когда оперативное вмешательство ограничивается только дренированием сальниковой сумки. Некоторые хирурги рекомендуют прибегать к дистальной резекции железы независимо от уровня ее перерыва (Л. К. Куликов и соавт., 1999; М. П. Королев и соавт., 2000). Между тем дистальная резекция железы — травматичное вмешательство, тем более что обычно сопровождается удалением селезенки, а это небезразлично для организма, так как ведет к развитию иммунодефицита, проявляющегося снижением Т-клеточного иммунитета, нарушением фагоцитарной активности лейкоцитов и мак- рофагов, уменьшением содержания иммуноглобулина М, тафтсина, интерферонов (С. Н. Богданов и соавт., 2002). Особенно неблагоприятны последствия спленэктомии у детей, иммунная система которых еще несовершенна. Нам удалось сохранить селезенку при дистальной резекции только у 6 из 24 перенесших такой объем операции. Кроме того, удаляется значительная масса функционально полноценной ткани железы, между тем как не гарантирована опасность развития в послеоперационном периоде панкреонекроза в сохраненном проксимальном отрезке железы со всеми вытекающими из этого последствиями. Следует также учесть, что дистальная резекция железы — это не простое по технике выполнения оперативное вмешательство, оно может сопровождаться значительной кровопотерей, особенно при наличии воспалительного процесса в перипанкреатической клетчатке. Заслуживает внимания опыт хирургов, которые при перерыве поджелудочной железы правее мезентериальных сосудов анастомозируют дистальный отрезок железы с отключенной по Ру петлей тонкой кишки (А. Н. Орлов, 1999; А. В. Махнев и соавт., 2002; М. Wynn et al, 1985, и др.). Однако данные других клиницистов свидетельствуют, что недостатком данного оперативного пособия является не только сложность выполнения, но и опасность развития несостоятельности швов панкреатоеюноанастомоза, панкреонекроза, перитонита (В. Я. Васютков, 3. М. Мурашева, 1995; Г. И. Веронский, С. Г. Штофин, 1999). Нами панкреатоеюноанастомоз при полном перерыве железы наложен 16 пострадавшим. Несостоятельность швов анастомоза возникла у 2 больных. Причиной этого осложнения мы считаем поздние сроки оперативного вмешательства, т. е. на фоне развившегося посттравматического панкреатита, хотя внешних его проявлений еще не было. Возможно, что и в наблюдениях авторов, описывающих теневые стороны панкреатоеюноанастомоза, панкреатит уже имелся на момент оперативного вмешательства. Что касается сложности данной методики операции, то, действительно, требуется достаточный опыт хирурга и прецизионная техника. Сложная ситуация складывается при сочетанном повреждении головки поджелудочной железы, двенадцатиперстной кишки, а иногда еще и общего желчного протока. Среди хирургов нет единства во взглядах относительно объема операции при такой тяжелой травме. Основные возражения против панкреатодуоденальной резекции — техническая сложность вмешательства и высокая послеоперационная летальность (В. Л. Хальзов, 1999), из-за чего ее называют «операцией отчаяния» (А. Б. Молитвославов, 1994). Мы считаем, что при повреждении панкреатодуоденального комплекса тяжесть травмы поджелудочной железы не должна являться основным аргументом, на основании которого решался бы вопрос о необходимости панкреатодуоденальной резекции. Из 9 выполненных нами панкреатодуоденальных резекций у одной больной такая операция предпринята при полном поперечном разрыве головки поджелудочной железы и интрамуральной гематомы двенадцатиперст- ной кишки, что, несомненно, является необоснованным превышением необходимого в данной ситуации объема вмешательства. Между тем встречаются публикации, в которых описывается применение панкреатодуоденальной резекции именно при изолированной травме поджелудочной железы, причем авторы убеждены в целесообразности выбранной ими тактики (Н. Е. Долгушин, Д. В. Баранов, 1996). Частота послеоперационных осложнений при травме поджелудочной железы составляет 32—75% (А. К. Ерамишанцев и соавт., 1994; С. А. Афендулов и соавт., 1995); среди оперированных нами больных они наблюдались у 39,7% пострадавших с закрытой травмой и у 24% — с ранением органа. Наиболее частым осложнением травмы поджелудочной железы является панкреатит, который среди пострадавших с закрытой травмой в 33,3% наблюдений констатирован нами уже во время первичного вмешательства. Поэтому мы полностью разделяем мнение исследователей (В. П. Сажин и соавт., 1995; Г. И. Веронский, С. Г. Штофин, 1999; В. В. Рыбачков и соавт., 2001; И. П. Назаров, Ю. С. Винник, 2002), считающих, что каждый больной с травмой поджелудочной железы, даже если она I степени тяжести, должен рассматриваться как уже страдающий острым панкреатитом, так как повреждение железы служит пусковым механизмом, активизирующим протеолитические ферменты. Исходя из этих данных, становится очевидной необходимость своевременного назначения комплексной патогенетической терапии панкреатита. Если при деструктивном посттравматическом панкреатите, осложненном аррозивным наружным или профузным кишечным кровотечением, а также в случае возникновения абсцесса сальниковой сумки и забрюшинной флегмоны необходимо неотложное оперативное вмешательство, то при образовании кисты поджелудочной железы или панкреатического свища целесообразна выжидательная тактика. По литературным данным, в раннем периоде формирования посттравматической кисты поджелудочной железы наличие воспалительного процесса (а также ее тонкая стенка) препятствует выполнению как радикальных операций (корпокаудальная резекция при локализации кисты в области тела-хвоста, панкреатодуоденальная резекция при поражении головки), так и созданию цистодигестивных анастомозов (А. Д. Смирнов, 1995; В. А. Соловьев и соавт., 1995). Оптимальным сроком хирургического лечения постнекротических кист поджелудочной железы считается 3—6 мес от начала заболевания, когда капсула уже «зрелая», т. е. плотная, достаточной толщины, что делает ее пригодной для наложения цистодигестивного анастомоза (А. А. Курыгин и соавт., 1996; В. К. Гостищев, В. А. Глушко, 1999). Нами вынужденно, в сроки от 4 до 5 недель с момента травмы, оперированы 12 больных с напряженной кистой поджелудочной железы. Показанием к операции служили выраженный болевой синдром и быстрый рост кисты с угрозой спонтанного разрыва. У 8 человек, несмотря на ранние сроки вмешательства, капсула кисты оказалась уже достаточно сформированной, что позволило применить внутреннее дренирование, а у 4 капсула была истонченной или выявлена картина панкреатита, перитонита, что заставило ограничиться наружным дренированием кисты. Поэтому мы разделяем мнение М. В. Данилова и В. Д. Федорова (1995), считающих, что при выборе метода хирургического лечения кист поджелудочной железы следует ориентироваться не только на длительность существования кисты, но и на клинические данные, а также морфологические изменения поджелудочной железы и окружающих ее тканей по данным дооперационного обследования и интраоперационной ревизии. Частота образования стойкого (хронического) свища поджелудочной железы при различных ее повреждениях составляет 12—60% (А. П. Радзиховский, 1987, 1991; И. Р. Карапетян, 1987). Панкреатический свищ сформировался у 31 (12,6%) из 245 оперированных нами больных с травмой поджелудочной железы. При лечении панкреатических свищей мы придерживаемся тактики хирургов (А. А. Шалимов, А. П. Радзиховский, 1995), рационально использующих консервативные и оперативные методы лечения. Оба метода лечения не являются конкурирующими. Если целостность и проходимость главного протока железы не нарушены, обычно отмечается тенденция к спонтанному закрытию свища (В. В. Виноградов и соавт., 1974). Спонтанное закрытие свища мы наблюдали при полном перерыве железы в области хвоста, что, по всей вероятности, связано с рубцовыми изменениями ацинарной ткани дистальной части органа и истощением его секреторной функции. Нами прослежена судьба 22 из 31 больного со свищом поджелудочной железы. Оперативное лечение потребовалось 5 больным, у которых свищевой ход был связан с Вирсунговым протоком на уровне перешейка железы. При выборе оперативного пособия мы придерживаемся тактики хирургов, отдающих предпочтение прямому панкреатоеюноанастомозу (А. П. Радзиховский, 1978; М. В. Данилов, И. М. Буриев, 1995; Н. Н. Артемьева и соавт., 1997), а не панкреатофистулоеюностомии (И. Н. Гришин и соавт., 1993). Всем оперированным наложен прямой панкреатоеюноанастомоз с отключенной по Ру петлей на «потерянном» дренаже. Мы не располагаем опытом закрытия панкреатических свищей с помощью клеевых композиций; литературные данные свидетельствуют об эффективности этого способа терапии (А. В. Хальзов, С. Г. Штофин, 2002). Наша лечебная тактика разработана применительно к трем степеням тяжести повреждения поджелудочной железы. Выделение еще IV степени тяжести по J. Smego et al. (1982) не имеет большой практической значимости, так как пострадавшие с размозжением поджелудочной железы обычно не достигают стационара из-за массивного кровотечения из поврежденных магистральных сосудов. Во всяком случае, из 245 анализируемых в данной работе наблюдений не было ни одного с размозжением железы. Мы считаем нерациональным к IV степени тяжести повреждения поджелудочной железы относить сочетанную травму панкреатодуоденального комплекса — независимо от тяжести повреждения отдельных органов (А. К. Ерамишанцев и соавт., 1994). Следует отметить, что при разработке классифика- ции тяжести травмы двенадцатиперстной кишки некоторые исследователи также принимали во внимание наличие еще и повреждения поджелудочной железы, но при этом они дифференцированно учитывали тяжесть их повреждения. Так, P. Weil (1983) к III степени тяжести травмы двенадцатиперстной кишки относит разрыв ее забрюшинного отдела в сочетании с незначительным повреждением поджелудочной железы; в данной ситуации тактика — как при изолированном повреждении органов. К IV степени тяжести повреждения двенадцатиперстной кишки P. Weil относит сочетание перфорации органа со значительным повреждением головки поджелудочной железы, когда уже решается вопрос о необходимости и возможности выполнения панкреатодуоденальной резекции. R. Adkins и J. Keyser (1985) к IIIА степени тяжести травмы двенадцатиперстной кишки относят наличие обширных гематом обоих органов, к IIIБ степени — повреждение всех слоев стенки двенадцатиперстной кишки в сочетании с «подкапсульной» гематомой железы или разрывом (ранением) железы без повреждения ее главного протока и наличием гематомы стенки двенадцатиперстной кишки; IV степенью тяжести, по мнению этих авторов, следует считать такие ситуации, когда выявлены повреждения всех слоев двенадцатиперстной кишки и тяжелая травма поджелудочной железы — таким пострадавшим показана панкреатодуоденальная резекция. По нашему мнению, неправомочно подразделение операций с учетом повреждений поджелудочной железы на радикальные, которыми считают сшивание главного протока железы, дистальную резекцию органа, дистальный панкреатоеюноанастомоз, и паллиативные — вмешательства, обеспечивающие отток из сальниковой сумки, а также необоснованно утверждение, что результаты радикальных операций лучше, чем паллиативных (Ю. А. Тетерлев, 2001). Прежде всего следует отметить, что восстановление пассажа сока поджелудочной железы сшиванием Вирсунгова протока, с нашей точки зрения, нецелесообразно. Мы убеждены в неизбежности рубцовой стриктуры наложенного соустья. Никто из хирургов, применивших такой объем вмешательства, не изучил отдаленные результаты у этих больных, а следовательно, и не подтвердил, что главный проток поджелудочной железы проходим. Следует стремиться не к радикальности, а к адекватности оперативного вмешательства, объем которого зависит от многих факторов, а именно: тяжести и характера травмы поджелудочной железы, локализации очага поражения в органе, своевременности операции, наличия сочетанных повреждений, отягощающих состояние пострадавшего, опыта хирурга. Прецизионная техника вмешательства на поврежденной поджелудочной железе расширяет возможности органосохраняющей тактики. При перерыве поджелудочной железы на уровне шейки создание панкреатоеюноанастомоза предпочтительнее дистальной резекции органа, так как предупреждает осложнения, обусловленные функциональной недостаточностью железы и последствиями спленэктомии; в условиях панкреатита, перитонита, обес- кровливания при данной локализации повреждения целесообразно ограничиться только дренированием сальниковой сумки. У каждого пострадавшего с травмой поджелудочной железы, особенно закрытой, независимо от тяжести повреждения органа, реальна опасность развития некротизирующего панкреатита, что диктует необходимость своевременного назначения патогенетически направленной терапии. СПИСОК ЛИТЕРАТУРЫ Актуальные вопросы хирургии гепатопанкреатобилиарной зоны/Под ред. Ю. С. Винника.— Красноярск, 2001.— 236 с. Веронский Г. И., Штофин С. Г. Лечение полных разрывов поджелудочной железы и их осложнений // Хирургия.— 1999.— № 4.— С. 36—39. Виноградов В. В. О травматических повреждениях поджелудочной железы // Хи-рургия.— 1954.— № 1.— С. 164—170. Ерамишанцев А. К, Молитвословов А. Б., Филин А. В. Травматические повреждения поджелудочной железы // Хирургия.— 1994.— № 4.— С. 13—17. Королев М. П., Кутушев Ф. X., Уракчеев Ш. К, Волков Д. Б. Хирургическая тактика при повреждениях поджелудочной железы // Вестник хирургии.— 2000.— № 3 — С. 40-44. Лечение деструктивных форм острого панкреатита // Анналы хирургической гепатологии: Матер. IV конф. хирургов-гепатологов.—1996.— Т. 1, прилож,— С. 119—188. Лубенский Ю. М., Нихинсон Р. А., Гульман М. И. Повреждения поджелудочной железы.— Красноярск Изд-во Красноярского ун-та.— 1983.— 149 с. Молитвословов А Б Хирургическое лечение травмы поджелудочной железы: Автореф, дис.... д-ра мед. наук.— М., 1994.— 45 с Панкреатит // 1 Московский межд. конгресс хирургов / Под ред. В М. Буянова, Г. В. Родомана.— М., 1995.— С. 155—244. Панкреонекроз // IX Всерос. съезд хирургов: Матер, съезда.— Волгоград, 2000.— С. 7-136. Толстой А. Д. Травматические панкреатиты (патогенез, профилактика, диагностика, лечение): Автореф, дис.... д-ра мед. наук.— Л., 1988.— 29 с. Травма поджелудочной железы // Анналы хирургической гепатологии: Матер. Всерос. конф. хирургов-гепатологов, посвященной 30-летию Кузбасского гепатологического центра.— Кемерово, 1999.— С. 23—59. Травматические повреждения поджелудочной железы // Анналы хирургической гепатологии Матер. VIII Межд конф. хирургов-гепатологов стран СНГ.— 2000.— Т. 5.- № 2.- С. 155-203. Хальзов В. Л. Диагностика, хирургическая тактика и лечение больных с повреждениями поджелудочной железы: Автореф, дис.... д-ра мед. наук — Новосибирск, 1996.— 41 с. Boissel P., Grosdidier J. Les traumatismes du pancreas // Med. Chir. Dig.— 1985.— Vol. 14.— № 3,— P. 211—213. Degiannis E., Levy R., Velmahos G., Potokar T. et al. Gunshot Injuries of the Head of the Pancreas: Conservative Approach // World J. Surgery.— 1996.— Vol. 20.— № 1.— P. 68-71. Northrup W., Simmons R. Pancreatic trauma: a review // Surgery.— 1972.— Vol. 71.— № l.-P. 27-43. Weil P. Management of retroperitoneal trauma // Curr. Probl. Surg.— 1983.— Vol. 20.— № 9.- P. 539-622. Wynn M., Hill D., Miller D., Waxman K. et al. Management of Pancreatic and Duodenal Trauma // Amer. J. Surgery.— 1985.— Vol. 150.— № 3.— P. 327—332. ГЛАВА 5 ПОВРЕЖДЕНИЯ КРУПНЫХ СОСУДОВ ЖИВОТА Повреждения крупных сосудов брюшной полости и забрюшинного пространства являются крайне тяжелой патологией. Летальность составляет 35—68% (М. Е. Де Бэки, Б. В. Петровский, 1980; Г. Л. Александрович, И. И. Руденко, 1991; А. А. Баешко и соавт., 1997; И. М. Самохвалов, А. А. Завражнов, 2002). При этом следует учесть, что многие пострадавшие погибают на месте получения травмы или при транспортировке. Так, при ранениях аорты стационара достигают только 20% пострадавших (В. К. Август и соавт., 1983; Н. Redman, 1977). Более того, 12,6—33,3% уже госпитализированным пострадавшим не успевают выполнить оперативное вмешательство, так как они погибают в приемном отделении, при транспортировке в операционную или на операционном столе до лапаротомии (А. А. Баешко и соавт., 2000; А. А. Завражнов и соавт., 2002). Между тем, если литература по повреждению магистральных сосудов конечностей практически необозрима, то травме крупных сосудов живота посвящены лишь единичные публикации, в которых обычно описываются наблюдения благоприятных исходов ранения аорты или нижней полой вены (С. И. Маркелов и соавт., 1984; А. Ф. Дронов и соавт., 1986; Д. Ф. Скрипниченко, В. И. Бабенко, 1987; Н. Н. Волобуев и соавт., 1992). В редких публикациях, основанных на большем клиническом материале, лечебная тактика отражена недостаточно полно (М. В. Гринев, В. А. Опушнев, 1988; Ю. А. Бельков и соавт., 1997). Да и крайне сложно, с учетом многообразия вариантов повреждения сосудов брюшной полости — уровня, протяженности, характера травмы,— дать четкие тактические установки (Н. В. Проценко и соавт., 1994). Лечебная тактика зависит еще и от многих других сопутствующих факторов: тяжесть кровопотери, наличие сочетанных повреждений, возможность выполнения хирургом требуемого объема оперативного вмешательства (М. В. Гринев, В. А. Опушнев, 1988). Н. К. Голобородько (1983) при фонтанирующих кровотечениях из крупных артериальных сосудистых стволов — аорты и ее первых висцеральных ветвей — рекомендует в первую очередь наложить под диафрагмой аортальный компрессор. Кровь из брюшной полости аспирируется электроотсосом для последующей реинфузии. После обнаружения раны в проекции сосуда обеспечивается временный гемостаз путем тампонады или пальцевого прижатия, а поврежденный сосуд необходимо выделить вне раны. Нельзя накладывать кровоостанавливающий зажим «вслепую», не видя сосуда, так как это усугубляет тяжесть повреждения самого сосуда и окружающих его структур, да к тому же обычно не обеспечивает гемостаз (Н. А. Кузнецов, 2003). При ранении супраренального отдела аорты, верхних брыжеечных и левых почечных сосудов, воротной вены в области ее бифуркации мобилизуется весь левый фланг ободочной кишки и частично — поджелудочной железы, а при повреждении нижней полой вены, ствола воротной вены мобилизуются печеночный изгиб ободочной кишки, двенадцатиперстная кишка и головка поджелудочной железы. После выделения поврежденного сосуда для временного гемостаза проксимальнее и дистальнее локализации раны накладываются зажимы или турникеты, а при краевом ранении аорты, нижней полой или воротной вен возможно боковое отжатие поврежденного участка зажимом типа Сатинского, что позволяет сохранить кровоток на время ушивания раны. Такая тактика позволяет накладывать швы в условиях «сухой» раны (Н. К. Голобородько, 1983; В. Я. Васютков и соавт., 1988; Н. В. Проценко и соавт., 1994). Травма позадипеченочного отдела нижней полой вены, обычно сопровождающаяся повреждением печени и печеночных вен, вынуждает хирурга перевести лапаротомный доступ в торакофренолапаротомию (М. В. Гринев, В. А. Опушев, 1988). При сквозных ранениях поджелудочной железы с повреждением верхней брыжеечной или воротной вен для свободы манипуляций на поврежденном сосуде приходится пересекать поджелудочную железу на уровне имеющейся раны (М. П. Королев и соавт., 1996; Е. Г. Григорьев и соавт., 2000). Таким образом, повреждения магистральных сосудов брюшной полости являются одним из наиболее опасных видов травм, сложными в плане выбора тактики и технического исполнения; проблема эта нуждается в дальнейшей разработке и обсуждении на форумах хирургов. В нашей клинике находились на лечении 88 пострадавших с повреждениями крупных сосудов брюшной полости и забрюшинного пространства. Ранение сосудов получили 82 (ножевое — 76, огнестрельное — 6), закрытую травму — 6 человек. При ранениях чаще повреждались нижняя полая вена (27), брыжеечные вены (16) и артерии (7), подвздошные вены (15) и артерии (7), аорта (9), реже — воротная вена (7), печеночная артерия (2), другие сосуды (9). Из 6 пострадавших с закрытой травмой у 3 обнаружен разрыв воротной, у 2 — нижней полой вены, у 1 — верхней брыжеечной, у 1 — нижней брыжеечной вены. Изолированное ранение сосуда (аорты) мы наблюдали только у 1 больного, а у остальных одновременно с сосудами повреждались еще и другие органы — чаще тонкая (41), двенадцатиперстная (19), ободочная (17) кишка, желудок (12) и печень (12). Ранение нескольких сосудов отмечено у 16 человек. Все пострадавшие с закрытой травмой живота получили множественные повреждения органов. О тяжести состояния больных свидетельствует тот факт, что 86,7% раненых и все пострадавшие с закрытой травмой доставлены с клиникой геморрагического шока преимущественно III—IV степени. В первые 3 ч с момента травмы госпитализированы 63 (72,4%) пострадавших, остальные — в последующие 3 ч. Затруднений в распознавании внутрибрюшной катастрофы у данного контингента пострадавших не было, в связи с чем они оперированы не позже 20—30 мин с момента госпитализации. Только пострадавшим, поступившим со стабильными показателями гемодинамики, что встречалось при наличии напряженной забрюшинной гематомы, представлялось возможным выполнить компьютерную томографию или провести ангиографическое исследование. Большинство же больных были доставлены с клиникой продолжающегося внутрибрюшного кровотечения, что свидетельствовало о повреждении паренхиматозного органа или крупного сосуда и являлось показанием к экстренной лапаротомии, которая выполнялась на фоне противошоковой терапии. Еще до вскрытия брюшной полости восполнение объема циркулирующей крови осуществляли инфузией в 2—3 вены плазмозамещающих и кристаллоидных солевых растворов. Компенсация кровопотери должна быть своевременной и адекватной. Наиболее полноценной трансфузионной средой для лечения острой кровопотери является аутокровь. Поэтому, чтобы не «расплескать» излившуюся в свободную брюшную полость кровь, брюшину сразу не рассекали на всем протяжении срединного операционного доступа; кровь собирали электроотсосом. Средний объем кровопотери у пострадавших с повреждением крупных сосудов составил 6,1 ±3,5 л, а средний объем реинфузии — 4,3±2,5 л. Реинфузия крови применена у 61 (70,4%) больного. При массивном продолжающемся кровотечении наличие повреждений полых органов не считали противопоказанием к реинфузии. Ревизия брюшной полости прежде всего была направлена на быстрое выявление источника кровотечения и его остановку. Если источник кровотечения располагался в забрюшинном пространстве, но через поврежденный листок брюшины кровь в брюшную полость не поступала, гематома оставалась ненапряженной, а гемодинамика — устойчивой, то при наличии повреждений полых органов в первую очередь производили их коррекцию. Продолжающееся кровотечение в забрюшинное пространство, о чем свидетельствует напряженная, увеличивающаяся в размерах гематома и неустойчивая гемодинамика, обязывало к первичному вмешательству на сосудах, а не на поврежденных полых органах. Временный гемостаз, в зависимости от конкретных условий, осуществляли пальце- вым прижатием кровоточащей раны сосуда, наложением кровоостанавливающих или сосудистых зажимов, турникетов, внутрипросветной баллонной окклюзией и даже тампонированием. Достигнуть временного гемостаза сдавлением поврежденного сосуда через гематому невозможно. Добившись инфузионно-трансфузионной терапией улучшения показателей гемодинамики, приступали к окончательной остановке кровотечения. Дальнейшая интраоперационная тактика зависела от многих факторов: анатомического расположения сосуда, его участия в кровоснабжении органа (конечности), локализации раны, характера травмы (ножевое, огнестрельное, сквозное ранение, наличие дефекта стенки, требующее замещения пластическими материалами, размозжение сегмента), тяжести состояния пострадавшего, опыта хирурга. Только выделив поврежденный сосуд (концы), можно решать вопрос о целесообразности его восстановления и предпочтительном виде окончательной остановки кровотечения (лигатура, сосудистый шов, закрытие дефекта аутовенозной «заплатой» или восстановление непрерывности сосуда с помощью «вставки»). Сосудистый шов применили на 83 сосудах. Использовали непрерывный или узловой шов на атравматической игле. На венах отдавали предпочтение непрерывному обвивному шву как более герметичному. При сквозном ранении нижней полой вены в анатомически «неудобных» ее отделах предварительно останавливали кровотечение пережатием сосуда периферичнее и нейтральнее повреждения или временной внутрипросветной баллонной окклюзией, а затем рану задней стенки ушивали через расширенную рану передней. Аутовенозная пластика (протезирование) предпринята на 6 сосудах. В жизнеугрожающих ситуациях у 12 пострадавших мы посчитали допустимым лигирование поврежденных крупных венозных стволов. Показанием к такому объему вмешательства стали крайняя тяжесть состояния больных вследствие продолжающегося массивного кровотечения и развившегося гипокоагуляционного синдрома, наличие сочетанных и множественных повреждений, ранение нескольких сосудов со значительным дефектом стенки на одном из них. Неблагоприятный исход у некоторых из этих пострадавших не был обусловлен лигированием поврежденной вены. Так, из 4 больных, которым перевязали верхнюю брыжеечную вену, 2 погибли на операционном столе от кровопотери, а 2 — выздоровели, хотя у 1 из них в послеоперационном периоде наблюдался эпизод кишечного кровотечения. Лигирование нижней брыжеечной вены у 3 больных не повлекло за собой каких-либо последствий. Из 3 раненых с лигированием общей подвздошной вены погибли 2: 1 — от продолжающегося кровотечения (просмотрено ранение задней стенки вены проксимальнее наложенной лигатуры); 1 больная умерла через 10 суток от пневмонии (только объем реинфузии у нее составил 24,5 л); у 1 раненого послеоперационное течение без особенностей. Правая вена ободочной кишки лигирована у 1 больного; выздоровление. Благоприятным был исход и у раненого после лигирования внутренней подвздошной вены. 1 раненому при пересечении собственной печеночной артерии наложен циркулярный сосудистый шов, 1 больной артерия лигирована. У обоих желчный пузырь, во избежание некроза, удален; послеоперационный период протекал без осложнений. Умер 31 (37,8%) человек с ранениями сосудов (ножевые — 28, огнестрельные — 3), причем из 27 пострадавших с ранениями нижней полой вены погибли 12, а из 9 с ранениями аорты — 5. Из 6 пострадавших с закрытой травмой сосудов умерли 2 с разрывом нижней полой и воротной вен. Основная причина неблагоприятного исхода — кровопотеря (84,8%); на операционном столе погибли 16 (48,5%), в раннем послеоперационном периоде — 12 (36,4%) больных. Прослеживается четкая зависимость между тяжестью кровотечения и исходом. Так, при кровопотере до 3 л летальность составила 14,5%, а при большем объеме — 60,5%. У 16 человек причиной смерти являлось неостановленное кровотечение, у 5 — невосполненная кровопотеря, у 7 — выраженная коагулопатия и полиорганная недостаточность. От перитонита умерло 4, от тромбоэмболии легочной артерии — 1. Ошибки в лечении способствовали неблагоприятному исходу у 12 пострадавших. Так, у 2 больных коррекция повреждений органов брюшной полости осуществлялась на фоне продолжающегося кровотечения в забрюшинное пространство. Попытки достигнуть временного гемостаза сдавлением поврежденного сосуда через гематому оказались неэффективными, терялось драгоценное время, и к моменту ревизии забрюшинного пространства уже развился гипокоагуляционный синдром. У 2 пострадавших ушивание сквозного ранения нижней полой вены тотчас выше бифуркации без предварительного пережатия осложнило выполнение вмешательства. Следовало прижать поврежденный участок вены к позвоночнику, наложить резиновые турникеты на обе подвздошные вены и на нижнюю полую вену выше места ранения, лигировать ее поясничные притоки и только затем приступить к восстановлению целостности сосуда. Неоправданно длительной была попытка ушивания дефекта стенки наружной подвздошной вены на фоне тяжелой кровопотери и множественных повреждений органов. Экстремальность ситуации при жизнеугрожающем кровотечении увеличивает опасность не выявить все имеющиеся повреждения. Среди рассматриваемого контингента больных у одного ранение двенадцатиперстной кишки, а у другого ранение аорты обнаружены уже при релапаротомии; причина: во время первого вмешательства не была ревизована забрюшинная гематома. У 2 пострадавших с торакоабдоминальными ранениями торакотомия была необоснованна, да и к тому же она предшествовала лапаротомии, тогда как следовало ограничиться только лапаротомией, предварительно устранив гемопневмоторакс дренированием плевральной полости. Грубой тактической ошибкой считаем отказ от реинфузии контаминированной крови при массивной кровопотере; она допущена у 3 погибших от кровотечения больных. Обсуждение Опыт нашей клиники по лечению пострадавших с повреждениями крупных сосудов брюшной полости основан на 88 наблюдениях (82 — с ранениями и 6 — с закрытой травмой). Большинство (72,4%) пострадавших оперированы в течение 3 ч с момента травмы. Значение фактора времени для данного контингента пострадавших трудно переоценить, так как тяжесть их состояния обусловлена массивной и обычно продолжающейся кровопотерей. Благоприятный исход реален, если корригирующее вмешательство выполняется до развития гипокоагуляционного синдрома. Даже во время лапаротомии, с учетом множественности повреждений органов, необходимо выбрать наиболее рациональную последовательность оперативного пособия. При продолжающемся кровотечении в свободную брюшную полость или в забрюшинное пространство мы, как и другие хирурги (В. Я. Васютков и соавт., 1988; Н. А. Ефименко, В. Е. Розанов, 2001), считаем необходимым прежде всего достижение гемостаза — с учетом сложившейся ситуации гемостаз может быть первоначально временным, а уже после стабилизации состояния пострадавшего под воздействием проводимой инфузионно-трансфузионной терапии — окончательным. Рекомендации некоторых клиницистов (Н. Н. Волобуев и соавт., 1992) при обнаружении забрюшинной гематомы начинать вмешательство с ее ревизии не всегда целесообразно следовать. Это оправданно для ситуаций, когда забрюшинная гематома большая, напряженная, гемодинамика неустойчивая или продолжается кровотечение через поврежденный задний листок брюшины. Нет необходимости при большой забрюшинной гематоме переходить на люмботомический доступ, хотя такая тактика также практикуется (Г. М. Николаев и соавт., 1980): достаточно проекционно или по переходной складке рассечь брюшину. Мы полностью разделяем мнение хирургов, считающих обязательной ревизию забрюшинной гематомы, даже если размеры ее относительно невелики и не увеличиваются по ходу вмешательства, так как замедление или прекращение кровотечения может быть связано с тампонадой раны сосуда сгустком крови, возможно повреждение почки, двенадцатиперстной кишки (И. Б. Тейтельбаум, Н. Г. Бабенко, 1980). Однако к ревизии такой гематомы следует приступить, предварительно выполнив коррекцию поврежденных органов брюшной полости. Целесообразность восстановительных операций при повреждении крупных артерий и вен живота не вызывает сомнений. Однако вряд ли справедливо утверждение А. А. Баешко и соавт. (2000), считающих, что на современном уровне развития хирургии восстановление магистрального кровотока возможно практически у всех больных, независимо от характера травмы сосуда. При множественной и сочетанной травмах живота у «обескровленного» больного, состояние которого критическое, времени на восстановление целостности сосуда может уже не оказаться, тем более если дефект в стенке сосуда большой, что требует реконструктивного вмешательства, причем с участием «сосудистого хирурга». В таких ситуациях допустима перевязка крупных сосудов, хотя иногда это и ведет к необходимости органоуносящих вмешательств. И все же, как показал наш опыт и опыт других хирургов (С. И. Маркелов и соавт., 1984; В. И. Булы-нин и соавт., 1986; Ю. А. Бельков и соавт., 1997), даже после перевязки брыжеечных, подвздошных вен может не возникнуть тяжелых регионарных нарушений кровообращения. Конечно, последствия практически непредсказуемы, но ведь речь идет о пострадавших, жизнь которых «висит на волоске» — они часто имеют множественные повреждения органов и уже выраженный ДВС-синдром; единственным шансом на спасение остается быстрое обеспечение гемостаза. Более того, И. П. Дуданов и соавт. (2000) считают возможным лигирование нижней полой вены, если повреждение ее обширное, протяженное, а состояние пострадавшего не позволяет выполнить продолжительное вмешательство с целью восстановления целостности сосуда. А. Н. Петров (2002) располагает 11 наблюдениями перевязки инфраренального отдела нижней полой вены (6), воротной вены и ее притоков (5) при травме живота; погибли 6 человек — все от осложнений, обусловленных лигированием сосудов. Дата добавления: 2015-11-25 | Просмотры: 840 | Нарушение авторских прав |
 99
99