 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Определение аллергенспецифических IgE в РАСТ с применением флюоресцентной меткиК аллергену, сорбированному на целлюлозном носителе, добавляют сыворотку крови пациента. Затем добавляются меченные ферментом В качестве примера метода,основанного на эффекте хемилюминесценции, можно привести МАСТ. MACT (множественный аллергосорбентный тест) — метод определения аллергенспецифических IgE, аналогичный по принципу постановки РАСТ, где аллерген сорбирован на целлюлозных нитях, а в качестве индикатора реакции используются фотореагенты, свечение которых регистрируется на пленке Polaroid, на люминометре, на фотометре
Рис. 8. Устройство для постановки МАСТ: 1 — MAST-панель в сборе; 2 — крышка; 3 — целлюлозные нити с адсорбированным аллергеном; 4 — корпус Псевдоиммуноблот — метод, позволяющий одновременно выявлять специфические IgE-антитела к спектру аллергенов (к каждому из них) Современные тест-системы построены по принципу двухуровневого определения аллергостатуса: на первом уровне производится стандартное аллергообследование, позволяющее определить группу аллергенов, Классический иммуноблот применяют в случае наличия четких указаний на причинный аллерген (данные анамнеза, элиминационного теста и др.) и отрицательных результатов тестирования на специфический IgE с охарактеризованными компонентами этого аллергена. В таких случаях из грубого экстракта аллергена получают блоты и проводят анализ сыворотки больного на наличие IgE, специфичных к минорным (не охарактеризованным) компонентам аллергена. Микроэррей (microarrey) является сравнительно новым (разработан 
Рис. 9. Схема проведения микроэррея для диагностики аллергии Исследование проводится в несколько этапов: 1. Приготовление микрочипа: рекомбинантные аллергены раскапываются на поверхность активированного предметного стекла (объем 2–3. Ход теста: а) раскапывание сывороток пациентов (15 мкл); б) инкубация (IgE пациента соединяются с аллергенами); в) добавление моноклональных антител против IgE, меченных флуорохромом; г) сканирование микрочипа; д) типичная сканограмма микрочипа: – первые три ряда = калибровочная кривая (интенсивность свечения пропорциональна количеству фиксированных IgE); – далее — профиль сенсибилизации пациента (специфичность и количество IgE в сыворотке пациента). Тесты активации клеток аллергенами (CAST) являются современными методами диагностики ГНТ медиаторного типа, не обусловленной IgE (рис. 10).
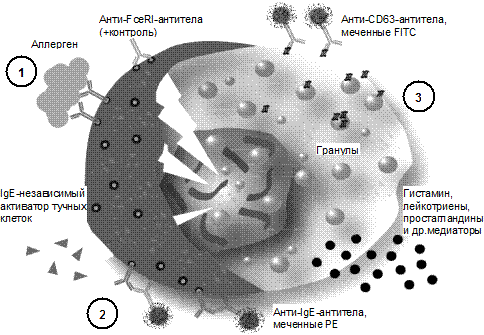
Рис. 10. Принцип постановки CAST/FAST: 1 — стимуляция базофилов (IgE-зависимая, с помощью аллергена; с помощью анти-FceRI-антител; IgE-независимая, с помощью пищевых добавок, нестероидных противовоспалительных средств (аспирин), лекарственных препаратов); 2 — идентификация базофилов. Проводится только для FAST, обычно с помощью меченых антител против IgE или рецепторов к хемокинам CCR3; 3 — учет реакции. CAST учитывают Ранее подобную реактивность выявляли в тестах повреждения лейкоцитов и стимуляции выделения гистамина базофилами, однако они слишком трудоемки, плохо воспроизводятся и не поддаются стандартизации. СAST/FAST ставится в несколько стадий: 1. Выделение лейкоцитов крови: а) к стабилизированной крови добавляют декстран для осаждения эритроцитов; б) надосадок центрифугируют для осаждения лейкоцитов (удаление декстрана и тромбоцитов); в) осадок лейкоцитов ресуспендируют в буферном растворе, содержащем ИЛ3. 2. Стимуляция лейкоцитов: а) с анти-FceRI-антителами (положительный контроль); б) физиологическим раствором (отрицательный контроль); в) аллергеном(ами) в различных концентрациях. 3. Супернатанты отбирают и немедленно определяют содержание лейкотриенов с помощью твердофазного ИФА. Для количественного 4. Интерпретация теста. Для пищевых аллергенов нижний (пороговый) уровень (cut off) обычно равен 400 пг/мл; для пищевых добавок, FAST отличается от CAST способом учета активированных базофилов: обнаружение и подсчет процента клеток, экспрессирующих CD63 Следует отметить, что CAST/FAST выявляет выделение лейкотриенов лейкоцитами как в связи, так и без наличия аллерген-специфических IgE. Основные показания для применения CAST/FAST: подозрение на ГНТ по медиаторному типу и отсутствие специфических IgE; наличие гиперчувствительности к пищевым добавкам и лекарственным аллергенам; диагностика аспириновой астмы и подобных состояний. CAST/FAST не рекомендуются как тесты для первичного аллергологического обследования (они сложнее, дороже и уступают стандартным тестам обнаружения специфических IgE (UniCAP и т. д.)).
Рис. 11. Учет FAST: а — отрицательный контроль; б — положительный контроль. Обозначения: PE —
Методы, направленные на исследование проаллергических Определение медиаторов и цитокинов в системном кровотоке (обычно методом твердофазного ИФА): 1. Выявление гистамина затруднено крайне высокой скоростью его инактивации (минуты), поэтому для обнаружения его наличия в системной циркуляции (анафилактический шок) чаще применяют определение метил-гистамина в моче (высокий уровень сохраняется несколько часов после исчезновения проявлений системной анафилаксии). 2. Определение триптазы в сыворотке крови. Триптаза содержится 3. Определение цитокинового статуса периферической крови (ИЛ4, ИФНγ, ИФНγ/ИЛ4) дает крайне общее представление о характере типа реагирования иммунной системы в момент проведения теста. Было популярно в 80-е гг. прошлого века. Позже — в 90-е гг. модель Th1/Th2 уступила место исследованию роли Т-регуляторов при аллергии. 4. Определение содержания клеток, секретирующих те или иные цитокины. В настоящее время имеется возможность определения этих параметров для аллергенспецифических клеток (технология тетрамеров). Чаще для указанных целей применяют проточную цитофлуориметрию и элиспот. Определение цитокинов и медиаторов в тканях (позволяет выяснить природу воспаления, его интенсивность, преобладающие звенья патогенеза): 1. Определение NO в выдыхаемом воздухе: простой неинвазивный тест, позволяющий отслеживать интенсивность воспалительного процесса в дыхательных путях (контроль лечения бронхиальной астмы). 2. Определение медиаторов и цитокинов в смывах, экссудатах и другом отделяемом поврежденных тканей. 3. Определение клеток, синтезирующих цитокины и медиаторы на срезах из биопсий поврежденных тканей. 4. Количественное определение мРНК цитокинов и медиаторов Необходимо отметить, что методы определения цитокинов при Дата добавления: 2015-11-26 | Просмотры: 672 | Нарушение авторских прав |

 а б
а б