|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
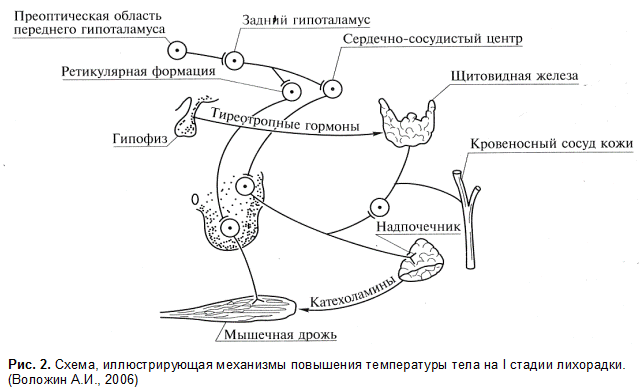
Этиология и патогенез лихорадкиРазвитие лихорадки обусловлено смещением установочной точки температурного гомеостаза на более высокий уровень под влиянием многочисленных пирогенных веществ. Различают пирогены экзогенные и эндогенные, первичные и вторичные, инфекционные и неинфекционные, приводящие соответственно к возникновению инфекционной и неинфекционной (асептической) лихорадки. Экзогенные пирогены инфекционного происхождения представляют собой высокомолекулярные липополисахаридные комплексы эндотоксинов, которые являются компонентом оболочек грамотрицательных микробов и выделяются при повреждении многих бактериальных клеток. Основным носителем пирогенной активности является содержащийся в них липоид А. Гидрофобный компонент, липоид А, погруженный в наружную мембрану бактериальной клетки, является маловариабельной частью молекулы липополисахарида (ЛПС). Она взаимодействует с поверхностными рецепторами СD14, расположенными на микро- и макрофагах, других антигенпредставляющих клетках, вызывая их активацию и синтез вторичных эндогенных пирогенов. Высокоактивные экзопирогены практически не обладают токсическими и антигенными свойствами, а также видовой пирогенной специфичностью. Токсический эффект липополисахаридных пирогенов в организме проявляется под влиянием доз, в сотни, тысячи раз превышающих минимальную пирогенную дозу. Полагают, что их токсические и пирогенные свойства связаны с наличием различных химических группировок. При повторном воздействии экзогенных пирогенов на организм к ним возникает толерантность. Помимо ЛПС пирогенными свойствами обладают капсульные полисахариды бактерий (леван, декстран), а также полимерный флагеллин жгутиковых, фиколл и пептиды из правовращающих аминокислот. Все эти так, называемые Т-независимые, бактериальные антигены активируют различные клоны В-лимфоцитов и стимулируют макрофагальную продукцию вторичных эндогенных пирогенов. Не содержащие ЛПС грамположительные бактерии и грибы служат источником небольшого количества экзогенных пирогенов, таких как липотейхоевая кислота и пептидогликан. К экзогенным инфекционным пирогенам относятся также термолабильные белковые вещества, выделенные из энтеротоксинов и экзотоксинов, например золотистого стафилококка, гемолитического стрептококка, дифтерийных бацилл, возбудителей дизентерии, туберкулеза, паратифов и других патогенных агентов. Пирогенная активность термолабильных белковых пирогенов значительно ниже, чем липополисахаридных. Вирусы, риккетсии и спирохеты вызывают развитие лихорадки, несмотря на отсутствие в них экзопирогенов: полисахаридов, липополисахаридов, эндо- и экзотоксинов. Однако после попадания в макрофаги и взаимодействия с лимфоцитами они способствуют образованию этими клетками вторичных эндогенных пирогенных веществ. Особенно активны в этом отношении вирус герпеса и вирус Эпштейн-Барр. Первичные экзогенные и эндогенные неинфекционные пирогены вызывают развитие асептической лихорадки также после активации в организме макрофагальных и иных мезенхимальных клеток и продукции ими вторичных белковых эндогенных пирогенов. Эндопирогены высвобождаются малигнизированными клетки миелоидного ряда при острой миелоидной лейкемии, злокачественными клетками при Ходжкинской лимфоме, меланоме и других злокачественных новообразованиях. Эндогенные пирогены образуются и в случаях иммуноаллергического или асептического травматического повреждения тканей, развития ишемического или геморрагического некроза и т.п. Следовательно, стимуляция выработки вторичных эндопирогенов может происходить вне инфекционного процесса, включая и различные формы аллергии. При аллергических реакциях комплексы Аг-АТ, связываясь со специфическими рецепторами на клеточной мембране фагоцитов активируют гены, ответственные за синтез вторичных эндогенных пирогенов. Таким образом, эффект первичных инфекционных и неинфекционных пирогенов опосредуется через образующиеся в организме вторичные эндогенные пирогены, которые являются адекватными раздражителями гипоталамического центра терморегуляции, вызывающими развитие лихорадки. Вторичные эндогенные пирогены представляют гетерогенную группу биологически активных веществ, объединенных понятием цитокины, с молекулярной массой 10–30 кДа: лейкоцитарный пироген (ЛП) или лейкоцитактивирующий фактор интерлейкин-1 (ИЛ-1α, ИЛ-1β), интерлейкин-6 (ИЛ‑6), интерлейкин-8 (ИЛ-8), фактор некроза опухолей (ФНО-α или кахексин, ФНО-β или лимфотоксин), интерферон (ИНФ-α, ИНФ-β, ИНФ-γ), макрофагальный воспалительный белок‑1α, а также менее активные катионные белки и колониестимулирующие факторы (КСФ). Они образуются в очаге инфекционного, асептического или иммуноаллергического воспаления возбужденными гранулоцитами, моноцитами крови и лимфы, тканевыми макрофагами и NK лимфоцитами-киллерами, В-лимфоцитами, микро- и макроглиальными, мезангиальными элементами, эндотелиоцитами, апудоцитами и тучными клетками в результате взаимодействия экзопирогенов со специфическими рецепторами указаных элементов, а также пино- и фагоцитоза экзопирогенов или поврежденных клеточных структур организма, иммунных комплексов и т. п. Эндопирогены могут образовываться в лейкоцитах при воздействии на них лимфокинов и «пирогенных» стероидных гормонов типа этиохолоналона — естественного печеночного метаболита андрогенов или же аналогов прогестерона. В отличие от экзогенных пирогенов вторичные эндогенные пирогены не вызывают развитие толерантности при повторном образовании в организме и, приводят к возникновению лихорадки через латентный период значительно меньший, чем после воздействия экзогенных пирогенов. В зависимости от изменения теплообмена в развитии лихорадки выделяют три стадии: 1) повышения температуры (stadium incrementum); 2) установления ее на более высоком уровне (stadium fastigium или acme); 3) снижения температуры до исходного значения (stadium decrementum). Первая стадия лихорадки характеризуется ограничением теплоотдачи и последующим увеличением теплопродукции. Однако, относительно механизмов действия пирогенов и изменения процессов терморегуляции в этот период лихорадки, единой точки зрения пока не существует. По мнению некоторых авторов, они могут быть представлены следующим образом. Циркулирующие в крови эндопирогены проникают через гематоэнцефалический барьер (ГЭБ) и оказывают прямое специфическое воздействие на термочувствительные нейроны и нейроны установочной точки гипоталамического центра терморегуляции. Это сопровождается активацией фермента фосфолипазы А2, приводящей к высвобождению арахидоновой кислоты из фосфолипидов нейрональных мембран. Далее активируются фермент циклоксигеназа (одна из простагландинсинтетаз) и образование простагландинов (PGЕ1 и PGЕ2), которые стимулируют аденилатциклазу, тормозят фосфодиэстеразу и способствуют повышению концентрации в цитоплазме этих нейронов ц3,5-АМФ. Через активацию АМФ-зависимых протеинаткиназ и фосфорилирование белков-ферментов изменяется метаболизм нейронов, выполняющих роль центральных термосенсоров. В результате перестройки метаболизма возбудимость холодочувствительных нейронов повышается, а теплочувствительных нейронов понижается и температура внутренней среды организма воспринимается как недостаточная. В связи с этим включаются механизмы направленные на сохранение тепла в организме. По другим литературным данным эндопирогены не могут оказывать прямое влияние на мембраны термочувствительных нейронов аппарата измерения, или же «эталонных» вставочных нейронов отдела сравнения гипоталамуса, так как не проходят сквозь ГЭБ, непроницаемый для крупных гидрофобных молекул полипептидов. Они проникают не собственно в ткань гипоталамического отдела мозга, а только в сосудистый орган конечной пластинки (СОКП) — один из так называемых циркумвентрикулярных органов, как бы вынесенных «за барьер». Эндопирогены усиливая, по-видимому, в клетках СОКП синтез циклоксигеназы, способствуют образованию PGЕ1 и PGЕ2, приводящих к изменению возбудимости указанных нейронов. В последнее время рядом авторов было установлено, что эндотелий СОКП является высокочувствительным к бактериальным липополисахаридам и при воздействии их на эндотелиоциты высокопроницаемой области ГЭБ они могут без участия лейкоцитарных эндопирогенов стимулировать продукцию клетками внутренней сосудистой выстилки PGЕ1 и PGЕ2. Липофильные жирорастворимые ПГЕ легко проникают, по-видимому, как к термочувствительным, так и к «эталонным» интернейронам «установочной точки» центра терморегуляции, оказывают непосредственное воздействие на нейрональные мембраны, изменяют характер метаболизма в клетках, степень их возбудимости и обеспечивают развитие лихорадки. Несмотря на то, что в переднем гипоталамусе под влиянием разнообразных пирогенов образуется около 20 различных метаболитов, называемых «медиаторами лихорадки», максимальное значение в повышении установочной точки температурного гомеостаза большинством исследователей отводится PGЕ1 и, особенно, PGЕ2, которые вырабатываются в гипоталамусе, главным образом, под влиянием ИЛ-1, ИЛ-6 и ФНО. Образовавшиеся PGЕ активируют аденилатциклазу и ингибируют фосфодиэстеразу, что способствует аккумуляции ц3,5-АМФ, по-видимому, как в термочувствительных, так и в «эталонных» нейронах теплорегулирующего центра. В условиях накопления внутриклеточного ц3,5-АМФ, повышения внеклеточной концентрации ионов Na, заметного снижения железа в тканях гипоталамуса и содержания ионов Са в нейронах, существенно возрастает их чувствительность к холодовым и понижается чувствительность к тепловым прямым и рефлекторным влияниям. При этом изменяется паттерн импульсной активности вставочных нейронов аппарата сравнения и повышается установочная точка температурного гомеостаза. В результате терморегулирующий центр воспринимает нормальную температуру крови, тканевой жидкости в области гипоталамуса и поток афферентной импульсации от периферических термосенсоров как сигнал охлаждения. Поэтому включаются механизмы, направленные на ограничение теплоотдачи, увеличение теплопродукции и температуры внутренней среды организма. При изменении возбудимости нейронов «термостата» и «установочной точки» гипоталамического центра терморегуляции импульсация от холодовых и тепловых нейронов легко воспринимается интернейронами аппарата сравнения и передается к нейронам эффекторного отдела. Генерируемый нейронами «установочной точки» сигнал рассогласования вызывает торможение парасимпатических нейронов переднего гипоталамуса — центра теплоотдачи и одновременное возбуждение симпатических нейронов заднего гипоталамуса — центра теплопродукции. Параллельно активируются нейроны прессорной области бульбарного сердечно-сосудистого центра и симпатические нейроны спинального вазомоторного центра. Это сопровождается повышением продукции катехоламинов, усилением сердечной деятельности и перераспределением сосудистого тонуса: расширением сосудов ряда внутренних органов и нейрогенным спазмом периферических сосудов, приводящим к развитию умеренной вторичной гипертензии и полиурии. Сужение сосудов кожи приводит к уменьшению ее кровоснабжения, и теплоотдачи путем конвекции, радиации и потоотделения. В результате теплоотдача может снизиться на 70 %. При этом кожа становится холодной, бледной и, нередко, цианотичной вследствие повышения в крови уровня восстановленного гемоглобина, появляется пилоэрекция, вызывающая у людей симптом «гусиной кожи». У большинства больных нередко ограничивается частота и глубина дыхательных движений, а следовательно, и выделение тепла из организма. Таким образом, увеличение температуры внутренней среды происходит прежде всего за счет значительного ограничения тепловых потерь и накопления тепла в организме. Дополнительный прирост тепловой энергии возникает в результате активации механизмов сократительного, а затем и несократительного термогенеза. При недостаточном повышении температуры тела и несоответствии ее установочной точке температурного гомеостаза дальнейший прирост тепловой энергии в организме осуществляется за счет включения сократительного термогенеза. В условиях ограниченного притока теплой крови к ряду внутренних органов и к кожным покровам происходит их охлаждение. Снижение температуры кожи на несколько градусов приводит к возбуждению холодовых рецепторов и поступлению потока афферентной импульсации к нейронам спинного мозга, ретикулярной формации мозгового ствола, таламуса, гипоталамуса и чувствительной области коры головного мозга. В результате возникает ощущение охлаждения организма и появление соответствующих поведенческих реакций, направленных на уменьшение теплоотдачи и увеличение теплопродукции. Вследствие еще большей активации холодовых термонейронов переднего гипоталамуса и адренергических нейронов заднего гипоталамуса усиливаются активирующие влияния ретикулярной формации мозгового ствола на нейроны красных ядер среднего мозга и ядер черепно-мозговых нервов, на спинальные α-, β- и γ-мотонейроны и затем склетную мускулатуру. Это приводит к дополнительной стимуляции симпато-адреналовой системы, выделению катаболических гормонов, несократительного и сократительного термогенеза, путем включения спинального рефлекторного механизма обратной связи с участием мышечных веретен, повышения терморегуляторного мышечного тонуса и развития мышечной дрожи. Вначале формируется асинхронное сокращение мышечных волокон, что воспринимается как тоническое напряжение мышц — терморегуляторный мышечный тонус, т.е. недрожательный термогенез (nonshivering termogenesis). Дальнейшая активация мышц синхронизирует сократительную деятельность отдельных двигательных единиц — возникает мышечная дрожь, т.е. дрожательный термогенез (shivering termogenesis): непроизвольные залповые сокращения различных групп мышц в том числе и жевательных. Это проявляется постукиванием зубов. Сократительный термогенез, обусловленный в определенной степени активацией терморецепторных нейронов в C5–Тh1 сегментах спинного мозга, является основным источником тепла за счет усиления биоэнергетики мышц, и увеличения температуры тела до уровня новой установочной точки температурного гомеостаза. Охлаждение кожи и активированный сократительный термогенез сопровождаются возникновением субъективного ощущения озноба. Терморегуляторный мышечный тонус, как и дрожь, является специализированными формами мышечной деятельности, направленной на увеличение теплопродукции. При повышении терморегуляторного мышечного тонуса стимулируются гликогенолиз, липолиз, окисление жирных кислот, потребление кислорода мышечными клетками. При этом чрезвычайно быстро и значительно возрастает теплообразование в мышцах. Дрожь способствует усилению мышечного метаболизма в 4–5 раз по сравнению с исходным уровнем. Поскольку при этом совершается незначительная работа мышц, то почти вся производимая энергия выделяется в виде свободного тепла, которое приводит к разогреванию внутренней среды организма. У взрослых людей дрожь является основным и наиболее эффективным способом увеличением выработки тепла. Чем больше выражен озноб и мышечная дрожь, тем интенсивнее развивается повышение температуры тела. У грудных детей прирост теплопродукции осуществляется, прежде всего, за счет усиления недрожательного термогенеза и лишь при чрезвычайных ситуациях — за счет мышечной дрожи. Охлаждение кожи включает и механизмы химической терморегуляции, также направленные на дополнительную выработку тепла в организме. Химическая терморегуляция начинается при снижении температуры кожи лишь до определенного уровня. Таким образом, вслед за срочным сократительным термогенезом включается отсроченный несократительный термогенез, обусловленный активацией механизмов химической теплопродукции. В условиях значительной активации симпатических влияний усиливается выделение адреналина из надпочечников, а также трийодтиронина и тироксина из щитовидной железы. Кроме того, ИЛ-1 стимулирует выработку соматостатина, кортиколиберина, АКТГ, глюкокортикоидов, тиролиберина и тиреоидных гормонов, а также подавляет гипоталамическую продукцию соматолиберина и инсулина поджелудочной железой, что способствует ослаблению анаболизма и повышению катаболизма. Несократительный термогенез обусловливается повсеместной активацией метаболизма под влиянием указанных гормонов, а также глюкагона и паратгормона, особенно в печени, жировой ткани, мозге и скелетных мышцах, которые участвуют в химическом термогенезе не менее активно, чем в сократительном. Катехоламины увеличивают образование цАМФ в липоцитах белой и бурой жировой ткани, особенно у детей, и вызывают относительно быстрое усиление липолиза. Увеличение концентрации жирных кислот в крови и клетках приводит к уменьшению сопряжения дыхания и фосфорилирования, а следовательно к увеличению доли первичного рассеиваемого тепла в, основном, в мышечной ткани. Адреналин активирует гликогенолиз и аэробное окисление глюкозы в печени, а глюкокортикоиды при этом способствуют гликонеогенезу и распаду новых порций эндогенной глюкозы. Гормоны щитовидной железы усиливают функциональную активность Na+/K+-АТФазы, которая обеспечивает генерацию тепла в объеме 30 % величины основного обмена. Кроме того, они способствуют митохондриальному окислению активируя НАД-зависимую электроннотранспортную систему глицерофосфатдегидрогеназы, а также усиливают липолиз. Высокие концентрации тиреоидных гормонов и ряда бактериальных ядов вызывают набухание митохондрий в клетках различных тканей, разобщение свободного дыхания и окислительного фосфорилирования, что обеспечивает заметное накопление первичной теплоты. ИЛ-1 и ФНО способствуя стимуляции катаболизма тормозят анаболизм. Например, они снижают активность липопротенинкиназы, блокируя тем самым липогенез в жировой ткани. Все это приводит к дальнейшему увеличению химической теплопродукции и температуры внутренней среды организма. В результате преобладание теплообразования над теплоотдачей приводит к накоплению тепла в организме и повышению температуры ядра тела. При этом температура тела нарастает до тех пор, пока она не достигнет уровня новой установочной точки температурного гомеостаза. На этом завершается первая стадия лихорадки. Таким образом, накопление дополнительного количества тепла на первой стадии лихорадки происходит, как правило, за счет резкого ограничения теплоотдачи и последующего увеличения теплопродукции. У взрослых снижение теплоотдачи играет ведущую роль в подъеме температуры тела. При таком варианте теплообмена продолжительность первой стадии лихорадки может быть небольшой, а подъем температуры обычно происходит за 2–3 часа. Однако возможен вариант, когда в первой стадии лихорадки имеет место одновременное повышение теплоотдачи и теплопродукции, хотя в данном случае степень увеличения продукции тепла преобладает над выделением его из организма. При этом температура тела нарастает медленно, без развития озноба. Степень повышения температуры внутренней среды организма определяется многими факторами: количеством образующихся экзопирогенов и динамикой появления их в кровотоке; интенсивностью выработки эндопирогенов; уровнем и соотношением их в крови; чувствительностью термокомпетентных нейронов к температурной информации и пирогенам; мощностью и зрелостью органов и систем, осуществляющих выработку и отведение тепла; нетемпературными рефлекторными влияниями на центр терморегуляции с периферических рецепторов. Так, например, рефлексы с капсулы почек, возникающие при их патологии, тормозят развитие лихорадки. Известно, что заболевания почек сопровождаются не высокой температурой, более того при болезнях почек ограничивается развитие лихорадки у больных с имеющимися интеркуррентными заболеваниями. Кроме того, степень повышения температуры тела регулируется системой эндогенного аптипиреза, активирующейся под влиянием ФНО. Она представлена гипоталамическим аргинин-вазопрессиновым (АВП) нейромодуляторным механизмом предотвращения гиперпирексии, за счет снижения возбудимости холодочувствительных термонейронов преоптической области переднего гипоталамуса и уменьшения эффектов симпатоадреналовой активности на периферии. Антипиретический эффект возникает также под влиянием тиролиберина, кишечного ингибирующего полипептида, нейротензина и бомбезина. Наиболее активный из них бомбезин повышает чувствительность тепловых термонейронов отдела измерения в гипоталамусе, что препятствует возникновению гиперпирексии. Одновременно ФНО стимулирует в гипоталамусе выработку α-меланотропина (α‑меланоцитостимулирующего гормона) и гормона окситоцина. Эти олигопептиды, не выходя в кровь, воздействуют на центры терморегуляции, постепенно вызывая ограничение подъема температуры тела. Кроме того, усиление выработки под влиянием ИЛ-1 естественных антиперетиков кортиколиберина, АКТГ и кортизола, по принципу обратной связи приводит к торможению высвобождения ИЛ-1, ИЛ-6 и ФНО-α клетками системы иммунитета на периферии и стабилизации клеточных мембран, с ограничением активности фосфолипазы А2 и уменьшением высвобождения метаболитов араходоновой кислоты в центральной нервной системе. Липокортин-1, предполагаемый медиатор функции глюкокортикоидов, также угнетает пирогенные эффекты ИЛ-1 и ИНФ. Соматостатин и эндогенные агонисты опиоидных и барбитуровых рецепторов — эндорфины и энкефалины, являясь также естественными антагонистами эндогенных пирогенов, препятствуют развитию гиперпирексии. И действительно, верхний предел температуры при лихорадке редко превышает 41,1 ºС. Если температура тела превышает этот уровень, то к лихорадке, по-видимому, присоединяется эндогенное перегревание. Ограничивают развитие гиперпирексии и гликопротеин массой 18 кДа — конкурентный блокатор клеточных рецепторов для ИЛ-1, «уромодулин» (белок Тамма-Хорсфалла), высокоафинно связывающий ИЛ-1, цитокины-блокаторы каскада ИЛ-10 и трансформирующий фактор роста-β, растворимые сывороточные антагонисты самих молекул ИЛ-1 и ИЛ-6, а также рецепторов ФНО. В последующем, когда несколько притормаживается выделение гормонов из гипоталамуса, гипофиза, надпочечников, щитовидной и паращитовидных желез, возникает замедление процессов химической теплопродукции. В этих условиях происходит самоограничение системной реакции, реакции острой фазы при воспалении и повышения температуры внутренней среды организма при лихорадке. Модулирующее, главным образом, тормозное влияние на состояние гипоталамического центра терморегуляции оказывает и кора головного мозга. Вторая стадия лихорадки заключается в том, что при повышенной теплопродукции в организме постепенно начинает возрастать теплоотдача и эти процессы уравновешиваются. Увеличение температуры внутренней среды организма вызывает некоторую активацию тепловых рецепторов сердца, почек, вен, органов брюшной полости, теплочувствительных нейронов спинного мозга и переднего гипоталамуса. Параллельно происходит ограничение импульсной активности холодовых термонейронов теплорегулирующего центра, снижение активности адренергических нейронов заднего гипоталамуса и симпатических влияний, некоторая активация парасимпатических нейронов и холинергических влияний. Все это приводит к расширению периферических сосудов, увеличению притока теплой крови к внутренним органам и коже, повышению ее температуры, потоотделения и теплоотдачи. Кроме того, ФНО и ИЛ-1 снижают чувствительность гладких мышц к катехоламинам, что также ведет к расширению периферических сосудов и появлению ощущения тепла и жара, повышению теплоотдачи и незначительному понижению артериального давления. Воздействуя на эндотелий, указанные эндопирогены повышают проницаемость капилляров, увеличивают транссудацию и еще больше усиливают гипотензивный эффект и теплоотдачу. В результате разогревания кожи и других тканей понижается активность холодовых термосенсоров кожи, внутренних органов, ограничивается поток афферентной импульсации в центр терморегуляции к холодовым термонейронам переднего гипоталамуса и к адренергическим нейронам заднего гипоталамуса, что сопровождается снижением симпатических влияний на периферию. В связи с этим постепенно уменьшается активирующее влияние на нейроны мезэнцефалической и бульбарной ретикулярной формации, ядер черепно-мозговых нервов, на спинальные моторные и вегетативные симпатические нейроны. Одновременно снижается активность термосенситивных структур в С5–Тh1 сегментах спинного мозга. Описанные изменения лежат в основе уменьшения сократительного и несократительного термогенеза. При этом мышечная дрожь, как основной источник тепловой энергии, обычно исчезает по достижении температуры внутренней среды порядка 39,5–40,0 °С. Усиление теплоотдачи на фоне ограничения прироста теплопродукции препятствует дальнейшему повышению температуры тела и способствует установлению ее на более высоком уровне. Продолжительность второй стадии лихорадки связана с тем, насколько долго поддерживается повышенная концентрация пирогенов в крови. При инфекционной лихорадке это, в основном, определяется свойствами возбудителей болезни: как долго они могут инициировать образование вторичных эндогенных пирогенов в организме больного. Продолжительность этой стадии лихорадки может быть от нескольких часов до нескольких недель. Заключительная — третья стадия лихорадки характеризуется значительным преобладанием теплоотдачи над теплопродукцией и возвращением температуры тела первоначальному уровню. Последнее обусловлено уменьшением концентрации пирогенов в организме, постепенным восстановлением чувствительности нейронов гипоталамического центра к холодовым и тепловым прямым и рефлекторным воздействиям. В полном соответствии с нормализацией чувствительности интернейронов аппарата сравнения установочная точка температурного гомеостаза возвращается к исходному значению. При этом происходит еще более выраженное торможение активности адренергических нейронов, снижение симпатических влияний и усиление активности парасимпатических нейронов эффекторного отдела центра терморегуляции и холинергических влияний. В результате отмечается дальнейшее расширение периферических сосудов, увеличение кровоснабжения кожи, деятельности потовых желез и потоотделения. Параллельно возникает местное повышение образования брадикинина и вторичное стойкое увеличение просвета кожных сосудов, их кровенаполнения и теплоотдачи. Стимулируется перспирация и возрастает диурез. Постепенно происходит восстановление еще достаточно активных метаболических процессов, уменьшение теплопродукции и литическое (в течение нескольких суток) снижение температуры тела до исходной. Поведение больного в это время также способствует потерям тепла. Снижение температуры не является простым следствием исчерпания ресурсов пирогенов, а имеет характер активной реакции, управляемой, как указывалось выше, многочисленными естественными эндогенными антиперетиками. Необходимо не только прекращение воздействия этиологического фактора, но и создание активного сигнала на окончание заданной программы. В частности, установлению температуры на исходном уровне способствует возвратный поток импульсации от нейронов аппарата сравнения, стабилизирующий функцию термочувствительных нейронов аппарата измерения теплорегулирующего центра. К нормализации температуры тела приводит также восстановление импульсной активности периферических термосенсоров, расположенных в различных разогретых кровью органах и тканях. Однако следует отметить, что чрезмерно быстрое снижение концентрации пирогенов в крови и прекращение их действия на гипоталамический терморегулирующий центр может сопровождаться развитием критического (за 1–2 часа) снижения температуры тела до нормы. Преобладание в данный период тонуса парасимпатической нервной системы над симпатической оказывает отрицательные батмо-, дромо-, ино- и хронотропный эффекты на сердце, что приводит к ослаблению сердечной деятельности, резкому расширению периферических сосудов, падению величины артериального давления и нарушению центральной гемодинамики. Следовательно, критическое снижение температуры тела сочетается с развитием острой сосудистой недостаточности — коллапса, особенно часто возникающего у детей. В соответствии с клиническими признаками стадии лихорадки получили характерное обозначение: озноб–жар–пот. Особенности терморегуляции и развития лихорадки у детей Лихорадка у детей развивается обычно после 3 месяцев жизни. При этом температура тела повышается медленно и, как правило, не удерживается на высоком уровне, особенно на фоне колебания температуры окружающей среды. Резкий подъем температуры тела нередко не сопровождается развитием озноба и мышечной дрожи. Основным источником тепла у них является активация метаболизма и распад бурой жировой ткани. Бурый жир располагается в межлопаточной области, за грудиной в средостении, вдоль аорты, крупных, сосудов, позвоночника и симпатического ствола, в подмышечной области, в брюшной полости, вокруг почек, надпочечников и в комочках Биша в щеках младенцев. Бурая окраска этого жира обусловлена обилием капилляров и митохондрий с их железосодержащими окрашенными цитохромами. Бурый жир — самый мощный источник тепла в организме. Клетки бурого жира снабжены большим количеством норадреналовых рецепторов и симпатических норадренергических нервных окончаний. У новорожденных в буром жире вдоль позвоночника находятся парааортальные ганглии Цукеркандля, представляющие скопление хромаффинной ткани, вырабатывающей норадреналин. В инкрете мозгового слоя надпочечников в течение 3–4 месяцев внеутробной жизни превалирует норадреналин. Активация симпатических влияний, хромаффинной ткани надпочечников и органов Цукеркандля нейрогенным и гуморальным путем стимулирует залповый липолиз и термогенез в бурых липоцитах. Это связано с тем, что адреналин и норадреналин при воздействии на рецепторы адипоцитов, активируют пептид термогенин, локализованный на внутренней поверхности митохондрий жировых клеток, усиливают распад жирных кислот, стимулируя нефосфорилирующее окисление, и теплообразование. Только за счет усиления обменных процессов в бурой жировой ткани у новорожденных выработка тепла может увеличиться на 100–200 %. Разогрев крови в крупных сосудах и системный эффект свободных жирных кислот способствуют повышению температуры. Кроме того, разогретая кровь от скоплений паравертебрального бурого жира оттекает через уникальные венозные анастомозы новорожденных в спинномозговой венозный синус и подогревает спинальные термосенсоры в сегментах С5–Тh1. В результате тормозиться дрожательный термогенез, но сохраняется тоническая мышечная активность. Следовательно, в механизмах повышения температуры тела при развитии лихорадки у новорожденных основную роль играет несократительный термогенез, тогда как сократительный практически не имеет значения. Особенности развития лихорадки объясняются еще и тем, что у детей первого года жизни имеет место функциональная неполноценность регуляторного центра нейрогенного сосудистого тонуса, термосенситивного рецепторного аппарата и низкая чувствительность гипоталамических нейронов к пирогенам. Кроме того, отмечается неустойчивость обмена веществ, недостаточное потоотделение, слабое развитие скелетных мышц, теплоизолирующих свойств кожи и подкожной клетчатки, большая удельная поверхностьтела, что выражается в несовершенстве химической и особенно физической терморегуляции. В условиях неполноценной физической терморегуляции не происходит существенного ограничения теплоотдачи, поэтому у значительной части детей первого года жизни лихорадка может вообще не проявляться. Однако при тяжелых инфекционных заболеваниях нередко отмечается высокая температурная реакция. В этих случаях повышение температуры тела связано с усилением теплопродукции в основном за счет воздействия токсических веществ, вызывающих разобщение свободного дыхания и окислительного фосфорилирования в клеточных элементах различных тканей. В раннем возрасте лихорадка может осложняться нарушением теплообмена и развитием гипертермии. У детей в возрасте старше 1 года лихорадка в неосложненных случаях развивается так же, как у взрослых, выполняя положительную, а нередко, и отрицательную роль. При этом системные и местные метаболические расстройства, их клинические проявления могут быть обусловлены патогенным эффектом самих пирогенных цитокинов. Дата добавления: 2015-11-26 | Просмотры: 592 | Нарушение авторских прав |