|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
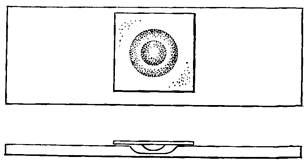
Практическая часть. Микроскопия микроорганизмов в живом состоянииМикроскопия микроорганизмов в живом состоянии. Для изучения формы и выявления подвижности бактерии изучают в живом состоянии в препаратах раздавленной или висячей капли. Раздавленная капля. На предметное стекло наносят каплю бульонной культуры. При обильном росте микробов культуру предварительно разводят стерильным изотоническим раствором хлорида натрия. Нанесенную на предметное стекло каплю раздавливают. Для этого покровное стекло ставят на ребро у края капли и опускают, постепенно вытесняя воздух, находящийся между предметным и покровным стеклами, чтобы избежать образования в ней пузырьков воздуха. В правильно приготовленном препарате раздавленной капли стекла плотно склеиваются и жидкость тончайшим слоем заполняет пространство между ними, не выступая за края покровного стекла. Висячая капля (рис. 3). На середину необезжиренного покровного стекла наносят небольшую, с четкими краями каплю бульонной культуры. Каплю материала покрывают предметным стеклом с лункой, края которой предварительно смазывают вазелином. Предметное стекло с прилипшим к нему покровным стеклом перевертывают. Капля оказывается висячей в герметически закрытой влажной камере, из которой жидкость испаряется очень медленно и поэтому препарат долгое время остается пригодным для наблюдения.
Рис. 3. Препарат «висячая капля» Висячую каплю микроскопируют с плоским зеркалом и суженной диафрагмой. При малом увеличении (8×) находят край капли, отчетливо видный в затемненном поле зрения. По одну сторону линии (края) видно множество мельчайших капелек конденсата, осевших на внутренней поверхности покровного стекла, по другую сторону линии фон равномерно серого цвета — искомая капля. Найденный край капли устанавливают в центре поля зрения микроскопа при малом увеличении и, не сдвигая препарата, переходят на более сильную (40×) или иммерсионную систему, слегка расширив диафрагму микроскопа. Подвижные бактерии проходят с одинаковой скоростью большие пространства, иногда через все поле зрения микроскопа, вращаясь вокруг своей оси. Живые микробы, находящиеся в препарате раздавленной капли, можно изучать и в темном поле зрения. При этом методе микроскопирования толщина предметных стекол не должна превышать 1,2 мм, покровных — 0,2 мм. Принцип исследования микробов в темном поле зрения заключается в том, что в объектив и, следовательно, в глаз наблюдателя попадают не прямые лучи света, а отраженные исследуемым объектом. Вследствие этого неосвещенное поле зрения остается совершенно темным, а микробные тела, отражающие лучи света, освещены очень ярко. При микроскопировании препаратов в темном поле зрения на верхнюю поверхность конденсора наносят каплю кедрового или вазелинового масла, поверх которой очень осторожно, чтобы не образовалось пузырьков воздуха, накладывают препарат. На покровное стекло наносится вторая капля масла. Наносить масло на обе поверхности препарата необходимо для того, чтобы при микроскопировании с иммерсионной системой проходящие лучи света не преломлялись. Препарат «отпечаток». Из агаризованной среды, на которой микроорганизмы растут сплошным газоном или в виде отдельных колоний, вырезают скальпелем небольшой кубик и переносят его на предметное стекло так, чтобы поверхность с микроорганизмами была обращена вверх. Затем к газону или к колонии прикладывают чистое покровное стекло, слегка надавливают на него петлей или пинцетом и тотчас же снимают, стараясь не сдвинуть в сторону. Полученный препарат помещают отпечатком вниз в каплю воды или метиленового синего (1:40) на предметное стекло. Отпечаток можно получить и на предметном стекле, если касаться поверхности колонии или газона предметным стеклом. Препараты живых клеток рассматривают с «сухими системами» микроскопа. Препараты, работа с которыми закончена, прежде чем вымыть, выдерживают в дезинфицирующем растворе. Препарат «микрокультура» или «агаровая пленка». На тонкое, простерилизованное и нагретое предметное стекло наносят стерильной нагретой пипеткой 0,2—0,3 мл горячей агаризованной питательной среды и распределяют по всей поверхности стекла. После застывания среды петлей удаляют лишний агар, оставляя два тонких участка пленки величиной с покровное стекло каждый. В центр квадратов бактериальной петлей или пипеткой наносят каплю жидкой культуры или суспензии клеток микроорганизма. Стекло помещают во влажную камеру (чашка Петри со слоем мокрой фильтровальной бумаги), которую ставят в термостат. Перед микроскопированием на пленку с выросшей микрокультурой наносят каплю красителя или каплю воды в случае подсыхания пленки и затем осторожно накрывают покровным стеклом. Метод, основанный на получении роста микроорганизма непосредственно на предметном стекле, позволяет вести микроскопическое наблюдение за процессами роста и развития, влиянием токсических и других агентов на эти процессы. На препаратах не нарушается естественное расположение клеток в растущей колонии. Приготовление фиксированных препаратов. Для изучения микроорганизмов в окрашенном виде на предметном стекле делают мазок, высушивают, фиксируют его и после этого окрашивают. Исследуемый материал распределяют тонким слоем по поверхности предметного хорошо обезжиренного стекла. Техника приготовления мазков определяется характером исследуемого материала. 1. Приготовление мазков из микробных культур с жидкой питательной среды. Маленькую каплю исследуемой жидкости наносят бактериальной петлей на предметное стекло и круговыми движениями петли распределяют равномерным слоем в виде кружка диаметром в копеечную монету. 2. Приготовление мазка из культур с плотных питательных сред. На середину чистого, хорошо обезжиренного стекла наносят каплю водопроводной воды, в нее вносят бактериальную петлю с небольшим количеством исследуемой микробной культуры так, чтобы капля жидкости стала слегка мутноватой. После этого излишек микробного материала на петле сжигают в пламени горелки и приступают к приготовлению мазка по описанному выше способу (1). Высушивание и фиксирование мазков. Приготовленный на предметном стекле мазок высушивают на воздухе и после полного высыхания фиксируют. При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые. Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы. Физический способ фиксации. Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за ребра мазком кверху и плавным движением проводят 2—3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с. Надежность фиксации проверяют следующим простым приемом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога. Химический способ фиксации. Для фиксации мазков применяют также химические вещества и соединения (табл. 2). Предметное стекло с высушенным мазком погружают в склянку с фиксирующим веществом и затем высушивают на воздухе. Таблица 2. Вещества для химической фиксации
Контрольные вопросы 1. Перечислите методы исследования живых бактерий; 2. Что можно выяснить о бактериях по препарату «висячая капля»? 3. Для каких микроорганизмов используют препарат-«отпечаток»? 4. Что такое микрокультура? 5. В чем заключается суть фиксации препаратов? Приведите примеры физической и химической фиксации. Дата добавления: 2015-12-16 | Просмотры: 1440 | Нарушение авторских прав |