 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Генетический полиморфизм и патологияНовая стратегия исследований Чтобы глубже проникнуть в механизмы мультифакториального наследования, необходимо изменить стратегию исследований. Если прямой путь от фенотипа к генотипу не дает положительных результатов, 3. Формальная генетика человека 261
то более успешным может оказаться обратный путь от гена и его продукта к фенотипу. На первый взгляд такое предложение звучит парадоксально: мы начинали с фенотипа, поскольку не было другого подхода к генотипу. Любой другой путь оказывался перекрытым самой природой генетического материала. Вместе с тем мультифакториальная модель основана на совместном действии многих генов. С другой стороны, анализ генетически полиморфных систем оказался успешным в раскрытии природы изменчивости генов, определяющих первичную структуру антигенов клеточной поверхности, а также ферментов и сывороточных белков с множеством разных (и во многих случаях неизвестных) функций. Следовательно, нет ничего искусственного в том, чтобы попытаться выяснить, не являются ли некоторые из этих полиморфизмов компонентами мультифакториальной подверженности при патологии. Харрис и соавт. [1787] показали, что по крайней мере треть структурных генов, определяющих ферменты крови, полиморфна, т. е. и в «норме» далеко не все индивиды оказываются идентичными по производимым в их организмах генным продуктам: межиндивидуальные различия в структуре белков и ферментов - это обычная ситуация. По оценкам у человека имеется примерно от 50 000 до 100 000 структурных генов. Следовательно, теоретически должны существовать тысячи полиморфных систем, хотя сейчас выявлено лишь около 150. Вот почему, если не удается «нащупать» какую-либо патофизиологическую связь, поиск маркеров, сцепленных с тем или иным заболеванием, будет скорее всего бесполезным. Важное направление исследований - выявление новых полиморфных систем, которые в ближайшем будущем могут оказаться полезными для поиска индивидуальных генов, вовлеченных в детерминацию заболевания. Обнаружение новых маркеров очень важно также с точки зрения полноты генетической карты человека. Ассоциация заболеваний с группами крови Система АВО Вскоре после открытия групп крови АВО были высказаны предположения об ассоциации этих антигенов с определенными заболеваниями. Первый этап исследований подобного рода достиг своей кульминации в 20-е гг. В это время некоторые авторы считали, что почти все широко распространенные заболевания ассоциируют с группами крови. Однако большинство этих исследований осуществлялось на относительно малом материале с применением неадекватных методов. Результаты оказались крайне противоречивыми. В последующие годы многие специалисты разочаровались в этой гипотезе, но в своей критике (в основном оправданной) они выплеснули «ребенка вместе с водой»: долгое время считалось, что группы крови не ассоциируют с заболеваниями. Ошибочная гипотеза ведет к важному открытию. Открытие Rh-несовместимости матери и плода впервые продемонстрировало возможность ассоциации групп крови с заболеваниями. Спустя короткое время такая связь была обнаружена и для других распространенных заболеваний. В 1953 г. была описана ассоциация между группой крови А и раком желудка [552]. Еще раньше, в 1950 г., Стокс показал, что смертность от рака желудка в городах северной Англии в среднем выше, чем в южной Англии. По его мнению, такой эффект мог объясняться присутствием на севере некоторого вещества, являющегося раздражающим агентом для слизистой оболочки желудка. Он обнаружил слабую корреляцию уровня заболеваемости с жесткостью воды (содержанием кальция): в городах со слабокальцинированной водой больных раком желудка было меньше. Другой группе исследователей (Aird et al., 1953; [552]) показалось более реальным, что различие в заболеваемости раком желудка на севере и юге Англии детерминировано генетически. В то время были описаны линии мышей с высокой и низкой частотой рака. В поиске возможного генетического маркера они использовали аналогию с распределением антигенов АВО. В северной Англии чаще встречается группа О, а в южной - группа А. Рабочая гипотеза авторов 262 3. Формальная генетика человека
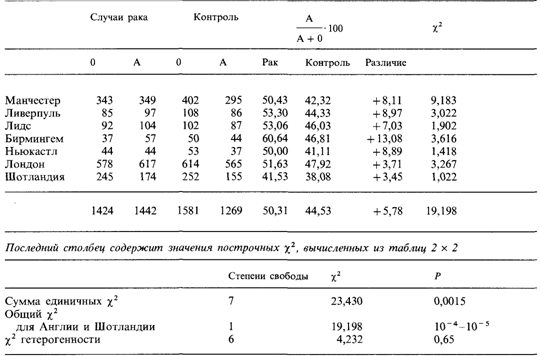
состояла в том, что группа О, вероятно, ассоциирует с предрасположенностью к раку желудка, что и определяет его более высокую частоту на севере Англии. Чтобы проверить эту гипотезу, они собрали сведения о больных раком в различных городах Англии и Шотландии и сравнили распределение групп крови АВО среди больных с распределением этих же антигенов в тщательно отобранных контрольных группах (как правило, это были больные, лечившиеся в тех же больницах, но по другому поводу). В табл. 3.22 представлены результаты этого исследования. В противоположность рабочей гипотезе была обнаружена значимая ассоциация с группой крови А, а не О. Это исследование вызвало поток работ по ассоциациям групп крови с различными заболеваниями. Стандартный статистический метод [959]. Прежде чем описывать наиболее важные результаты, уместно объяснить суть стандартного статистического метода, используемого в этом анализе. В двух выборках – больных и контрольной – сравниваются частоты двух признаков (или групп признаков, например, А против 0 или А + В + АВ против 0). Отношение
должно быть равно 1, если отношение А/0 одинаково в обеих выборках, т.е. если нет ассоциации. [A(Pat)-абсолютное количество индивидов с группой А в выборке больных и A(contr)абсолютное количество индивидов с группой А в контрольной выборке]. В противном случае отношение х будет больше или меньше 1. Это отношение х обычно называют «относительной частотой». В нашем примере оно означает, что частота рака желудка у лиц с группой А в х раз выше, чем у лиц с группой 0. Значимость отклонения x от 1 можно тестировать следующим образом:
χ2 отклонения = у2 w (с одной степенью свободы). Несколько оценок х можно объединить в 3. Формальная генетика человека 263
общую оценку:
Поток исследований и их результаты [211, 145]. Приблизительно за 15 лет был выявлен ряд ассоциаций для широко распространенных заболеваний (табл. 3.23). Помимо рака желудка, который исследовали по крайней мере в 101 выборке, еще для нескольких злокачественных новообразований было показано, что риск оказаться пораженным был несколько выше для больных с группой крови А. Такая же тенденция была установлена для ряда неопухолевых заболеваний, в частности для ревматических, пернициозной анемии и в очень большой степени для тромботических и тромбоэмболических заболеваний. С другой стороны, ассоциация с группой 0 была установлена для язвенной болезни двенадцатиперстной кишки. Эти данные показывают, что группа крови А определяет хотя и малый, но значимый вклад в предрасположение ее носителей к некоторым тяжелым заболеваниям, тогда как среди здоровых стариков по сравнению с общей популяцией чаще следует ожидать носителей группы 0. Такой вывод был подтвержден в исследовании лиц старше 70 лет, которые на момент обследования обладали все еще завидным здоровьем. Различие было особенно сильным, когда контрольная выборка состояла из пожилых людей, подвергавшихся хирургическим операциям [728]. Возможные смещения. В широкомасштабных статистических исследованиях возможны определенные смещения. 1. Выбор подходящего контроля. Распределение популяций людей по группам крови неравномерно. Несмотря на соответствие данных ожидаемым пропорциям Харди—Вайнберга, популяция может случайно подразделяться на группы с разными частотами изучаемых генов. Если контроль взят из другой, нежели больные, группы, то в результате можно установить ложную ассоциацию. Например, если группа крови 0 «дарует» особо хорошее здоровье ее обладателям, то в выборках доноров, среди которых с большей вероятностью можно ожидать лиц с хорошим здоровьем, частота аллеля 0 может оказаться слишком высокой. 2. Публикация только положительных результатов. Вполне понятно желание исследователей вознаградить себя «положительными» результатами, т. е. в нашем случае открытием ассоциации. Вот почему свои данные скорее всего опубликуют только те, кто нашел (возможно, случайно) значимую ассоциацию. Исследователи, которые оказались менее «удачливыми», могут не публиковать свои данные. Таким образом, накопление положительных публикаций ведет к ложной ассоциации. Было показано, что перечисленные смещения отсутствуют в случае установленных ассоциаций [211]. Успокаивает также то обстоятельство, что данные, собранные для многих других заболеваний, дают отрицательные результаты, хотя и в этих случаях выборки больных и контрольных индивидов собирались сходным образом, а вычисления проводились так, что, если и были смещения, то одинаковые. Примером могут служить врожденные пороки. Целая группа заболеваний, включающая врожденный порок сердца, расщепление губы и неба, поражение почек и мочевой системы, гидроцефалию и другие, не обнаружила никаких ассоциаций с группами крови, хотя было обследовано 4 762 больных и 156 716 контрольных лиц [211]. Неудачная попытка найти механизм ассоциации. В первые годы исследований ассоциаций групп крови и заболеваний многие авторы пытались спекулировать на биологических причинах ассоциаций и отводили эту роль веществам групп крови, например, в секретах желудка и двенадцатиперстной кишки. Более общая гипотеза пыталась объяснить ассоциации более сильным иммунным ответом носителей группы крови 0 по сравнению с носителями группы крови 264 3. Формальная генетика человека
266 3. Формальная генетика человека
А. Эта гипотеза стимулировала популяционно-генетические исследования, но экспериментальная ее проверка для таких широко распространенных заболеваний, как язва двенадцатиперстной кишки и рак желудка (разд. 6.2.1.8), не была проведена. Чтобы понять механизм ассоциаций, необходимо более детальное знание роли клеточной поверхности, особенно ее гликопротеинов, во взаимодействии с другими клетками и со средой. Тот факт, что до сих пор все попытки продемонстрировать убедительный механизм ассоциаций остались безуспешными, принес разочарование многим ученым. В последние годы поток работ по ассоциациям групп крови с заболеваниями почти полностью иссяк. Стало ясно также, что общий вклад генов АВО в генетическую этиологию этих болезней, вероятно, мал, как показано, например, при изучении язвенной болезни [637]. Таким образом, результаты этих исследований, хотя и являются статистически значимыми, в частности, в случае язвенной болезни, рака желудка и некоторых других заболеваний, но они мало что прибавляют к пониманию генетических и средовых причин этих форм патологии. Kell-система Мутации системы Kell, акантоцитоз и хронический грануломатоз. Помимо ассоциаций ряда заболеваний с распространенными группами крови известны некоторые примеры наследственных аномалий, связанных с редкими генами или с генами-модификаторами генов «групп крови». В разделе 3.1.7 мы упоминали гены-модификаторы системы групп крови АВО, они известны лучше других и не влияют существенно на здоровье своих носителей. Примером прямой ассоциации между аллелями редкой группы крови и заболеванием может служить система групп крови Kell. Она особенно интересна, поскольку известно, что «вещество» Kell включено в структуру клеточных мембран. Для более глубокого понимания природы других ассоциаций заболеваний крови и, например, системы HLA важно знать мембранные функции, а для этого особенно полезными могут оказаться именно такие редкие аллели, как Kell. В популяциях европейского происхождения обнаруживаются два аллеля аутосомного локуса Kell: K и k, более редкий из них К имеет частоту 0,05. С другой стороны, у 14-20% американских негров найден аллель Kell-системы Js, крайне редкий в других популяциях. Этот аллель служит превосходным маркером для лиц африканского происхождения. Гемолитическая анемия новорожденных редко вызывается анти-Kell антителами, но когда это случается, основной механизм сходен с таковым при резус-конфликте. Кроме аутосомного локуса антигена Kell идентифицирован Х-сцепленный локус, который кодирует вещество-предшественник Kell, известное как Кх. В норме все люди имеют Кх-антигенную детерминанту как на эритроцитах, так и на лейкоцитах. Некоторые индивиды гомозиготны по нулевому («немому») аллелю (Ко) [609] того же локуса Kell. В этом случае нет обычных антигенов Kell, но можно выявить сильную Кхреакцию [777]. Данный результат не противоречит предположению о том, что нормальная Кхдетерминанта, контролируемая Х-сцепленным локусом, является единственной связанной с Kell-антигеном у гомозиготных носителей Ко(или немого) аллеля. Такие лица клинически и гематологически нормальны. Были идентифицированы мутации по локусу Кх, которые проявляются или в эритроцитах, или в лейкоцитах, или в обоих типах клеток [776]. Маклеодовский фенотип эритроцитов [957] обусловлен Х-сцепленной рецессивной мутацией, вызывающей отсутствие Кх-детерминанты. Это приводит к аномалии мембраны эритроцитов – акантоцитозу («колючие» эритроциты) и их разрушению. Тяжесть гемолиза может меняться от компенсируемого разрушения небольшого числа клеток до тяжелой гемолитической анемии [776]. А-Р-липопротеинемия [592] - обычная причина акантоцитоза (14595)-в этих случаях отсутствует. Ясно, что аномалии эритроцитов вызваны отсутствием Кх-антигенов, поскольку клетки, в которых отсутствуют все Kell-антигены, за исключением Кх (Ко), морфологически нормальны. Так как речь идет об Х-сцепленном рецессивном признаке, экспрессия маклеодовского фенотипа выявляется только у мужчин. Матери мужчин с маклеодовским (т. е. мутантным Кх-фенотипом) гетерозиготны как по нормальному Кх(+)-, так и по мутантному Кх(—)-аллелю. В соответствии с принципом инактивации Х-хромосомы (разд. 2.2.3.3) такие гетерозиготные женщины должны быть функциональными мозаиками, у которых в части клеток экспрессируется нормальный Кх(+)-, а в других – мутантный Кх(—)-аллель. Действительно, в популяции эритроцитов у них обнаруживаются и нормальные, и аномальные клетки [890]. Такой мозаицизм можно продемонстрировать с помощью иммунологических и морфологических методик, поскольку Кх(—)-клетки являются 3. Формальная генетика человека 267
акантоцитами. Нормальные клетки превышают по численности аномальные, что объясняется укорочением жизни Кх(—)- эритроцитов по сравнению с Кх (+)-клетками. Х-сцепленная Кх-детерминанта предположительно связана с мембранным белком, мутации в этом локусе приводят к патологически мембранным перестройкам, что вызывает морфологические аномалии эритроцитов и гемолиз. Эффекты мутаций, нарушающих Кх-антигены, часто проявляются и в лейкоцитах. Например, у нескольких мальчиков с хроническим грануломатозом (CGD) были идентифицированы Kell-типы [682]. Позже было показано, что это тоже мутации Кх-локуса. Больные с CGD характеризуются повышенной восприимчивостью к относительно слабым бактериальным патогенам. Развитие болезни выражается в инфекционном поражении кожи, лимфатических узлов и легких, часто наблюдаются лимфаденопатия, гепатоспленомегалия и гипергаммаглобулинемия. Еще до выявления ассоциации с группой крови Kell было установлено, что во многих случаях это Х-сцепленная аномалия. Лейкоциты при этом заболевании обнаруживают снижение способности убивать многие бактерии, но фагоцитарная и лизосомальная активности сохраняются [715]. Истинная связь мутантного Кх-гена с пониженной бактерицидной активностью лейкоцитов еще не выяснена, но возможно, что Кхмембранный антиген вовлечен в активацию NADH-дегидрогеназы, необходимой для проявления бактерицидной активности [776]. Все другие лейкоцитарные антигены нормальны. У некоторых больных с грануломатозом было снижено содержание Кх-вещества как в лейкоцитах, так и в эритроцитах. В этих случаях наряду с грануломатозом обнаруживались акантоцитоз и гемолиз [776]. Большинство больных с Кх-ассоциированным CGD имели нормальные эритроциты, хотя выявлено несколько больных с Х-сцепленным акантоцитозом (маклеодовский фенотип) и нормальными лейкоцитами. Известны по крайней мере шесть Х-сцепленных и три аутосомно-рецессивных типа CGD. При этом обнаруживаются разные ферментативные дефекты: нарушение инициации окислительного фосфорилирования, дефекты в обеспечении NADPH и недостаточность цитохрома b. Таким образом, описанный синдром весьма гетерогенен, а Кх-недостаточность является лишь одним из нескольких типов [714]. 3.7.3. Система HLA и заболевания [888, 207а] Как уже говорилось (разд. 3.5.5), локусы главного комплекса гистосовместимости (МНС) расположены в хромосоме 6 человека и гомологичны генам комплекса Н2 мыши [113]. Иммунизация инбредных линий мышей разными, явно неродственными антигенами (синтетическими полипептидами, сывороточными белками, антигенами клеточных поверхностей) индуцирует высокие уровни антител в одних линиях и низкие уровни (или отсутствие ответа) в других. Количество индуцированных антител контролируется локусами иммунного ответа (Ir), которые являются частью комплекса Н2. Заражение мышей вирусом лейкемии вызывает рак, более легкий в одних линиях, чем в других [766]. Эти различия контролируются генами, которые, подобно генам Ir, относятся к комплексу Н2 [741; 740; 765; 783]. Позже было продемонстрировано сцепление комплекса Н2 с генетическими факторами предрасположения к аутоиммунному тиреоидиту мышей [859] и восприимчивости к лимфоцитарному вирусу хориоменингита. В случаях устойчивости к лейкемогенезу и восприимчивости к инфекции вирусом хориоменингита не удалось обнаружить какие-либо специфические антитела. Однако иммунный ответ обнаружен в случае тиреоидита. Здесь удалось установить связь между конкретным типом антигена трансплантации, наличием специфических антитироглобулиновых антител и тяжестью болезни. Это было важным шагом на пути к выяснению механизма ассоциации. (Между прочим, можно упомянуть, что у человека была описана ассоциация между аутоиммунным тиреоидитом и антигеном HLAВ8.) Эти результаты свидетельствовали о том, что у человека гены иммунного ответа могут быть тесно сцеплены с HLA-генами. Поскольку для хорошо изученных генов системы HLA у человека было продемонстрировано неравновесие по сцеплению, наличие этого же свойства можно предположить и для гипотетических генов иммунного ответа. Следовательно, ассоциации забо- 268 3. Формальная генетика человека
леваний с антигенами системы HLA, вообще говоря, можно было предвидеть. Первой аномалией у человека, проанализированной с этой точки зрения, была болезнь Ходжкина - злокачественное новообразование лимфатической системы. Обследование 523 больных обнаружило значимую ассоциацию с HLA-1. Исследования при других злокачественных новообразованиях, в частности при острой лимфатической миелогенной лейкемии, дали противоречивые результаты. Более сильные ассоциации были найдены для ряда незлокачественных заболеваний, в частности для анкилозирующего спондилита, спру, болезни Рейтера, множественного склероза и псориаза (табл. 3.24). В некоторых случаях степень ассоциаций была огромной. Для анкилозирующего спондилита, например, коэффициент X (разд. 3.7.2) оказался равным 87, т. е. болезнь была в 87 раз вероятнее у носителей HLA-типа В27, чем в общей популяции. Хотя почти все больные анкилозирующим спондилитом имели антиген HLA-B27, у большинства носителей этого антигена не было данного заболевания. Частота HLAВ27 в популяции белых в США составляет около 5%, а частота анкилозирующего спондилита – 1/2000. Однако тщательные клинические и рентгенологические исследования показали, что у 20% носителей В27 обнаруживаются незначительные клинические и рентгенографические признаки, свидетельствующие о наличии легкой формы анкилозирующего спондилита [48]. Сравнение ассоциаций аллелей системы антигенов HLA и групп крови АВО с теми или иными заболеваниями выявляет некоторые различия. HLA-ассоциации, как правило, намного сильнее. Для большинства ассоциаций с группами крови АВО характерно, что относительные частоты среди больных превышают частоты в контрольных группах не более чем вдвое, тогда как для HLA-ассоциаций эти частоты обычно намного выше. Однако очень высокая предрасположенность носителей антигена HLAВ27 к анкилозирующему спондилиту была исключением, для большинства ассоциаций эти частоты значительно ниже. Таким образом, имеющиеся данные свидетельствуют о том, что вклад HLA-антигенов в мультифакториальные системы, вызывающие указанные выше заболевания, значительнее, чем вклад антигенов АВО при тех заболеваниях, с которыми они обнаруживают ассоциацию. Следовательно, попытки вскрыть механизм HLA-ассоциаций имеют больше шансов на успех. Существуют ли на самом деле HLA-сцепленные гены иммунного ответа у человека? И каков способ их действия? Важная роль, которая принадлежит HLA-антигенам в иммунном ответе (разд. 3.5.5, [623]), предполагает наличие генетической изменчивости иммунного ответа, зависящей от различных HLA-типов. Что касается истинной природы этой зависимости, то для ее объяснения можно предложить по крайней мере пять механизмов. 1. HLA-антигены на поверхности клетки могут действовать как рецептор для вируса или другого патогенного агента. Эту возможность следует проверить, особенно если ассоциация столь же сильная, как при анкилозирующем спондилите. 2. Вторая возможность - перекрестные реакции HLA-антигенов с вирусными или бактериальными антигенами, что приводит либо к более слабому иммунному ответу вследствие иммунологической толерантности, либо к более сильному ответу на чужеродный антиген. Эти механизмы обсуждались для ассоциаций между группами крови и инфекционными заболеваниями и будут описаны позже в контексте естественного отбора (разд. 6.2.1). 3. Ассоциация может возникать вследствие неравновесия по сцеплению с антигеном HLA из этого же или других HLA-локусов. Было показано, например, что ассоциации с аутоиммунными заболеваниями могут быть связаны главным образом (или исключительно) с локусом HLA-D/DR. Однако аллели этого локуса обнаруживают неравновесие по сцеплению с аллелями локуса В. Это может вызвать более слабую ассоциацию с антигенами локуса В. Например, была найдена ассоциация между юношеской формой сахарного диабета (аутоиммунная форма) и HLA-B8. Однако, когда дополнительно проанализировали локус D, 3. Формальная генетика человека 269
4. Ассоциация вследствие неравновесия по сцеплению может иметь место также и в том случае, если редкая мутация повреждает ген, тесно сцепленный с локусами МНС, но функционально с этой системой несвязанный. 5. Пятая и наиболее вероятная возможность - это гипотеза о том, что гены иммунного ответа (Ir) тесно сцеплены с генами комплекса HLA, причем между ними существует сильное неравновесие по сцеплению. Сильным аргументом в пользу этой 270 3. Формальная генетика человека концепции могут служить обсуждавшиеся выше аналогичные результаты у мыши. Эта гипотеза вовсе не исключает идею о том, что HLA (или Ir) антигены на поверхности клетки могут действовать как рецепторы для патогенных агентов. Эту концепцию можно проверить непосредственно с помощью семейных исследований двух типов. Обнаружение одновременно заболевания и одинаковых HLA-антигенов у пораженных членов одной семьи совместимо с гипотезой о вирусных рецепторах и с гипотезой о кросс-реакциях с микробными антигенами, а также с гипотезой тесно сцепленных генов иммунного ответа. Комбинация Ir-аллелей в транс-положении с HLA-аллелями, которые обычно ассоциируют с ними вследствие неравновесия по сцеплению, означала бы наличие семей, в которых ни один из заболевших не обнаружил бы гаплотипов с антигеном, обычно ассоциирующим с болезнью. Такие семьи и в самом деле наблюдались. Однако при неравновесии по сцеплению в большинстве семей с пораженными маркерный ген системы HLA и ген болезни будут находиться в цис -положении, а в меньшей части семей - в транс -положении. Следовательно, для семей, несущих этот ген в транс -положении, предсказание на основе гипотезы Ir-локуса противоречило бы предсказаниям на основе других гипотез. Если ассоциация Ir-антигенов с болезнью является следствием тесного сцепления с Ir-генами, то возможно также, что в одной популяции последние сцеплены предпочтительно с одним из аллелей HLA-системы, а в других популяциях - с иными аллелями этой системы. Следовательно, исследования HLA-ассоциаций с заболеваниями, особенно если они проводятся в разных расовых популяциях, могут привести к противоположным результатам. Ассоциация определенной болезни аллелями системы HLA, может пролить свет на патогенез этой болезни. Например, при множественном склерозе иммунологические исследования причин HLA-ассоциаций обнаружили специфически сниженный клеточный иммунитет к кори и другим парамиксовирусам [662, 689]. Множественный склероз ассоциирует с HLA-B7. Этот же антиген обнаруживает ассоциацию с лепроматозной проказой (тип проказной инфекции с особенно слабым ответом Тлимфоцитов и, следовательно, слабым клеточным иммунитетом [668]). Полученные результаты привели к заключению, что носители антигена В7 могли быть «слабыми ответчиками», т.е. их Т-лимфоцитам требуется больше времени, чтобы ответить клеточной пролиферацией на определенные антигенные стимулы. Это может помочь раскрытию механизмов HLA-ассоциаций с заболеваниями. Предварительный вывод таков: множественный склероз может вызываться медленной вирусной инфекцией, первично поражающей лиц, предрасположенных к ней вследствие (сцепленного с HLA) аномального иммунного ответа. Тот факт, что юношеская форма диабета обнаруживает ассоциацию с HLA-антигенами, а взрослая - нет, подтверждает точку зрения относительно разной этиологии этих форм диабета, а также то, что юношеский диабет может иметь аутоиммунную или вирусную этиологию. Об этом же свидетельствует намного меньшая конкордантность идентичных близнецов в случае юношеского диабета по сравнению с близнецовыми данными при взрослой форме диабета [906] (разд. 3.8.14). Результаты совсем недавних исследований позволяют говорить о двух типах юношеского сахарного диабета: один тип ассоциирует с HLA-D3 (или В8) и развивается, по-видимому, по аутоиммунному механизму, а другой ассоциирует с D4, причем больные этой формой часто отвечают на введение экзогенного инсулина выработкой антител. Следовательно, анализ HLA-ассоциаций может способствовать важным уточнениям нозологической классификации в пределах группы сходных заболеваний и, кроме того, может помочь в выявлении генетической гетерогенности в этой группе. Некоторые гипотезы, касающиеся функциональной значимости всего МНС района в хромосоме 6, обсуждались в разд. 3.5.5. Этот хромосомный район содержит крупный кластер тесно сцепленных генов - все с
3. Формальная генетика человека 271 близкородственными функциями. Изучение ассоциаций этих генов с заболеваниями поможет пролить свет не только на этиологию определенных болезней, но и на механизмы ряда важных функций в норме. Сцепление и ассоциация. Необходимо тщательно разграничивать сцепление и ассоциации. Сцепление относится к двум генам, расположенным в одной хромосоме на определенном (и определяемом) расстоянии друг от друга. Термин «ассоциация» часто используется в том случае, когда при конкретном заболевании (или при наличии какого-то признака) наблюдается более высокая частота определенного гена-маркера. Ассоциация не подразумевает, что ген болезни и маркерный ген расположены в одной хромосоме. При обсуждении частот HLA-аллелей при разных заболеваниях могут возникнуть недоразумения, касающиеся этих понятий [809]. Мы уже упоминали, что комплекс локализован в хромосоме 6. Тесно сцеплен с этим комплексом ген недостаточности 21-гидроксилазы [633], который в гомозиготном состоянии приводит к врожденной гиперплазии надпочечников (20910). Аналогично с HLA-локусами сцеплен ген одной из форм спиноцеребелярной атаксии (16440) [725]. Имеющиеся данные по гемохроматозу [болезнь накопления железа (14160), которая наследуется предпочтительно как аутосомно-рецессивный признак, причем иногда с проявлением у гетерозигот] можно интерпретировать так, что ген этой болезни также сцеплен с HLA-комплексом [872а, 8726, 745]. Все перечисленные болезни являются моногенными, соответствующие гены расположены на определенном, вполне измеримом расстоянии от HLA-комплекса в хромосоме 6. Однако нет оснований считать, что эти заболевания и HLA-комплекс физиологически как-то связаны. С другой стороны, болезни, с которыми ассоциируют аллели HLA-комплекса, не являются моногенными признаками, а имеют обычно мультифакториальную природу. Для ряда таких заболеваний (хронический гепатит, миастения гравис, ревматоидный артрит, болезнь Аддисона, тиреотоксикоз, юношеская форма сахарного диабета, детская спру и множественный склероз) установленные ассоциации касались D/DR-антигенов HLA-системы [623]. Общей характерной чертой при этих заболеваниях является наличие аутоантител, в связи с чем они были классифицированы как аутоиммунные заболевания или по крайней мере как иммуноассоциированные болезни. Семейные исследования показали значимое накопление случаев заболевания среди родственников пробандов, хотя четкое менделевское наследование отсутствовало. Однако относительный риск для носителей DR-антигенов проявить то или иное заболевание в целом невысокий и примерно в 2-8 раз превышает частоту в контрольной популяции (кроме детской формы спру, наблюдавшейся среди этих носителей в 65 раз чаще, чем в контрольной популяции [582]). И здесь уместно использовать объяснения, излагавшиеся выше в случае ассоциаций ряда болезней с другими аллелями HLAкомплекса. Например, можно считать, что ассоциации обусловлены генами иммунного ответа (Ir), тесно сцепленными с D/DRаллелями, либо эти последние непосредственно вовлечены в механизмы иммунного ответа (через макрофаги Т-клеточной системы). Можно предположить, что на механизм ассоциаций так или иначе влияет вся клеточная поверхность, особенности которой определяются HLA-D/DR- и Ir-аллелями (а также, вероятно, другими тесно сцепленными генами) [818]. Органоспецифические аутоантитела определяют проявление различных аутоиммунных болезней. Неизвестно, однако, участвуют ли в этом дополнительные гены в других хромосомах. В продукцию аутоантител вовлечены, вероятно, и определенные средовые стимулы, часто вирусного происхождения, как это предполагается, например, в случае диабета, гепатита и множественного склероза. Индивиды с определенными D/DR-аллелями HLA-комплекса в большей степени восприимчивы к формированию антител, чем те, у которых такие гены отсутствуют. Это по крайней мере частично объясняет генетическую восприимчивость к аутоиммунным болезням. Таким образом, будучи ассоциированными, D/DR-гены HLA-комплекса и гены 272 3. Формальная генетика человека аутоиммунных заболеваний не являются сцепленными. 3.7.4. Полиморфизм α1-антитрипсина и патология [749, 653] Полиморфизм α1 -антитрипсина (PI). Группы крови АВО обнаруживают слабую ассоциацию с большим числом заболеваний, но убедительное объяснение этих ассоциаций пока отсутствует. Антигены системы HLA демонстрируют более сильную ассоциацию с меньшим числом заболеваний. Но хотя и в этом случае убедительное биологическое объяснение пока отсутствует, все же обсуждаются вполне разумные и, главное, экспериментально проверяемые гипотезы. Полиморфизм α1-антитрипсина ассоциирует у взрослых главным образом с одной болезнью - хронической эмфиземой легких, патогенез которой в определенной степени выяснен. Антипротеолитическая активность сыворотки человека была установлена Камю и Глеем (1897), а также Ханом (1897). Ландштейнер (1900) показал, что эта активность связана с альбуминовой фракцией. Из шести антипротеаз, идентифицированных в сыворотке человека, α1-антитрипсин и α2-макроглобулин имеют наибольшие концентрации. Оба этих белка ингибируют большое число протеаз, включая тромбин. Антипротеолитическую активность оценивают путем гидролиза искусственных субстратов трипсином в присутствии тестируемой сыворотки. Существует тесная корреляция между иммунологически измеряемой концентрацией и активностью. Концентрация быстро растет, например, при бактериальной инфекции, после введения противотифозной вакцины или во время беременности. Оказалось, что синтез происходит в печени. Межиндивидуальные различия впервые обнаружены в 1963 г. [755]. Предполагалось, что низкий уровень α1-антитрипсина определяется рецессивным геном. Однако с помощью электрофоретических методик и изоэлектрического фокусирования удалось идентифицировать по крайней мере 23 разных фенотипа (рис. 3.70; табл. 3.25). Генетической основой этой гетерогенности служат серии множественных аллелей. Локус был назван PI, а различные аллели-PIM, PIZ и т.п., фенотипы - М/М, M/Z и т. п. Во всех исследовавшихся до сих пор популяциях наиболее часто встречаются Р1М-аллели (М1; М2 и М3): их общая частота составляет 0,9 и выше. Другие, более редкие аллели обозначены буквами. Положение этих букв в алфавите дает приближенную картину электрофоретической мобильности. На рис. 3.70 показана электрофоретическая картина. Анализ нуклеотидной последовательности (разд. 2.3.3.4) клонированной кДНК показал, что, например, Z-вариант обусловлен единичной нуклеотидной заменой [751]. Особенно большое значение имеют варианты Z и S, поскольку именно они определяют существенное снижение уровня α1-антитрипсина. В случае другого, более редкого аллеля РI– активность этого белка у гомозигот (нулевой аллель) вовсе не обнаружена. Гетерозиготы РIМ/РI– имеют фенотип М с концентрацией около 50% от нормы.
Внутривенное введение противотифозной вакцины и диэтилстильбэстрола приводит к 100%-ному увеличению активности у лиц с ММ-типом. Гетерозиготы MZ-типа обнаруживают умеренное увеличение, тогда как у гомозигот ZZ вообще трудно выявить какое-либо увеличение активности. Ассоциация с хронической эмфиземой легких (ХЭЛ). Эриксон (1965) [651] выявил 33 гомозиготы ZZ-типа, по крайней мере у 23 из которых были обнаружены симптомы хронической эмфиземы легких.
3. Формальная генетика человека 273
На основе семейных данных Эриксон показал, что эмфизема легких в 15 раз чаще встречается среди этих гомозигот, чем в общей популяции. Это наблюдение было подтверждено многими исследователями на большом числе больных. В одной группе из 295 больных с этим диагнозом было выявлено 20 гомозигот PIZ, т. е. меньше ожидаемого, исходя из частоты гена. Чаще всего первые симптомы заболевания распознаются в третьем или четвертом десятилетии жизни. При обычной форме хронической эмфиземы легких заболевание полностью проявляется, как правило, после 50 или 60 лет. Для этой формы характерна атрофия легочной ткани и кровеносных сосудов в нижних долях. Достаточно интересно, что еще до того, как был открыт дефект α1-антитрипсина, среди больных хронической эмфиземой легких, врачи вы-
274 3. Формальная генетика человека
деляли особую группу больных с такими симптомами. Широко обсуждался вопрос, часто ли у гетерозигот проявляется ХЭЛ. Высказывалось мнение, что гетерозиготы имеют лишь трехкратный риск развития ХЭЛ по сравнению с М-гомозиготами [653]. Тесты на легочные функции обнаружили у гетерозигот более высокую частоту ряда нарушений и тенденцию к относительно позднему проявлению этих нарушений. Хроническая эмфизема развивается только у 70-80% гомозигот, а среди гетерозигот частота намного ниже. На проявление заболевания оказывают влияние средовые факторы: α1-антитрипсин ингибирует также протеолитические ферменты, освобождаемые гранулоцитами и макрофагами. Поэтому возможно, что эти ферменты, (они обычно высвобождаются при воспалительных процессах) в случае хронической эмфиземы недостаточно инактивированы. Если больной страдает повторными бронхитами вследствие, например, курения или частых инфекций, протеолитические ферменты будут вызывать аутолитические повреждения легких. Курение повышает опасность бронхиальных инфекций и способствует прогрессированию болезни [653]. Следовательно, Z/Z-гомозиготам и гетерозиготам следует воздерживаться от курения и избегать производств, связанных с раздражениями бронхов. Бронхиты необходимо лечить на ранней стадии и интенсивно. «Если мы сможем отучить индивидов с генотипом PIZ от курения, то мы продлим жизнь каждому из них на 15 лет» [653]. Другая болезнь, которая ассоциирует с низкими уровнями α1-антитрипсина у гомозигот, - детская форма цирроза печени. Эта ассоциация твердо установлена, но наблюдается реже, чем в случае хронической эмфиземы легких. Цирроз печени у взрослых также чаще распространен среди гомозигот ZZ. Значение новых исследовательских стратегий. Полиморфизм α1-антитрипсина интересен тем, что связанный с ним механизм разрушения легких можно объяснить. Этот случай явно контрастирует с ассоциациями, описанными для антигенов АВО и даже для системы HLA. В данном случае ситуация проще: носители одного из генотипов поражаются не всегда, но очень часто, и сама болезнь довольно специфическая, поскольку она была идентифицирована прежде, чем стала известна ее биохимическая причина. Статус Z/Z также можно рассматривать как рецессивную болезнь с «неполной пенетрантностью». Вероятно, множество других таких моногенно-рецессивных вариантов еще скрыто внутри больших групп мультифакториальных заболеваний: либо потому, что трудно идентифицировать фенотип, либо потому что учтены еще не все проявления патологии. Влияние аллеля PIZ на подверженность гетерозигот заболеванию, по-видимому, очень сходно с ситуацией в случаях АВО- и HLA-антигенных систем. Тяжелая форма хронической эмфиземы легких проявляется относительно редко, но клинически она сходна с более частой формой, осложняющей хронические бронхиты, т.е. дополнительные средовые и генетические факторы вносят в общую подверженность при этом заболевании, по-видимому, немалый вклад. Пример описанной ассоциации с наибольшей ясностью иллюстрирует недавно разработанную «непрямую» исследовательскую стратегию. Сначала на генетическом уровне идентифицируется генетический полиморфизм. Затем продукт конкретного гена определяется с помощью биохимических методов. Далее осуществляют поиск возможного влияния полиморфизма на экспрессию гена. В обсуждавшемся выше случае имела место недостаточность белка, т.е. низкая ферментативная активность, вследствие чего организм неадекватно отвечает на такие воздействия среды, как инфекция. Эта специфическая функциональная недостаточность приводит к заболеванию, особенно при наличии повышенной подверженности к раздражению слизистой бронхов вследствие средовых воздействий. Подобная стратегия исследований будет, вероятно, полезной в генетическом анализе и других заболеваний и признаков, при которых взаимосвязи генотипа и фенотипа настолько сложны, что исключают прямой путь с помощью менделевских ме- 3. Формальная генетика человека 275
тодов. В таких случаях приходится надеяться лишь на методы генетики количественных признаков. Ассоциации заболеваний с другими полиморфизмами [145]. Помимо описанных выше трех основных примеров ассоциаций были исследованы (и в ряде случаев достаточно успешно) другие примеры ассоциирующих полиморфизмов, включая другие системы групп крови [211], гаптоглобины и ощущение вкуса фенилтиомочевины (ФТМ). Некоторые из них будут описаны в разделе, посвященном популяционной генетике (разд. 6.1.2). Особый интерес представляют ассоциации между полиморфизмом аполипопротеина Е и атеросклерозом [916, 917] (разд. 3.13), а также вариантами третьей компоненты комплемента и некоторыми заболеваниями: аллель C3F, по-видимому, ассоциирует с ревматоидным артритом [590; 591; 657], гепатитом [657] и силой иммунного ответа. Недостаточность компонента С6 была обнаружена примерно у половины больных менингококковым менингитом. Если все эти ассоциации подтвердятся, то они будут представлять значительный интерес, потому что в этих случаях можно обсуждать вероятные гипотезы относительно биологических механизмов и генетических последствий. Дата добавления: 2015-12-16 | Просмотры: 1222 | Нарушение авторских прав |
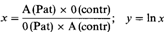 (3.10)
(3.10)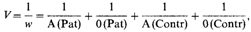
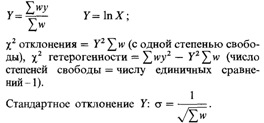

 3. Формальная генетика человека 265
3. Формальная генетика человека 265

 аллель D3 обнаружил намного более сильную ассоциацию с диабетом того же типа и, кроме того, D3 ассоциировался с аллелем В8 вследствие неравновесия по сцеплению. Следовательно, ассоциация диабета с аллелем В8, очевидно, была вызвана ассоциацией диабета с аллелем D3 и неравновесием по сцеплению.
аллель D3 обнаружил намного более сильную ассоциацию с диабетом того же типа и, кроме того, D3 ассоциировался с аллелем В8 вследствие неравновесия по сцеплению. Следовательно, ассоциация диабета с аллелем В8, очевидно, была вызвана ассоциацией диабета с аллелем D3 и неравновесием по сцеплению.
