 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ПерманганатометрияМетод перманганатометрии является одним из методов окислительно- восстановительного титрования. В основе этого метода лежат реакции окисления ионом перманганата – MnO4-. Окисление может проводиться при различных значениях рН. В щелочной и нейтральной средах (рН ³ 7) ион MnO4-, имеющий малиновую окраску, восстанавливается до MnO2 бурого цвета. При прямом титровании перманганатом в щелочной и нейтральной средах практически трудно уловить точку эквивалентности. В кислой среде (рН < 7) ион MnO4- восстанавливается до почти бесцветных ионов Мn2+ MnO4- + 8Н+ + 5е ® Mn2+ + 4H2O (Mn7+ + 5е ® Mn2+)
Применяя прямое титрование восстановителей в кислой среде раствором КMnO4, точку эквивалентности устанавливают без индикатора, так как по мере титрования раствор КMnO4 будет обесцвечиваться до тех пор, пока в титруемой колбе присутствует восстановитель. Как только весь восстановитель прореагирует, тогда от одной капли избытка КMnO4 весь раствор в колбе окрасится в слабо-розовый цвет. Это и будет указывать, что наступила точка эквивалентности. Можно титровать раствор КMnO4 раствором восстановителя. В этом случае в точке эквивалентности раствор перманганата калия обесцветится. Окислительно-восстановительный потенциал MnO4-/ Mn2+ равен 1,51 В. Используя титрование перманганатом в кислой среде, можно определять восстановители с потенциалом меньше 1,51 В. Приготовление рабочего раствора титранта КMnO4 не удовлетворяет требованиям, предъявляемым к исходным веществам, поэтому приготовить его раствор точной концентрации по навеске нельзя. Перманганат всегда содержит примеси продуктов восстановления, например, MnO2, т.е. не является химически чистым. Он легко разлагается под влиянием восстановителей (NH3 воздуха, органических веществ, попадающих в воду с пылью). Вследствие этого концентрация раствора KMnO4 после приготовления некоторое время уменьшается. В лабораторно-учебной практике его раствор готовят концентрацией примерно 0,05 н; титр его устанавливают через 7 или 10 дней после приготовления раствора. Хранить раствор следует в темноте или в склянках из тёмного стекла, т.к. свет ускоряет разложение KMnO4. Стандартными (исходными) веществами в перманганатометрии являются H2C2O4·2H2O, Na2C2O4, Fe, As2O3 и др.
Ход работы а) рассчитывают навеску КMnO4 для приготовления 250 мл примерно 0,05 н раствора по формуле: б) вычисленную навеску кристаллического КMnO4 отвешивают в химический стакан на технических весах, растворяют в горячей дистиллированной воде, добавляя воду небольшими порциями в химический стакан с навеской и сливая раствор каждый раз в мерную колбу (не допускать попадания в колбу кристаллов КMnO4). По окончании растворения КMnO4, раствор в мерной колбе охлаждают под краном. Перемешивают, доводят объем колбы до метки холодной дистиллированной водой. Колбу закрывают пробкой и оставляют в темном месте до следующего занятия. Для определения титра получившегося раствора пользуются, как правило, химически чистой щавелевой кислотой (Н2С2О4) или оксалатом натрия (Na2С2О4), которые для титрования готовятся из фиксанала или по навеске. Определение основано на реакции:
2KMnO4 + 5Н2С2О4 + 3Н2SО4 = K2SO4 + 2MnSO4 + 10CO2 + 8Н2О
окислитель 2 MnО 4- + 8Н+ + 5е ® Mn2+ + 4Н2О восстанавливается
Реакцию проводят при температуре 85°С, не допуская кипячения (происходит разложение оксалат-иона). Вначале реакция идёт медленно и требует интенсивного перемешивания. Так как образующиеся ионы Mn2+ катализируют данную реакцию (явление автокатализа), по мере накопления ионов Mn2+, реакция идёт быстро.
Тема: Энергетика химических реакций Содержание темы. Основные понятия термодинамики: система, типы систем, состояние системы, процессы, виды процессов, внутренняя энергия, теплота, работа, термодинамические функции. Первый закон термодинамики, энтальпия. Стандартная энтальпия образования вещества. Закон Гесса и его следствия. Энтальпия химических реакций. Термохимические расчеты. Калорийность продуктов питания. Второй закон термодинамики. Энтропия системы. Энергия Гиббса и её связь с энтальпией и энтропией системы. Термодинамический критерий самопроизвольного протекания процессов. Разделы, выносимые на самостоятельную проработку. Применение I начала термодинамики к живым системам. Расчет калорийности продуктов питания (СОХЖ, 83-84). Письменное задание для самостоятельной проработки. Разберите пример решения типовой задачи 3. Рассчитайте калорийность продуктов питания (по вариантам).
Домашнее задание для подготовки к занятию: СОХЖ с. 73-92, ЕОХ с. 21-32. Разберите примеры: 1,2,3 и ГЗХ 3,5,7,8, гл.V. Письменно выполните задания (нечетные номера к занятию 1, четные - к занятию 2). 1. Пользуясь табличными данными, рассчитайте тепловые эффекты реакций: а) С2Н5ОН (г) + ½ О2 (г) ® СН3СООН (ж) + Н2О (ж) б) С6Н12О6 (т) ® 2С2Н5ОН (ж) + 2СО2 (г) 2. Рассчитайте тепловой эффект реакции гидратации 2,24 л этилена до этилового спирта в стандартных условиях. 3. Вычислите стандартную теплоту образования сахарозы С12Н22О11, если тепловой эффект реакции: С12Н22О11 (т) + 12О2 (г) ® 12СО2 (г) + 11Н2О (ж) равен –5694 кДж. 4. Ферментативное дегидрирование пропанола-2 протекает по следующему уравнению:
ОН О Определите, какое количество энергии выделится или поглотится при этом, если известны энтальпии сгорания веществ (кДж/моль): DН0298(пропанола) = -2002, DН0298(ацетона)= -1789, D Н0298(Н2)= -285. 5. Напишите уравнение реакций, тепловой эффект которых был бы стандартной теплотой образования глюкозы; азотной кислоты; аммония хлорида. 6. Рассчитайте, сколько энергии получает грудной малыш при искусственном вскармливании 100 г молочной смеси «Детолакс», имеющей состав: белки 13,7%, жиры 27%, углеводы 53%. Сколько такой смеси требуется ребенку массой 4 кг, если суточная потребность энергии у детей первых трех месяцев жизни составляет в среднем 500 кДж/кг или 120 ккал/кг? 7. Подсчитайте калорийность традиционного завтрака англичан, съедающих около 300 граммов овсяной каши, имеющей состав: белки 9%, жиры 1,4%, углеводы 70%. 8. Стандартные теплоты образования NH3 и PH3 равны соответственно –46,2 и +5,1 кДж/моль. Кокой следует сделать вывод из этих данных об относительной устойчивости молекул NH3 и PH3? 9. Не проводя расчета, определите, как изменяется энтропия в следующих реакциях NH3 (г) + НСl (г) ® NH4Cl (т); COCl2 (г) ® СО2 (г) + Cl2 (г); PCl3 (г) + Cl2 (г) ® PCl5 (г) . 10. Определите возможность самопроизвольного протекания в стандартных условиях следующей реакции восстановления уксусного альдегида: О
СН3–С–Н (г) + Н2 (г) ® СН3СН2ОН (ж), DG0укс.альд.= -134 кДж/моль. 11.Дайте заключение о направлении самопроизвольного протекания реакции при 370С, определите, какой фактор: энтальпийный или энтропийный оказался решающим: СН3СООС2Н5 (ж) + Н2О (ж) ® СН3СООН (ж) + С2Н5ОН (ж) Для этилацетата: DН0обр.= -469,5 кДж/(моль.К), S0298= 259 Дж/(моль.К); для СН3СООН: S0298= 160 Дж/(моль.К) 12. Определите, каким процессом в организме: экзо- или эндоэргоническим является окисление молочной кислоты в пировиноградную (при 370С): СН3–СН–СООН фермент СН3–С–СН3 + Н2,
ОН О если известны для молочной кислоты DН0обр. = -673 кДж/моль, S0298 = 192 Дж/(моль.К), для пировиноградной кислоты DН0обр. = -586 кДж/моль, S0298 = 179 Дж/(моль.К) Факультативно. Решите задачи: ГЗХ 1981: №284, 295, 297, 300, 307, 308; или 1985: №289, 300, 302, 305, 312, 313. Дата добавления: 2015-12-16 | Просмотры: 2293 | Нарушение авторских прав |
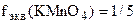
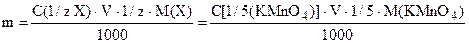
 восстановитель 5 2С2 О42- - 2е ® 2СО2 окисляется
восстановитель 5 2С2 О42- - 2е ® 2СО2 окисляется






