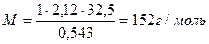|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач
Задача 1:Осмотическое давление. Закон Вант-Гоффа. Рассчитав осмотическое давление, опишите, что произойдет с эритроцитами, помещенными в 350 мл раствора хлорида кальция (М = 111 г/моль), содержащего 14 г растворенного вещества при 20°С? Решение: разбавленные растворы неэлектролитов обладают рядом свойств (коллигативные свойства), количественное выражение которых зависит от числа кинетически активных частиц растворенного вещества и растворителя, т.е. от их концентрации и не зависит от их химической природы! К ним относятся: осмотическое давление, понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания растворов по сравнению с чистым растворителем. Для электролитов вводится поправочный изотонический коэффициент, учитывающий увеличение числа частиц в растворе за счет диссоциации. Осмотическое давление раствора пропорционально его молярной концентрации и абсолютной температуре, согласно закону Вант-Гоффа: где: См - молярная концентрация, показывающая число моль растворенного вещества, содержащихся в 1 л раствора: R - газовая постоянная, 8.31 Дж/моль.К, T - температура, К; i -изотонический коэффициент. Для растворов неэлектролитов i =1, для растворов электролитов i > 1 и зависит от степени диссоциации (a) и числа образующихся при диссоциации ионов (n): i = 1+a(n-1) Учитывая определение молярной концентрации, уравнение Вант-Гоффа принимает вид: 1. Рассчитаем абсолютную температуру: T= 273 + t°C= 273 + 20= 293 К 2. Хлорид кальция - это средняя соль, сильный электролит. Его степень диссоциации равна 100% или 1. Он диссоциирует с образованием 3 ионов: CaCl2 ® Ca2+ + 2Cl-, т.е. a = 1, n = 3. Рассчитаем изотонический коэффициент: i = 1 + 1(3 – 1) = 3 3. Подставим найденные значения в уравнение Вант-Гоффа, учитывая, что объем раствора должен быть выражен в литрах, и рассчитаем Pосм. (в кПа):
4. Осмотическое давление раствора хлорида кальция равно 2632 кПа. Оно больше, чем осмотическое давление крови (Росм.крови = 770 кПа). Этот раствор является гипертоническим по отношению к крови. В таком растворе наблюдается явление осмоса, т.е. односторонняя диффузия растворителя через полупроницаемую мембрану оболочки клетки в сторону более концентрированного (гипертонического) раствора. Эритроцит обезвоживается, усыхает, т.е. подвергается плазмолизу.
Ответ: Эритроциты в растворе хлорида кальция подвергаются плазмолизу, т.к. этот раствор является гипертоническим по отношению к крови. Задача 2 Законы Рауля Рассчитайте, при какой температуре будет замерзать антифриз - водный раствор этиленгликоля (М = 62 г/моль), содержащий 310 г растворенного вещества в 500 г воды?
1. Рассчитаем массу растворенного вещества в 1000 г растворителя, составляя пропорцию: в 500 г H2O содержится 310 г в-ва в 1000 г - х 2. Вычислим, сколько моль составляет 620 г этиленгликоля.
3. Поскольку этиленгликоль - это неэлектролит, i = 1. 4. Найдем понижение точки замерзания раствора: Dtзам = i · K · Cm = 1· 1.86 · 10 = 18.6 5. Найдем температуру замерзания раствора, зная, что вода замерзает при 0°С. tзам = t (H2O) - t (р-ра) = 0 - 18.6° = -18.6° Ответ: раствор этиленгликоля замерзнет при -18.6°С. Измеряя понижение температуры замерзания различных растворов, рассчитывают молекулярную массу растворенного вещества (например, белка) или концентрации различных компонентов физиологических жидкостей (мочи, лимфы, крови). Этот метод называется криометрией.
Примечание: при решении задач № 2 и 3 можно воспользоваться готовыми формулами:
Задача 3. При растворении 13 г камфоры в 400 г диэтилового эфира температура кипения эфира повысилась на 0.453°. Определите молярную массу камфоры, если Е = 2.12 для диэтилового эфира.
1. Поскольку растворенное вещество (камфора) - это неэлектролит, i = 1. 2. Рассчитаем, сколько граммов растворенного вещества (камфоры) содержится в 1000 г растворителя (диэтилового эфира) 13 г в-ва содержится в 400 г р-ля х - 1000 г 3. Вычислим, сколько моль составляют 32.5 г камфоры, т.е. вычислим моляльную концентрацию: где М - молярная масса камфоры, которую надо вычислить. Подставим значение моляльной концентрации в уравнение Рауля: Dtкип.= i·E·Cm; Ответ: молярная масса камфоры равна 152 г / моль. Контрольные вопросы для самопроверки 1. В чем отличие растворов от химических соединений? 2. Что служит мерой растворимости веществ? Какие факторы влияют на растворимость веществ в жидкости? 3. Как вы представляете себе механизм растворения твердых веществ в жидкостях? 4. Из каких тепловых эффектов складывается суммарный тепловой эффект процесса растворения твердых веществ в жидкостях? 5. Как изменяется энергия Гиббса в процессе растворения твердых веществ? 6. Как влияет температура и давление на растворимость газов в жидкостях? 7. Какое давление газа принято называть парциальным? Сформулируйте закон Генри и Дальтона. Для каких газов эти законы выполняются, а для каких газов - нет? 8. Как влияет присутствие электролитов в растворе на растворимость газов? Сформулируйте закон Сеченова. 9. Объясните причину возникновения кессонной болезни с точки зрения закона Генри. 10. Какие свойства растворов называют коллигативными? Перечислите эти свойства. Какие растворы проявляют эти свойства? 11. Какой процесс называют диффузией? Какой процесс называют осмосом? Чем отличается осмос от диффузии? 12. Что называется осмотическим давлением? Как его измеряют и как его можно рассчитать по закону Вант-Гоффа? 13. Зависит ли величина осмотического давления от природы растворенного вещества? от природы растворителя? 14. Какие растворы подчиняются закону Вант-Гоффа? 15. Какие растворы получили название изотонических, гипотонических, гипертонических? Какой раствор носит название «физиологического»? 16. Охарактеризуйте явления гемолиза и плазмолиза. 17. Изотоничны ли растворы сахара и глицерина, имеющие концентрацию: а) 0.1 моль/л; б) 2%? 18. Из чего складывается осмотическое давление плазмы крови? Какое давление называют онкотическим? 19. Какой пар называют насыщенным? Процесс испарения - это экзо- или эндотермический процесс? 20. Как влияет на величину давления насыщенного пара растворителя присутствие нелетучего растворенного вещества? Сформулируйте I закон Рауля. 21. Приведите определение температуры кипения и замерзания жидкости. 22. Каково соотношение между температурой кипения и замерзания чистого растворителя и раствора. Сформулируйте II закон Рауля и проиллюстрируйте его графически. 23. Каков физический смысл криоскопической и эбулиоскопической постоянной? Эти постоянные являются константами: растворителя, растворенного вещества, раствора? 24. Как принято выражать концентрацию растворенного вещества в законе Вант-Гоффа для осмотического давления и во II законе Рауля? 25. При наступлении холодов в клетках растений происходит процесс превращения высокомолекулярных веществ в низкомолекулярные (например, крахмал - в ди- и моносахариды). Поясните, почему это приводит к увеличению зимостойкости растений? 26. Как можно использовать для растворов электролитов законы Вант-Гоффа и Рауля, справедливые для разбавленных растворов неэлектролитов? 27. Что такое изотонический коэффициент? Каков его физический смысл? Как его можно рассчитать?
Программа контрольной работы N 1 I. Химическая термодинамика. Основные понятия термодинамики: термодинамические системы: изолированные, открытые, закрытые. Параметры системы - масса, давление, объем, температура, внутренняя энергия и др. Термодинамические процессы. Работа и теплота - две формы передачи энергии. Первое начало термодинамики. Энтальпия. Стандартная энтальпия образования вещества, ΔH0298 обр. Закон Гесса и следствия из него. Применение первого начала термодинамики к живым системам. Расчет калорийности продуктов питания. Второе начало термодинамики. Самопроизвольные процессы. Энтропия системы. Абсолютная энтропия вещества. S0298. Факторы, влияющие на энтропию. Расчет энтропии реакции. Второе начало термодинамики для изолированных систем. Энергия Гиббса. Энтальпийный и энтропийный факторы протекания процессов. Расчет энергии Гиббса реакции для стандартных и нестандартных условий. Критерии самопроизвольного протекания процесса в закрытых и открытых системах. Экзо- и эндотермические процессы. Принцип энергетического сопряжения биохимических реакций. II. Химическая кинетика. Предмет и основные понятия химической кинетики. Скорость химических реакций. Средняя и истинная скорость. Факторы, влияющие на скорость реакции. Классификация реакций в кинетике: гомогенные и гетерогенные, простые и сложные (параллельные, последовательные, цепные, сопряженные). Молекулярность простой реакции. Зависимость скорости реакции от концентрации исходных веществ. Закон действующих масс. Константа скорости реакции. Ее физический смысл. Зависимость ее от различных факторов. Порядок реакции по веществу и общий порядок реакции. Кинетические уравнения реакций нулевого, первого и второго порядков. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Понятие о теории активных столкновений и о теории активированного катализа. Схема каталитического действия. Особенности ферментативного катализа. III. Химическое равновесие. Необратимые и обратимые по направлению реакции. Химическое равновесие. Кинетические и термодинамические условия наступления состояния динамического равновесия. Константа химического равновесия и ее зависимость от различных факторов. Связь константы равновесия с энергией Гиббса. Смещение равновесия. Принцип Ле Шателье. Расчет равновесных и исходных концентраций системы. IV. Растворы. Виды растворов. Вода как растворитель. Ее биологическая роль. Структурированная вода и ее особенности. Растворимость веществ. Термодинамика процесса растворения. Растворимость газов в жидкостях. Законы Генри, Дальтона, Сеченова. Способы выражения содержания растворенного вещества в растворе: массовая доля, молярная концентрация и моляльная концентрация. Коллигативные свойства растворов неэлектролитов. Осмотическое давление. Закон Вант Гоффа. Расчет осмотического давления в растворах электролитов. Изотонический коэффициент. Роль осмоса и осмотического давления в биологических системах. Осмотическое давление. Изо- гипо- и гипертонические растворы. Явления плазмолиза и гемолиза. Законы Рауля: понижение, давления насыщенного пара над раствором, понижение температуры замерзания и повышение температуры кипения растворов. Законы Рауля для растворов электролитов. Криоскопическая и эбулиоскопическая постоянные, их физический смысл. Дата добавления: 2015-12-16 | Просмотры: 5562 | Нарушение авторских прав |
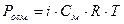
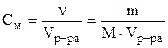
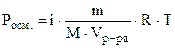
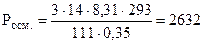 кПа
кПа
 Ркр < Рр-ра Плазмолиз
Ркр < Рр-ра Плазмолиз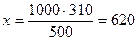 г этиленгликоля
г этиленгликоля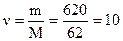 моль - это и есть моляльная концентрация Cm, т.к. указывает количество вещества в 1000 г растворителя.
моль - это и есть моляльная концентрация Cm, т.к. указывает количество вещества в 1000 г растворителя.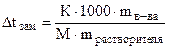 ;
; 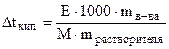
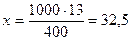 г камфоры.
г камфоры.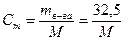
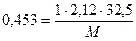 , отсюда
, отсюда