|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач. Используемые обозначения и размерности:
Используемые обозначения и размерности: К – константа диссоциации; С – молярная концентрация электролита, моль/л; a - степень диссоциации, в долях единицы или %; [H+], [OH-] – концентрации ионов водорода и гидроксид-ионов, моль/л; m - ионная сила; f – коэффициент активности иона; Z – заряд иона; а – активная концентрация (активность) иона, моль/л; Основные расчетные формулы
[H+] = Ca (5) [OH-] = Ca (6)
Задача 1. Вычислите [OH-] в 0,1 м растворе NH4ОН. Решение: из формулы (4) a= [OH-] = Ca = 0,1·1,33·10-2 = 1,33·10-3 моль/л. Задача 2. При какой молярной концентрации уксусной кислоты в растворе ее степень диссоциации равна 0,01? Решение: по формуле (3) Задача 3. Повлияет ли на процесс диссоциации NH4OH добавление а)HCl; б)NaOH?
Ионы ОН- соединяются с ионами Н+ хлороводородной кислоты, диссоциирующей нацело: HCl ® H+ + Cl- (2), при этом образуются молекулы почти недиссоциирующей воды: ОН- + Н+ ® Н2О (3). Уменьшение концентрации OH- в соответствии с принципом Ле-Шателье приведет к тому, что равновесие (1) будет смещено вправо, т.е. процесс диссоциации NH4OH усилится. б) Добавление NaOH, диссоциирующего по уравнению: NaOH ® Na+ + OH- (4) приведет к увеличению концентрации OH-, что вызовет смещение равновесия (1) влево, т.е. процесс диссоциации будет подавляться. Задача 4. Вычислите ионную силу и активности ионов в 0,08 растворе CaCl2. Решение: концентрации ионов Са2+ и Cl- равны соответственно 0,08 и 0,16 моль/л согласно уравнению диссоциации соли: CaCl2 ® Ca2+ + 2Cl- 1моль 1 моль 2 моль 0,08 моль 0,08 моль 0,16 моль. Ионная сила раствора по формуле (7) составляет:
Коэффициенты активности Cl- рассчитывают по формуле (9) либо находят по таблице (см.приложение). Пользуясь формулой (8), находят активность каждого иона: а(Ca2+) = 0,23·0,08 = 0,018 моль/л; а(Cl-) = 0,69·0,16 = 0,11 моль/л. Задача 5. Составьте уравнения реакций гидролиза солей в ионной и молекулярной формах. 5.1 Ацетат натрия 5.2 Карбонат натрия 5.3 Хлорид аммония 5.4 Сульфат меди(II) 5.5 Сульфид аммония. Решение. Гидролизом называют обратимое обменное взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита и изменению реакции среды. - Движущей силой или причиной гидролиза является образование слабого электролита: чем слабее образующийся электролит,тем глубже протекает гидролиз (тем больше степень гидролиза соли). Гидролизу подвергаются соли, образованные: 1)сильным основанием и слабой кислотой; 2)слабым основанием и сильной кислотой; 3)слабым основанием и слабой кислотой, так как при их гидролизе может образовываться слабый электролит. - Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, так как взаимодействие катиона сильного основания и аниона сильной кислоты с водой не приводит к образованию слабого электролита. I.Гидролиз по аниону слабой кислоты. 5.1 Ацетат натрия – соль, образованная сильным основанием NaOH и слабой кислотой СН3СООН, диссоциирует по уравнению: NaCH3COO ® Na+ + СН3СОО-
слабый электролит Этому уравнению соответствует молекулярное уравнение:
Раствор данной соли имеет щелочную реакцию среды, рН>7, т.к. согласно ионному уравнению в растворе накапливаются гидроксид-ионы. 5.2 Карбонат натрия - в водном растворе идет процесс диссоциации соли: Na2CO3 ® 2Na+ + CO32-
слабый электролит
Реакция раствора данной соли щелочная, рН>7. Как видно из приведенных уравнений, гидролиз Na2CO3 по первой ступени идет с образованием кислой соли и только по второй ступени образуется угольная кислота. Практически гидролиз идет только по первой ступени.Это объясняется тем, что ионы НСО3- диссоциируют гораздо труднее [К(НСО3-)=5,6×10-11)], чем молекулы Н2СО3 [К(Н2СО3)=4,3×10-7)], т.е. ион НСО3- является более слабым электролитом, чем молекула Н2СО3. Кроме того, в растворе накапливаются ОН--ионы, смещающие равновесие гидролиза по второй ступени влево. Таким образом, гидролиз солей многоосновных кислот практически не идет дальше первой ступени и заканчивается образованием кислых солей.
II Гидролиз по катиону слабого основания 5.3 Хлорид аммония - соль, образованная слабым основанием NH4OH и сильной кислотой HCl, в водном растворе диссоциирует по уравнению: NH4Cl ® NH4+ + Cl-.
слабый электролит
В растворе образуется избыток ионов Н+, следовательно, реакция среды кислая, рН<7.
5.4. Сульфат меди (II) - соль, образованная сильной серной кислотой и слабым двухкислотным основанием Cu(OH)2. В реакции гидролиза принимают участие ионы Сu2+, при этом взаимодействие этих ионов с ионами ОН- воды идет ступенчато.
слабый электролит
Реакция среды раствора этой соли кислая, рН<7. Практически гидролиз останавливается на первой ступени. Следовательно, гидролиз солей многокислотных оснований идет с образованием основных солей.
III Гидролиз по катиону слабого основания и аниону слабой кислоты 5.5 Сульфид аммония - соль, образованная слабым основанием NH4OH и слабой кислотой H2S. В данном случае и катион, и анион соли участвуют в реакции гидролиза, связывая ионы Н+ и ОН- воды с образованием слабого основания и слабой кислоты.
слабый электролит слабый электролит
Практически гидролиз идет по первой ступени. В зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания, растворы cолей могут иметь слабокислую или слабощелочную реакцию, т.е. рН близко к 7. В данном случае К(HS-)=1,3·10-13 << К(NH4OH)=1,8·10-5, поэтому реакция среды слабощелочная. Задача 6. Какие процессы будут происходить при смешивании водных растворов сульфида натрия и хлорида алюминия? Составьте уравнение реакции. Решение: AlCl3 – соль образована слабым основанием Al(OH)3 и сильной кислотой HCl. Na2S – соль образована сильным основанием NaOH и слабой кислотой H2S. При смешивании растворов этих солей, обе соли гидролизуются, в реакции гидролиза участвуют ионы Al3+, связывая ионы ОН- из воды, и ионы S2-, связывающие ионы Н+ из воды. Электролитическая диссоциация воды: Н2О ↔ Н+ + ОН- резко смещается вправо. Это приводит к тому, что гидролиз обеих солей доходит до конца согласно ионному уравнению: 2Al3+ + 3S2- + 6HOH ® 2Al(OH)3¯ + 3H2S, молекулярное: 2AlCl3 + 3Na2S + 6HOH ® 2Al(OH)3¯ + 3H2S+ 6NaCl *Примечание. В таблице растворимости против солей, подвергающихся полному гидролизу, стоит прочерк и указывается, что эти соли в водном растворе не существуют, так как они разлагаются водой. Задача 7. Определите реакцию среды в водном растворе KMnO4. Решение: KMnO4 - соль образована сильным основанием КОН и сильной кислотой HMnO4, следовательно, ни ион К+, ни ион MnO4- не могут связывать ионы Н+ и ОН- из воды с образованием слабого электролита. Соль KMnO4 не принимает участия в гидролизе и реакция среды в растворе определяется диссоциацией молекул воды:
Задача 8. Как усилить гидролиз соли CH3COONa? Решение: напишем уравнение реакции гидролиза этой соли в ионной форме:
Чтобы сместить равновесие реакции вправо, надо уменьшить концентрацию ОН--ионов, чего можно достичь добавлением кислоты (например, HCl) и связыванием ионов ОН- в молекулы практически не диссоциирующей воды: Н+ + ОН- ® Н2О (2) Концентрация ионов ОН- резко падает и по принципу Ле-Шателье равновесие (1) смещается в сторону прямой реакции, гидролиз усиливается. Кроме того, гидролиз усиливается при разбавлении соли и повышении температуры (DН > 0).
Контрольные вопросы для самопроверки 1. Какой процесс называется электролитической диссоциацией? Сформулируйте основные положения теории электролитической диссоциации Аррениуса. 2. В чем особенность диссоциации слабых электролитов? Чем отличаются слабые электролиты от сильных? 3. Дайте определение понятиям: степень и константа диссоциации. Какие факторы влияют на их величину? 4. Как связаны между собой степень и константа диссоциации. 5. Что характеризует собой Ка и рКа кислот (Кb и рКb оснований)? 6. В чем особенность диссоциации сильных электролитов? Активность и коэффициент активности ионов. Приведите примеры сильных электролитов. 7. Каковы особенности диссоциации многоосновных кислот и многокислотных оснований, средних, кислых и основных солей? Приведите примеры их диссоциации. 8. Какие реакции называют реакциями гидролиза? Укажите причину гидролиза. 9. Охарактеризуйте основные случаи гидролиза солей. От каких факторов зависит процесс гидролиза? 18. Роль гидролиза в биохимических процессах. Тема. Растворы электролитов. Теория кислот и оснований. Дата добавления: 2015-12-16 | Просмотры: 3004 | Нарушение авторских прав |



 (1) К» Сa2 (2)
(1) К» Сa2 (2)  (3)
(3)  (4)
(4)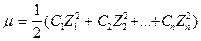 (7) a = fC (8)
(7) a = fC (8)  (9)
(9)
 = 1,33×10-2 (долей единицы).
= 1,33×10-2 (долей единицы). 1,8×10-1 моль/л
1,8×10-1 моль/л
 Решение: а) NH4OH является слабым электролитом. Ионное равновесие в его растворе выражается условно уравнением: NH4OH NH4+ + OH- (1)
Решение: а) NH4OH является слабым электролитом. Ионное равновесие в его растворе выражается условно уравнением: NH4OH NH4+ + OH- (1)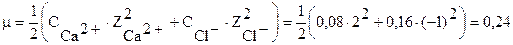

 Из этих ионов участвовать в реакции гидролиза может только ацетат-ион, являющийся анионом слабой кислоты: СН3СОО- + Н+ОН- СН3СООН + ОН-
Из этих ионов участвовать в реакции гидролиза может только ацетат-ион, являющийся анионом слабой кислоты: СН3СОО- + Н+ОН- СН3СООН + ОН-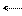
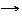 NaCH3COO + HOH СН3СООН + NaOH
NaCH3COO + HOH СН3СООН + NaOH
 Соль эта образована сильным основанием NaOH и слабой двухосновной угольной кислотой, поэтому в реакции гидролиза участвует ион СО32-, который, соединяясь с ионом Н+ воды, может дать слабый электролит (слабую кислоту). Но поскольку угольная кислота диссоциирует ступенчато, ступенчато идет и обратный процесс – процесс взаимодействия ионов СО32- с ионами Н+. Отсюда вытекает, что гидролиз Na2CO3 идет ступенчато: 1 ступень: СО32- + Н+ОН- НСО3- + ОН- ионное уравнение
Соль эта образована сильным основанием NaOH и слабой двухосновной угольной кислотой, поэтому в реакции гидролиза участвует ион СО32-, который, соединяясь с ионом Н+ воды, может дать слабый электролит (слабую кислоту). Но поскольку угольная кислота диссоциирует ступенчато, ступенчато идет и обратный процесс – процесс взаимодействия ионов СО32- с ионами Н+. Отсюда вытекает, что гидролиз Na2CO3 идет ступенчато: 1 ступень: СО32- + Н+ОН- НСО3- + ОН- ионное уравнение Na2CO3 + НОН NaHCO3 + NaOH молекулярное уравнение
Na2CO3 + НОН NaHCO3 + NaOH молекулярное уравнение
 2 ступень: НСО3- + НОН Н2СО3 + NaOH
2 ступень: НСО3- + НОН Н2СО3 + NaOH
 NaНCO3 + НОН Н2СО3 + NaOH.
NaНCO3 + НОН Н2СО3 + NaOH.
 NH4Cl + HOH NH4OH + HCl молекулярное уравнение
NH4Cl + HOH NH4OH + HCl молекулярное уравнение
 1 ступень: Cu2+ + HOH CuOH+ + H+ ионное уравнение
1 ступень: Cu2+ + HOH CuOH+ + H+ ионное уравнение
 2CuSO4 + 2HOH (CuOH)2SO4+H2SO4 молекулярное уравнение
2CuSO4 + 2HOH (CuOH)2SO4+H2SO4 молекулярное уравнение
 2 ступень: СuOH+ + HOH Cu(OH)2 + H+
2 ступень: СuOH+ + HOH Cu(OH)2 + H+
 (CuOH)2SO4 + 2HOH Cu(OH)2 + H2SO4
(CuOH)2SO4 + 2HOH Cu(OH)2 + H2SO4
 1 ступень: S2- + H+OH- + NH4+ HS- + NH4OH ионное уравнение
1 ступень: S2- + H+OH- + NH4+ HS- + NH4OH ионное уравнение