 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач. 1.Определение состава комплексного иона.1.Определение состава комплексного иона. Задача 1. Определите состав и заряд комплексного иона [Fe(CN)6]х, в котором железо проявляет степень окисления (+3) Решение. Заряд комплексообразователя иона железа равен + 3, а заряд шести цианид-ионов равен -6. Следовательно, алгебраическая сумма зарядов будет равна (+3)+(-6) = = -3; Fe3+ - комплексообразователь, 6CN- - лиганды; координационное число комплексообразователя равно 6. 2.Номенклатура комплексных соединений. По рациональной номенклатуре сначала называется анион, а затем в родительном падеже катион, с указанием его степени окисления. В названии комплексного иона перечисляются все его составные части: вначале лиганды ионного происхождения, а затем молекулярного, Все лиганды перечисляются в алфавитном порядке, Число частиц одинаковых лигандов указывается перед их названием греческим числительным: 2 - ди, 3 – три, 4 – тетра. Последним указывается комплексообразователь. Анионные лиганды: к химическому названию добавляется гласная -«о»: F- -фторо, CN- -циано, OH- -гидроксо, SO42- сульфато, NO2-– нитро, и т.д. Молекулярные лиганды: NH3 – аммин, H2O – аква, CO – карбонил, N2H4 – гидразин, NO – нитрозил, указываются без окончания. Комплексообразователь: в катионном комплексе дается русское название элемента, в анионном комплексе добавляется суффикс –«ат» к корню слова латинского названия элемента. Если комплексообразователь проявляет несколько степеней окисления, то после его названия в скобках римской цифрой указывается степень окисления. Задача 2. Назовите комплексные соли: 1.[Pt(NH3)6]Cl4, - (комплексный катион) хлорид гексаамминплатины (II) 2. К2[Со(СNS)4] – (комплексный анион) тетратиоцианокобальтат (II) калия 3. [Рt(NH3)2Сl4] – (нейтральный комплекс) тетрахлородиамминплатина. 3. Равновесие в растворах комплексных соединений Задача 3. Определите концентрацию ионов Hg2+ и Cl- в 0,1 М K2[HgCl4].
Записываем выражение константы нестойкости, взяв ее значение из таблицы:
Обозначим [Hg2+] через х. Тогда [Cl-]= 4х, [HgCl4]2- - примем равной общей концентрации раствора (0,1 моль /л), так как константа нестойкости этого комплекса очень мала. Подставляем все значения в выражение константы нестойкости:
х = Концентрация ионов Cl- будет в 4 раза больше: [Cl-] = 1,2.10-4. 4 = 4,8.10-4 моль/л Ответ: [Hg2+] = 1,2 ·10-4 моль/л, [Cl-] = 4,8 ·10-4 моль/л
Контрольные вопросы для самопроверки. 1. Какие соединения называются комплексными? 2. Дайте определение понятию центральный атом (комплексообразователь). 3. Назовите атомы и ионы, которые чаще являются центральными атомами К.С. 4. Что такое лиганд? Приведите примеры ионов и молекул, являющихся лигандами. 5. Что называют дентатностью лиганда? Приведите примеры моно-, ди- и полидентатных лигандов. 6. Дайте определение понятию координационнное число центрального атома. Какое значение оно обычно принимает? 7. Как классифицируют К.С. в зависимости от природы лиганда? Что такое хелаты? 8. Как классифицируют К.С. в зависимости от заряда их внутренней сферы? Как определяется заряд внутри сферы? 9. Какие типы химических связей встречаются в К.С.? Какую роль выполняет центральный атом и лиганды при образовании К.С.? 10. Дайте определения понятиям «первичная и вторичная диссоциация К.С.» 11. Что называется константой нестойкости? 12. Гемоглобин и его производные. Чему равно координационное число у железа в гемоглобине? Сколько с ним связано лигандов? 13. Как называют хелатные комплексы гемоглобина, хлорофилла, витамина В12? 14. В каких случаях возможно образование и разрушение К.С.? Какими реактивами можно разрушить: а) гидроксокомплексы б) аммиачные комплексы? 15. Приведите примеры комплексов, играющих важную роль или применяемых в медицине. Дата добавления: 2015-12-16 | Просмотры: 1510 | Нарушение авторских прав |
 Решение. Так как концентрация раствора невысокая, а все соли диссоциированы наце
Решение. Так как концентрация раствора невысокая, а все соли диссоциированы наце  ло, считаем, что общая концентрация иона [HgCl4]2- также равна 0,1 моль/л. Пишем уравнение диссоциации комплексного иона: [HgCl4]2- Hg2+ + 4Cl-
ло, считаем, что общая концентрация иона [HgCl4]2- также равна 0,1 моль/л. Пишем уравнение диссоциации комплексного иона: [HgCl4]2- Hg2+ + 4Cl-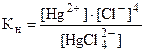 = 6·10-17
= 6·10-17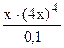 = 6·10-17, откуда: 256х5 = 6·10-18;
= 6·10-17, откуда: 256х5 = 6·10-18;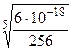 =
= 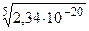 ≈ 1,2.10-4 моль/л = [Ag+]
≈ 1,2.10-4 моль/л = [Ag+]