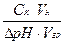|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Ситуационные задачи. 1. Объясните, почему сульфат магния, MgSO4 нельзя вводить внутривенно?1. Объясните, почему сульфат магния, MgSO4 нельзя вводить внутривенно? (Коллоидные системы) 2. Объясните, почему рекламируемая зубная паста "Блендамед-сода-бикарбонат", содержащая NaHCO3, эффективна при профилактике кариеса? (Гидролиз) 3. С точки зрения химии биогенных элементов объясните причину возможного появления судорог во время сильного волнения. Какие препараты могут уменьшить судороги? 4. С точки зрения химии биогенных элементов объясните, почему опасно кормить грудного младенца только коровьим молоком? 5. Объясните механизм послабляющего действия сульфатов магния и натрия.(Осмос 6. Как из старого мяса приготовить съедобное блюдо? Объясните с точки зрения химии растворов ВМС. (ВМС) 7. Почему при приготовлении шашлыка мясо предварительно вымачивают в уксусе? (ВМС) 8. Почему сухие белковые препараты, полученные высаливаеием с последующей лиофильной сушкой: - не растворяются в воде, но растворяются в физрастворе, - почему рассыпанный альбумин нельзя собирать просто мокрой тряпкой? 9. Объясните, как в полевых условиях отмыть посуду от жира без мыла и стирального порошка? (Гидролиз жира. Эмульсии) 10. В медицинской практике лекарственные средства используют в виде эмульсии как I, так и II рода. Объясните, какие эмульсии назначают: - врач-дерматолог для наружного применения, врач-гастроэнтеролог для внутреннего применения. (Эмульсии) 11. С точки зрения осмоса объясните причину появления опухоли на не обработанной антисептиком ране. Как уменьшить опухоль? (Осмос) 12. Используя законы Рауля, объясните, в чем заключается обеззараживающий эффект автоклавирования медицинских инструментов при высоком давлении? (Коллигативные свойства) 13. Для обеззараживания медицинских инструментов можно использовать солевые растворы. Объясните механизм этого действия. Какой раствор более эффективен: хлорид натрия или хлорид кальция? (Осмос) 14. У здорового человека температура замерзания плазмы крови = -0,5 С. Измеряя температуру замерзания плазмы крови больного, в реаниматологии оценивают возможность его отравления. С точки зрения законов Рауля, что при этом должно наблюдаться и почему? (Коллигативные свойства) 15. С точки зрения кинетики биохимических реакций объясните, почему больной плохо себя чувствует даже при повышении температуры на 10 С. (Кинетика) 16. Почему KМnO4, K2Cr2O7 и H2O2 можно использовать в качестве антисептиков? Какой из них наиболее эффективен? (ОВ-реакции) 17.Почему в дезинфицирующем средстве на основе пероксида водорода присутствуют лимонная кислота и цитрат натрия? (Буферные системы) 18. а) Два белка с pJ1= 5 и pJ2 = 9 нужно разделить с помощью электрофореза. При каком значении рН разделение будет наиболее эффективным? б) После электрофореза белки на фореграмме подвергают окрашиванию. Используя правило Панета-Фаянса объясните, какие красители для этого выбрать? (Белки, адсорбция) 19. Что такое диализ и перитонеальный диализ? Для каких целей он используется в клинической биохимии? (Коллоидные системы) 20. Почему внутривенное введение растворов электролитов, например, CaCl2 следует проводить очень медленно, желательно с помощью капельницы? Для объяснения используйте правило Шульце-Гарди. 21. Можно ли при внутривенном введении 0,9%раствор NaCl заменить изотоничными ему стерильными растворами MgSO4, MgCl2, или CaCl2? Объясните, используя знания физ-коллоидной химии. 22. Можно ли, используя метод пептизации, удалить почечные камни или атеросклеротические бляшки? 23. На чем основан старинный метод лечения переломов костей путем приема внутрь толченой скорлупы яиц? Как можно модифицировать этот метод? 24. Каким образом можно осуществить фиксацию биопрепаратов для их последующего изучения, чтобы прижизненная структура биопрепарата была сохранена от разрушающего действия микроорганизмов? 25. Объясните, на чем основано бактериостатическое действие гипертонических растворов NaCl, сахарозы и мочевины? 26. Объясните, на чем основано дезинфицирующее действие соды, Na2CO3. Почему добавки детергентов (моющих средств) увеличивают его эффективность? 27. Объясните с точки зрения коллоидной химии, что происходит, когда врач перед осуществлением клинических процедур моет руки с мылом? 28. Как приготовить в полевых условиях эффективное дезинфицирующее средство, имея в распоряжении поваренную соль и автомобильный аккумулятор? 29. Чем можно объяснить эффективность использования углеводородов типа керосина в народной медицине в качестве средств против воспаления, особенно на ранних стадиях развития этих процессов? 30. Почему такие металлы, как титан, цирконий, ниобий, золото можно совершенно безопасно использовать в качестве основы штифтов, гвоздей, протезов, опорных элементов без какой-либо опасности для организма больного? 31. Фторопласты, в частности фторопласт-4, -(CF2-CF2)n применяются в качестве материала при протезировании клапанов сердца, кровеносных сосудов. Объясните, почему при использовании этого материала исключено появление тромбов у пациентов? 32. Известно, что цианид-ионы являются смертельными ядами для теплокровных животных и человека: - чем можно объяснить механизм их токсического действия? - почему нетоксичны желтая и красная кровяные соли K4[Fe(CN)6], K3[Fe(CN)6]. - Что можно предложить для лечения отравленных цианидами? 33. На чем основан механизм действия детоксикантов (противоядий, антидотов) при отравлениях ионами тяжелых металлов? Объясните на примере детоксикации катиона Hg2+ унитиолом. 34. Объясните, как можно использовать токсичные катионы тяжелых металлов (Hg2+, Pb2+,Cd2+ и др.) в терапевтической практике, например, в виде цитотоксинов? 35. Известно, что катион Ва2+ высокотоксичен для теплокровных. Почему сульфат бария используется как рентгеноконтрастное вещество для обследования желудочно-кишечного тракта без опасности отравления? Почему для этих целей нельзя использовать нерастворимый сульфат свинца? 36. Объясните сущность работы аппарата "искусственная печень", основанную на принципах гемосорбции. 37. Объясните на основе законов осмоса, что такое перитонеальный диализ? 38. Сердечные гликозиды, входящие в состав наперстянки, имеют общую формулу R-NH2. Предложите, как можно "улучшить" технологию получения лекарственных отваров и настоек из подобного растительного сырья? 39. Фармакопейные стандарты многих стран мира предусматривают использование и хранение референсных сывороток, антигенов, антител и других биологических препаратов в 50% растворе глицерина. Используя знание коллигативных свойств растворов, объясните, как это делается? 40. Какие явления физической и коллоидной химии лежат в основе иммунохимических реакций с "прямой меткой" и "непрямой меткой"? 41. Почему при варке мясного супа его необходимо солить, причем вначале бульон обязательно варят на очень слабом огне? 42. Моль поражает шерстяные изделия. Как можно, зная это свойство белков, из которых состоит шерсть, предотвратить поражение ее молью? 43. Как можно сохранить локоны в прическе, зная химические свойства белков? 44. Объясните методы безоперационного удаления почечных камней. 45. Объясните методы безоперационного удаления желчных камней.
ПРИЛОЖЕНИЕ
ТЕМА «РАСТВОРЫ». ОСНОВНЫЕ ОПРЕДЕЛЕНИЯ, КОТОРЫЕ НУЖНО ВЫУЧИТЬ: 1. Коллигативные свойства растворов – это свойства растворов, которые зависят только от числа частиц растворителя и растворенного вещества (то есть, их концентрации), так как обусловлены тепловым хаотическим движением частиц. Они не зависят от химической природы частиц. 2. Диффузия – это самопроизвольный процесс переноса частиц растворенного вещества и растворителя из области большей концентрации в область меньшей за счет их теплового движения, приводящий к выравниванию концентрации. 3. Осмос – это самопроизвольный процесс односторонней диффузии растворителя через полупроницаемую мембрану в сторону более концентрированного раствора. 4. Осмотическое давление – это давление, которое надо приложить к раствору, чтобы прекратился осмос, то есть проникновение в раствор молекул растворителя через полупроницаемую мембрану. 5. Онкотическое давление – это часть осмотического давления крови (0,5%), создаваемая растворенными в ней белками. 6. Закон Вант-Гоффа – осмотическое давление раствора пропорционально молярной концентрации вещества в растворе и абсолютной температуре: Росм = СМ . R . Т. 7. Молярная концентрация – это концентрация, показывающая число моль растворенного вещества в 1 л раствора: m
M . V 8. Гемолиз – это разрушение (разрыв) эритроцита, помещенного в гипотонический раствор, вследлствие проникновения воды через оболочку в эритроцит. 9. Плазмолиз – это усыхание и гибель эритроцита, помещенного в гипертоническийц раствор, вследствие перехода воды через оболочку из эритроцита в раствор. 10. Первый закон Рауля – понижение давление пара растворителя над раствором по сравнению с давлением пара над чистым растворителем пропорционально мольной доле растворенного вещества: Ро – Р = Ро . N 11. Второй закон Рауля – повышение температуры кипения раствора по сравнению с чистым растворителем пропорционально моляльной концентрации Dtкип = Е . Cm. 12. Моляльная концентрация – показывает число моль растворенного вещества в 1 кг (1000 г) растворителя [Cm] = [моль/кг]. 13. Диссоциация – это процесс распада электролита на ионы под действием полярных молекул растворителя. 14. Электролиты – это вещества, распадающиеся (диссоциирующие) в водном растворе на ионы и проводящие поэтому электрический ток. 15. Константа диссоциации – это постоянная величина, количественно характеризующая обратимый процесс диссоциации слабого электролита и численно равная отношению произведения равновесных концентраций ионов в степенях, равных стехиометрическим коэффициентам, к равновесной концентрации электролита. 16. Активность ионов – это кажущаяся (или эффективная) концентрация ионов сильных электролитов, в соотвествии с которой ионы принимают участие в различных процессах, происходящих в растворе: ах = g.Сх 18. Коэффициент активности ионов – это величина, показывающая, во сколько раз активность ионов меньше их истинной концентрации в растворе сильного электролита: g. = ах / Сх 19. Протонная теория – это теория, рассматривающая кислотно-основное взаимодействие как перенос протона (иона Н+) от одного вещества (кислоты) к другому (основанию). 20. Кислота Бренстеда – это молекула или ион, отдающие ион водорода, то есть являющиеся донором протона: HCl ® H+ + Cl-; NH4+ ® H+ + NH3 21. Основание Бренстеда – это молекула или ион, принимающие ион водорода, то есть являющиеся акцептором протона: H+ + NH3 ® NH4+ ; ОН- + Н+ ® Н2О. 22. Ионное произведение воды - это постоянная при данной температуре величина для воды и водных растворов, равная произведению концентраций ионов водорода и гидроксид-ионов. Ее численное значение К(Н2О) = [Н+] [ОН-] = 1.10-14. 23. Водородный показатель рН – это количественная хараткеристика кислотности воднйо среды, равная отрицательному десятичному логарифму концентрации ионов водорода в растворе: рН = - lg[Н+] 24. Буферные растворы - это водные растворы, сохраняющие постоянное значение рН при разбавлении и добавлении небольших количеств сильной кислоты или щелочи. 25. Буферная емкость – это мера способности буферного раствора сохранять постоянство рН, равная числу моль эксивалентов сильной кислоты или щелочи, которое нужно добавить к 1 литру буферного раствора, чтобы изменить величину его рН на единицу: BK = 26. Кислотно-щелочное равновесие организма (КЩР) – это относительное потсоянство концентраций ионов водорода и гидроксид-ионов, то есть, потсоянство рН в водных средах организма. 27. Щелочной резерв крови – это суммарная концентрация буферных оснований крови, способных связывать избыточные ионы водорода; количество определяется концентрацией СО2, химически связанного со 100 мо крови в виде гидрокарбонат-иона (НСО3-) при парциальном давлении СО2, равном 40 мм рт.ст., то есть как во вдыхаемом воздухе (норма 50-70%)/ 28. Гетерогенное равновесие – это равновесие, которое устанавливается между осадком и насыщенным раствором над ним, когда скорость пооцесса растворения равна скорости обратного процессма кристаллизации этого вещества. 29. Произведение растворимости или константа растворимости – это постоянная величина, равная произведению активностей (концентраций) ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре.
Дата добавления: 2015-12-16 | Просмотры: 1244 | Нарушение авторских прав |
 СМ =
СМ =