 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Используемые обозначения и размерности[H+] - концентрация ионов водорода, моль/л; [OH-] - концентрация гидроксид-ионов, моль/л; Кв - ионное произведение воды; рН - водородный показатель; рОН - гидроксильный показатель; а(Н+) - активная концентрация (активность) ионов водорода, моль/л; f(H+) - коэффициент активности ионов водорода; См - молярная концентрация, моль/л; Сн - молярная концентрация эквивалента, моль/л; К - константа диссоциации; a - степень диссоциации, в долях единицы или %; n - число ионов Н+ (ОН-), полученных при диссоциации одной молекулы кислоты (основания).
Кв = [H+]·[OH-] = 10-14 (1) Для растворов сильных оснований рН = -lg[H+] (2) [OH-] = См × n = Сн (8) рОН = -lg[OH-] (3) Для растворов слабых кислот рН + рОН = 14 (4) [H+] = См·a (a-в долях единицы) (9) р а (Н+) = -lg а (Н+) (5) [H+] = а (Н+) = [H+]·f(H+) (6) Для растворов слабых оснований Для растворов сильных кислот: [OH-] = См · a (a - в долях единицы) (11)
1) истинные концентрации [H+] и [OH-] можно использовать при вычислениях только для чистой воды и разбавленных водных растворов, когда коэффициенты активности близки к 1. В концентрированных растворах для вычисления рН нужно пользоваться активными концентрациями (активностями) а(Н+) и а(ОН-). При не очень точных расчетах различием между истинной концентрацией и активностью можно пренебречь; 2) следует помнить, что для одноосновных кислот и однокислотных оснований См = Сн. Для многоосновных кислот и многокислотных оснований См не равно Сн. Но слабые многоосновные кислоты и слабые многокислотные основания диссоциируют преимущественно по первой ступени (H2S ↔H+ + HS-), поэтому без большой ошибки их можно также рассматривать как бинарные электролиты и считать, что См = Сн. Задача 1. Вычисление водородного показателя раствора (рН). Чему равны рН и рОН раствора, содержащего 0.056 г NaOH в 300 мл раствора? Решение: NаОН - сильное основание, поэтому [OH-] = Сн. Находим Сн раствора по известной формуле: Э - молярная масса эквивалента, г/моль; V - объем раствора, мл;
Следовательно, [OH-] = 0,00467 моль/л. От [OH-] к рН можно прийти двумя путями: 1) [OH-] ® рОН ® рН; 2) [OH-] ® [H+] ® рН Воспользуемся первым путем: рН= -lg[OH-]= -lg0,00467= -lg(4,67·10-3)= 3 - lg4,67= = 3 - 0,6693 = 2,33; рН = 14 - 2,33 = 11,67. Задача 2. Вычисление концентрации ионов ОН- по значению рН. Чему равны [H+] и [OH-] в растворе, рН которого равен 2,35? Решение: рН = -lg[H+], 2,35 = -lg[H+], lg[H+] = -2,35. Так как логарифм в данном случае является дробным числом, то для вычисления [H+] можно воспользоваться таблицей логарифмов. lg[H+] = Задача 3. Вычисление рН сильного электролита с учётом коэффициента активности. Чему равен рН 0,1М раствора H2SO4? Решение: согласно условию задачи водородный показатель следует находить по активной концентрации (активности) ионов водорода: р а (Н+) = -lg a (H+). Для вычисления активности ионов водорода нужно знать их истинную концентрацию и коэффициент активности: а (Н+) = [H+]·f (H+). В 0,1М растворе H2SO4 истинная концентрация ионов водорода равна: [H+] = См·2 = 0,2 мольл. Коэффициент активности можно найти, зная ионную силу раствора m. Последняя вычисляется по известной формуле:
где С1, С2,......, Сn - молярные концентрации ионов, Z1, Z2,......, Zn - заряды ионов. В 0,1М растворе H2SO4 ионная сила будет равна:
По величине ионной силы находим коэффициент активности ионов водорода (см. приложение): f (H+) = 0,81.Вычисляем активность ионов водорода: а (Н+) = [H+]·f (H+) = = 0,2·0,81 = 0,162 мольл. Вычисляем рН: р а (Н+) = -lg а (Н+) = -lg (1,62·10-1) = 1 -lg1,62 = 1-0,204 = 0,79. Задача 4. Вычисление рН раствора слабого электролита. Чему равен рН 0,02н. СН3СООН, если a = 0,05?
Концентрацию ионов водорода в растворе слабой кислоты можно вычислить по одной из формул: [H+] = См·a (где a в долях единицы) или [H+] = В условии задачи дана степень диссоциации, поэтому воспользуемся первой формулой: [H+] = 0,02·0,05 = 0,001 мольл. Вычислим рН: рН = -lg[H+]= -lg10-3 = 3. Задача 5. Вычисление рН раствора слабого электролита Чему равен рН 0,025М раствора NH3?
Концентрацию гидроксид-ионов в растворе слабого основания можно вычислить по одной из формул: [OH-] = См·a (где a в долях единицы) или [OH-] = В условии задачи не даны ни степень диссоциации, ни константа диссоциации. Однако последнюю можно найти по справочнику (см. приложение): К(NH4OH)= 1,8·10-5. Воспользуемся второй формулой:
рОН = -lg[OH-] = -lg (6,71·10-4)= 4 - lg 6,71 = 4 - 0,0826 = 3,17. Задача 6. Вычисление рН смеси сильных электролитов. Вычислите рН раствора, полученного при сливании 10 мл 0,1М раствора HNO3 с 20 мл 0,1М раствора КОН. Решение: в случае приближённых расчётов можно не учитывать активность электролитов. Тогда рН смеси сильных электролитов будет определяться избытком ионов Н+ или ОН-, оставшихся после реакции нейтрализации: Н+ + ОН- ® Н2О. Количество вещества HNO3 находится по формуле: n (HNO3) = СМ·V= 0,1·10 = = 1 ммоль = 10-3 моль, в котором n (Н+) = n (HNO3) = 10-3 моль. Количество вещества щёлочи равно: n (КОН) = 20·0,1 = 2 ммоль = 2·10-3 моль, в котором количество вещества n (ОН-) = 2·10-3 моль. Так как реакция нейтрализации идёт в стехиометрическом соотношении 1:1, то в избытке после нейтрализации остаются ОН--ионы:n (ОН-)=(2·10-3 - 1·10-3)=1·10-3 моль Можно найти рОН этой смеси, рассчитав концентрацию ионов ОН- по формуле: [OH-] = n (OH-)/V(л) = 1·10-3/(10 + 20)·10-3 = 0,033 = 3,3·10-2 моль/л. рОН = -lg [OH-] = -lg (3,3·10-2) = 2 - lg 3,3 = 2 - 0,52 = 1,48.
Вопросы для самопроверки 1. Протонная теория кислот и оснований Бренстеда-Лоури. Что называют кислотой и основанием по этой теории? Приведите примеры. 2. Что такое амфолиты? Каковы их свойства? Приведите примеры. 3. Что такое ионное произведение воды? 4. Что характеризуют собой значения концентрации ионов водорода и водородного показателя? Назовите методы определения рН растворов. 5. Перечислите интервалы значений рН для биологических жидкостей. Тема. Буферные системы Содержание темы. Что такое буферные растворы? Их состав и классификация. Механизм буферного действия. Расчет рН буферных растворов. Уравнение Гендерсона-Гассельбаха. Буферная емкость. Факторы, влияющие на ее величину. Буферные системы живого организма: гидрокарбонатная, фосфатная, гемоглобиновая, белковая. Их состав и механизм буферного действия. Биологическое значение. Щелочной резерв крови. Механизм совместного действия гемоглобиновой и гидрокарбонатной буферных систем организма. Кислотно-основное равновесие организма. Алкалоз и ацидоз. Разделы, выносимые на самостоятельную проработку: кислотно-основное равновесие в организме (КЩР) и основные показатели КЩР (щелочной резерв крови, дефицит и избыток оснований, буферные основания). - ЛББХ с. 155-160, СОХЖ с. 203-207. Пример вопроса по этому материалу: укажите, какие показатели КЩР характеризуют следующие состояния организма: а) состояние нормы б) ацидоз в) алкалоз: 1) ВЕ < 0; 2) Р(СО2) = 40 мм. рт. ст.; 3) ВЕ = 0; 4) рН плазмы крови = 7,38; 5) ВВ < 42 ммоль/л; 6) [НСО3-] = 30ммоль/л; 7) Р(СО2) = 35 мм.рт.ст.; 8) ВВ = 42 ммоль/л; 9) [НСО3-] = 24 ммоль/л; 10) рН плазмы крови = 7,20 Показатели кислотно-основного (щелочного) равновесия, КЩР, в крови.
Домашнее задание для подготовки к занятию: а) ЕОХ с. 108 – 119, ЛББХ с. 151 – 160, СОХЖ с. 193 – 207; б) разберите примеры типовых задач 1 – 6; в) рассмотрите ситуационные задачи № 17, 26; г) письменно выполните следующие задания: 1. Используя следующие электролиты, составьте из них кислотные и основные буферные растворы: CH3COOH HClO4 NH4OH CH3COONa KClO4 HCOOH HNO3 H3BO3 HCOOK KHSiO3 H2CO3 H2SiO3 CsOH NaHCO3 NH4Cl H2PO4- Mn(OH)2 K2HPO4 NaCl 2. Рассчитайте значение рН кислотного буферного раствора, составленного из равных объемов одинаковой концентрации растворов слабой кислоты и ее соли, если: - значения рКа кислоты а) 4,76; б) 8,17; - значения Ка кислоты а) 3,8 . 10-6 б) 5,3 . 10-7 3. Рассчитайте значение рН основного буферного раствора, составленного из равных объемов одинаковой концентрации растворов слабого основания и его соли, если: - значения рКа кислоты а) 4,75; б) 8,17; - значения Ка кислоты а) 5,8 . 10-9 б) 2,5 . 10-8 4. Вычислите рН буферной системы, состоящей из 80 мл 0,1 н раствора СН3СООН и 20 мл 0,1 н раствора СН3СООNa; К(СН3СООН) = 1,85 . 10-5. Приведите механизм буферного действия. 5. Вычислите рН буферной системы, содержащей 8 мл 0,1 н NH4OH и 2 мл 0,1 н NH4Cl; К(NH4OH) = 1,77 . 10-5. Приведите механизм буферного действия. 6. Рассчитайте величину кислотной буферной емкости, если при добавлении 3 мл раствора HCl с концентрацией 0,2 моль/л к 20 мл буферного раствора с рН = 4,9 его рН стал равным 4,3. 7. Рассчитайте, сколько мл 2 н раствора ацетата натрия надо прибавить к 200 мл раствора уксусной кислоты такой же концентрации, чтобы рН буферного раствора равнялся 4. Пример билета тестового контроля: I. Раствор какого вещества нужно добавить к водному раствору NH3, чтобы образовалась буферная система: 1) HCl 2) NaCl 3) NH4Cl 4) NaOH 5) HNO2 6) HNO3 II. Буферные свойства проявляют системы: 1)CH3COONa, CH3COOH 2) NaCl, HCl 3) H3PO4, NaH2PO4 4) HHb, Hb-. III. В эритроцитах тканевых капилляров избыточные протоны связываются: 1) HCO3- 2) HPO42- 3) Hb- 4) HbO2- 5) H2N – Pt – COO- IV. Вычислите и укажите рН гидрокарбонатной буферной системы (рКа Н2СО3 = 6,35) с соотношением компонентов донор протона: акцептор протона а) 1:1 б) 1:10 в) 10:1 1) 4,35 2) 5,34 3) 6,35 4) 8,35 5) 4,50 6) 7,35 V. В каких растворах основная буферная емкость больше кислотной? HNO2 + NaNO2 1) 100 мл, 0,1 М + 100 мл, 0,1 М 2) 200 мл, 0,2 М + 200 мл, 0,1 М 3) 50 мл, 0,2М + 100 мл, 0,4 М Дата добавления: 2015-12-16 | Просмотры: 1063 | Нарушение авторских прав |


 Основные расчетные формулы
Основные расчетные формулы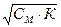 (10)
(10) [H+] = См · n = Сн (7) [OH-] =
[H+] = См · n = Сн (7) [OH-] = 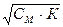 (12)
(12)
 Примечания:
Примечания: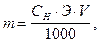 где m -масса растворенного вещества, г;
где m -масса растворенного вещества, г;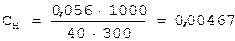 моль/л.
моль/л.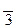 ,65. Чтобы найти[H+], надо взять антилогарифм от числа
,65. Чтобы найти[H+], надо взять антилогарифм от числа 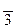 ,65 и получим: [H+]= 0,0045 моль/л. Полученную величину удобнее выразить числом 4,5·10-3 моль/л. Это и есть искомая величина [H+]. Для вычисления [OH-] воспользуемся ионным произведением воды: [OH-]
,65 и получим: [H+]= 0,0045 моль/л. Полученную величину удобнее выразить числом 4,5·10-3 моль/л. Это и есть искомая величина [H+]. Для вычисления [OH-] воспользуемся ионным произведением воды: [OH-] 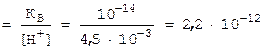 моль/л.
моль/л.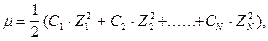
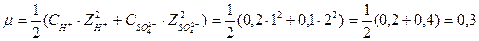 .
.
 Решение: СН3СООН - слабый электролит, на ионы диссоциирует только часть его молекул: СН3СООН СН3СОО- + Н+.
Решение: СН3СООН - слабый электролит, на ионы диссоциирует только часть его молекул: СН3СООН СН3СОО- + Н+.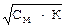 .
.
 Решение: раствор NH3 представляет собой слабое основание: NH4OH NH4+ + OH-.
Решение: раствор NH3 представляет собой слабое основание: NH4OH NH4+ + OH-.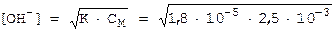 = 6,71·10-4 мольл.
= 6,71·10-4 мольл.