 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач. Задача 1. Вычисление константы равновесия по равновесным концентрациям реагирующих веществ и определение их исходной концентрации.Задача 1. Вычисление константы равновесия по равновесным концентрациям реагирующих веществ и определение их исходной концентрации. В системе 2NO + O2 ↔ 2NO2 при некоторой температуре равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): [NO] = 0,2; [О2] = 0,3; [NO2] = 0,4. Рассчитайте константу равновесия этой реакции и исходные концентрации. Решение: а) расчет константы равновесия производится по закону действующих масс для химического равновесия:
Константа равновесия этой реакции больше единицы, отсюда можно сделать вывод о преимущественном смещении равновесия вправо, т.е. о преобладании в системе продуктов реакции.
б) исходные концентрации находим как сумму: Исходная = равновесная + расход концентрация концентрация вещества А на образование вещества А вещества А, [А] продукта реакции
Расход NO находим на основе стехиометрии уравнения реакции по пропорции: на образование 1 моль NO2 расходуется 1 моль NO 0,4 моль - х
Аналогично определяем исходную концентрацию О2: на образование 2 моль NO2 расходуется 1 моль О2 0,4 моль - х
Ответ: Кр = 13,3, реакция начиналась при концентрациях (моль/л): СNO = 0,6; Задача 2. Вычисление равновесных концентраций реагирующих веществ. Для обратимой реакции I2 г + H2 г ↔ 2HI определите равновесные концентрации Н2 и I2, если их исходные концентрации были соответственно (моль/л): 0,1 и 0,2, а равновесная концентрация HI = 0,1 моль/л. Решение: к моменту равновесия концентрации исходных веществ понизятся, а продукта реакции – увеличатся. Поэтому равновесные концентрации можно рассчитать как разность: Равновесная = исходная - расход вещества А концентрация концентрация на образование вещества А вещества А продукта реакции
Расход водорода находим на основании уравнения реакции: на образование 2 моль HI расходуется 1 моль H2 0,1 моль - х
Аналогично определяем расход и равновесную концентарцию I2: на образование 2 моль HI расходуется 1 моль I2 0,1 моль - у
Ответ: равновесные концентрации веществ (моль/л) равны: [H2] = 0,05; [I2] = 0,15 Задача 3. Определение изменения энергии Гиббса реакции DG0 по значению константы равновесия Кр. Константа равновесия реакции: СО + Н2О ↔ СО2 + Н2 равна 1,4 при температуре 727°С. Найдите DG этой реакции и определите ее направление при данной температуре. Рещение: взаимосвязь изменения энергии Гиббса реакции и Кр описывается изотермой:
Т = 727 + 273 = 1000 К. Тогда: DG = -8,31·1000·2,3 lg 1,4 = -2,79·103 Дж = - 2,79 кДж Поскольку DG < 0, при данной температуре протекает прямая реакция. Задача 4: Сдвиг химического равновесия, принцип Ле-Шателье. Как повлияет: а) повышение температуры; б) повышение давления на смещения равновесия следующей реакции: 2Н2 г + О2 г ↔ 2Н2О ж, DH0 = -571 кДж Решение: В состоянии равновесия скорости прямой и обратной реакции равны, т.е. в единицу времени в результате процесса образуется столько же вещества, сколько их распадается на исходные вещества. Это состояние равновесия сохраняется до тех пор, пока сохраняются постоянные три параметра системы: 1) концентрации реагирующих веществ; 2) температура; 3) давление (для газов). При изменении этих условий скорости прямой и обратной реакции приобретают различные значения: увеличивается скорость той реакции, которая уменьшает произведенное воздействие (принцип Ле-Шателье). Согласно этому принципу, если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в сторону, уменьшающему это воздействие. Но через некоторое время снова наступает равенство скоростей прямой и обратной реакции и устанавливается новое состояние равновесия с новыми концентрациями исходных веществ и продуктов реакции (но той же Кр). Переход системы из одного состояния в другое называется смещением или сдвигом химического равновесия. В приведенном уравнении прямая реакция является экзотермической, идущей с выделением тепла. С повышением температуры, согласно принципу Ле-Шателье, увеличивается скорость реакции, поглощающей это подводимое тепло, т.е. эндотермической обратной реакции. Равновесие смещается влево. При повышении давления, в соответствии с принципом Ле-Шателье, должна увеличиваться скорость реакции, идущей с уменьшением давления, в данном примере – в прямой реакции уменьшается число молекул газа и, следовательно, при неизменном объеме сосуда уменьшается и давление: равновесие смещается в сторону образования продуктов реакции, вправо. Контрольные вопросы для самопроверки 1. Какие реакции называют обратимыми по направлению? 2. Что такое химическое равновесие? Кинетические и термодинамические условия химического равновесия. 3. Перечислите признаки, характеризующие состояние химического равновесия. 4. Изобразите графически зависимость скорости прямой и обратной реакций от времени, укажите состояние равновесия. 5. Из приведенных ниже значений термодинамических функций укажите, которые являются критерием состояния равновесия (при p,T=const) а) в изолированной системе б) в закрытой системе: 1) ∆H<0 2) ∆H>0 3) ∆H=0 4) ∆S<0 5) ∆S>0 6) ∆S=0 7) ∆G<0 8) ∆G>0 9) ∆G=0 6. Приведите математическое выражение закона действующих масс для химического равновесия. Что называют константой равновесия реакции? зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления? 7. Числовое значение константы равновесия определяет глубину превращения исходных веществ в продукты реакции. Если константа скорости прямой реакции много меньше константы скорости обратной реакции, то как это влияет на числовое значение константы равновесия и выход продуктов реакции? 8. Почему в выражение константы равновесия не входят концентрации веществ, находящихся в твердой фазе? 9. Что следует понимать под сдвигом химического равновесия? Что означает смещение равновесия в сторону прямой реакции? В сторону обратной реакции? Дата добавления: 2015-12-16 | Просмотры: 4006 | Нарушение авторских прав |
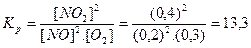
 Сисх NO = 0,2 + 0,4 = 0,6 моль/л
Сисх NO = 0,2 + 0,4 = 0,6 моль/л Сисх О2 = 0,3 + 0,2 = 0,5 моль/л
Сисх О2 = 0,3 + 0,2 = 0,5 моль/л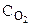 =0,5
=0,5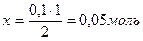 [Н2] = 0,1 – 0,05 = 0,05 моль/л
[Н2] = 0,1 – 0,05 = 0,05 моль/л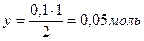 [I2] = 0,2 – 0,05 = 0,15 моль/л
[I2] = 0,2 – 0,05 = 0,15 моль/л