 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Примеры решения типовых задач. Растворимость вещества определяется концентрацией насыщенного при данной температуре его раствора, которая может быть выражена в любых единицах.
Растворимость вещества определяется концентрацией насыщенного при данной температуре его раствора, которая может быть выражена в любых единицах. Многие электролиты обладают ограниченной растворимостью в воде. На практике часто встречаются гетерогенные системы, в которых осадок малорастворимого электролита находится в равновесии с насыщенным раствором этого электролита. Такое равновесие называют гетерогенным: осаждение
осадок растворение раствор
Константа равновесия гетерогенного процесса определяется только произведением концентраций ионов в растворе и не зависит от концентрации твердого компонента: КS = [An+]m·[Bm-]n = ПР(AmBn) Произведение концентраций ионов в насыщенном растворе малорастворимого электролита (в степенях, равных стехиометрическим коэффициентам) при данной температуре есть величина постоянная; ее называют произведением растворимости (ПР). В более строгих расчетах заменяется произведением активностей. Произведение растворимости (ПР) - константа, которой приходится часто пользоваться для решения многих практических вопросов. Задача 1. Выбор осадителя для отделения того или иного иона Исходя из величин ПР, скажите, какой осадитель лучше выбрать: (NH4)2SO4, (NH4)2CO3 или (NH4)2C2O4 для наиболее полного осаждения из раствора иона Ва2+? Решение: осадитель подбирается таким образом, чтобы ПР осаждаемого вещества было наименьшим (т.е. осаждаемое вещество должно иметь наименьшую растворимость). Сравним ПР сульфата, карбоната и оксалата бария: ПР(ВaSO4)=1.1·10-10; ПР(ВаСО3) = = 4.0·10-10; ПР(ВаС2О4)=1.1·10-7. Как видим, наименьшую величину ПР имеет сульфат бария(1.1·10-10). Следовательно, для более полного осаждения ионов Ва2+следует взять осадитель(NH4)2SO4. Примечание. По величине ПР можно сравнивать растворимость веществ только с одинаковыми числами n и m, т.е. образующих одинаковое число ионов. Задача 2. Вычисление произведения растворимости Вычислите ПР(AgCl), если известно, что 1л его насыщенного раствора при 20°С содержит 0.0016г AgCl. Решение: чтобы вычислить ПР труднорастворимого электролита, нужно найти его растворимость (моль/л). Молярная масса М(AgCl)=143.3г/моль, следовательно, молярная концентрация AgCl равна: С(AgCl) = m(AgCl) = 0.0016 = 1.12·10-5 моль/л M·Vр-ра 143.3´1 Растворенная часть AgCl находится в растворе в виде ионов: AgClp ® Ag+р + Cl-р Из уравнения диссоциации видим, что 1 моль AgCl дает 1 моль ионов Ag+ и 1 моль ионов Cl-, следовательно: [AgCl]p = [Ag+] = [Cl-] = 1.12·10-5 моль/л, а произведение концентраций ионов в насыщенном растворе и есть произведение растворимости, т.е. ПР(AgCl) = [Ag+]·[Cl-] = 1.12·10-5 ´ 1.12·10-5 = 1.12·10-10 Задача 3 Вычисление растворимости по величине произведения растворимости Произведение растворимости BaSO4 при 25°С равно 1.1·10-10. Вычислите его растворимость при той же температуре (в г/л). Решение: обозначим растворимость BaSO4 (моль/л) через х. Но весь растворенный BaSO4 находится в виде ионов, и каждая молекула дает при диссоциации 1 ион Ва2+ и 1 ион SO42-: BaSO4 p ® Ba2+ + SO42- x моль/л х моль/л х моль/л [BaSO4]p = [Ba2+] = [SO42-] = x; ПР(BaSO4) = [Ba2+]·[SO42-] = 1.1·10-10 Подставляя в выражение ПР концентрации ионов, выраженные через х, получим:
Следовательно, и [BaSO4]p = 1.06·10-5 моль/л. Для перевода молярной концентрации BaSO4 в г/л, воспользуемся формулой: m(BaSO4) = n·M(BaSO4) и получим: [BaSO4]=1.06·10-5·233 = 2.47·10-3 г/л (где 233г/моль=М(BaSO4)). Задача 4. Образование осадка Рассчитайте, выпадает ли осадок CaSO4 при смешивании равных объемов 0.02М раствора CaCl2 и 0.2М раствора Na2SO4. ПР(CaSO4) = 6.3·10-5 Решение: согласно общему принципу Ле Шателье, гетерогенное равновесие
При сливании равных объемов двух солей объем полученной смеси в 2 раза больше, чем объем каждого из взятых растворов, следовательно, и концентрация каждой из солей уменьшится в 2 раза. После смешения будем иметь: [CaCl2]= 0.01моль/л; [Na2SO4]= = 0.1моль/л Считая, что соли полностью диссоциированы: CaCl2 ® Ca2+ + 2Cl-; Na2SO4 ® 2Na+ + SO42- можем записать: [Ca2+] = 0.01моль/л; [SO42-] = 0.1моль/л. Находим ионное произведение: [Ca2+]·[SO42-] = 0.01 ´ 0.1 = 1·10-3. Ионное произведение, как видим из расчетов, больше, чем ПР(CaSO4), т.е. 1·10-3 > 6.3·10-5. Следовательно, осадок образуется.
Задача 5. Выпадает ли осадок CaCrO4 при смешивании 10мл 0.1М раствора CaCl2 и 5мл 0.05М раствора K2CrO4? Решение: найдем концентрацию каждого из веществ после смешивания растворов. Для этого первоначальную концентрацию умножаем на степень разбавления данной соли: [CaCl2] = [K2CrO4] = Считая диссоциацию полной: CaCl2 ® Ca2+ + 2Cl-; K2CrO4 ® 2K+ + CrO42- можно записать: [Ca2+]=6.7·10-3моль/л, [CrO42-]=1.7·10-2моль/л. Найдем ионное произведение: [Ca2+]·[CrO42-] = 6.7·10-3 ´ 1.7·10-2 = 1.14·10-4. Сравнивая ионное произведение с ПР(CaCrO4), видим, что ионное произведение меньше, чем ПР(CaCrO4): 1.14·10-4 < 7.1·10-4. Делаем вывод: осадок выпасть не может, т.к. полученный после смешивания раствор будет ненасыщенным относительно хромата кальция. Задача 6. Объясните, почему а) CaCO3 растворяется в HСl, б) почему CaSO4 в кислотах не растворяется? Решение. Р астворение осадка. Чтобы растворить осадок, нужно каким-то образом уменьшить произведение концентраций ионов (“ионное произведение”) в растворе. Это можно сделать, связывая хотя бы один из ионов, посылаемых в раствор осадком, или в малодиссоцирующее соединение, или в комплексное соединение, или изменяя степень окисления данного иона, или другим путем. Образование слабодиссоциирующего соединения.
в результате ионное произведение(произведение концентраций ионов Са2+ и СО32-) станет меньше, чем ПР(СаСО3). Это, в свою очередь, вызовет смещение равновесия (1) вправо, т.е. осадок СаСО3 будет растворяться.
Равновесие между твердой фазой CaSO4 и ионами Са2+ и SO42- нарушаться не будет, поэтому осадок не растворяется. Вывод. Труднорастворимые в воде соли слабых кислот растворяются в сильных кислотах, а соли сильных кислот в кислотах не растворяются. Задача 7. Объясните растворение PbI2 в водном растворе KI.
связывается ионами иода в устойчивый комплексный ион [PbI4]2-, в результате концентрация ионов Pb2+ в растворе уменьшается, уменьшается и ионное произведение, что приводит к смещению равновесия (3) между твердой фазой PbI2 и ионами вправо. Осадок PbI2 растворяется.
Контрольные вопросы для самопроверки. 1. Какую систему называют гетерогенной? Какое равновесие называют гетерогенным?
осадок ионы в растворе Как называются прямая и обратная реакции?
4. Дайте определение понятия “Константа(произведение) растворимости”. 5. Напишите математическое выражение ПР для следующих веществ: AgCl, PbCl2, CaSO4, HgI2, Ca3(PO4)2. 6. Определите, какой сульфат менее растворим в воде при 25°С, если ПР имеют следующие значения: ПР(CaSO4)= 6.1·10-5; ПР(BaSO4) = 1.1·10-10
8. Как оценить, пользуясь правилом ПР, в каких случаях при сливании растворов осадок образуется, а в каких – нет? 9. Рассчитайте, выпадет ли осадок AgCl при сливании равных объемов: 0.02М раствора NaCl и 0.2М раствора AgNO3, если ПР(AgCl) = 1.6·10-10. 10. Каковы условия растворения осадков? Объясните, почему ВаСО3 легко растворяется в HСl, а BaSO4 не растворяется. Тема: Окислительно-восстановительные процессы. Содержание темы: Сопряжённые ОВ пары. Сравнительная сила окислителей и восстановителей. ОВ и электродные потенциалы. Механизм их возникновения, зависимость их от различных факторов. Уравнения Нернста-Петерса. Прогнозирование направления ОВ-процесса по величинам ОВ-потенциалов. Диффузный и мембранный потенциалы. Медико-биологическое значение ОВ-процессов. Разделы, выносимые на самостоятельную проработку: Степень окисления и ее определение. Окислительно-восстановительные реакции. Процессы окисления и восстановления. Окислители и восстановители. Окислительно-восстановительная двойственность. Домашнее задание для подготовки к занятию. СОХЖ с. 208-215, ЕОХ с. 131-139. Разберите примеры 1-6 из ГЗХ примеры 1, 2, 3, гл. VIII, 6. Письменно выполните задания. К занятию №1 1. Определите степени окисления выделенных элементов: а) N H3; б) Р4 ; в) Cr 2O72-; г) S O42-. 2. Среди перечисленных укажите а) восстановители, б) с окислительно-восстанови-тельной двойственностью, в) окислители: Mn; Fe2+; ClO3-; NO3-; PbO2; K2MnO4; NaJ. 3.Окисление или восстановление происходит при переходах: а) SO42- ® SO32- б) NO3- ® NO в) JO3- ® J- г) H2O2 ® H2O? 4. Имеются две взаимодействующие ОВ-пары. Установите окислитель и восстановитель и составьте уравнение реакции в ионном виде: a) H2O2 + 2H+ + 2e ® 2H2O j10 = 1,78 В Fe3+ + e ® Fe2+ j20 = 0,77 В б) MnO4- + 8H+ + 5e ® Mn2+ + 4H2O j10 = 1,51 B O2 + 2H+ + 2e ® H2O2 j20 = 0,68 B 5. Определите окислитель, восстановитель, направление ОВ реакции и расставьте коэффициенты: а) HNO3 + S ↔ NO + H2SO4 б) CuS + H2O2 + HCl ↔ CuCl2 + S + H2O К занятию №2 1. Определите окислитель, восстановитель, направление ОВ реакции и расставьте коэффициенты: а) NaBr + MnO2 + H2SO4 ↔ Na2SO4 + MnSO4 + Br2 + H2O б) FeSO4 + KClO3 + H2SO4 ↔ KCl + Fe2(SO4)3 + H2O 2. Какой из окислителей: MnO2, PbO2, K2Cr2O7 - является наиболее эффективным по отношению к HCl при получении Cl2? 3. Можно ли использовать KMnO4 в кислой среде в качестве окислителя в следующих процессах при стандартных условиях: а) HNO2 + H2O - 2e = NO3- + 3H+; б) 2H2O - 2e = H2O2 + 2H+; в) H2S - 2e = S + 2H+ 4. Можно ли при стандартных условиях окислить хлорид водорода до Cl2 с помощью серной кислоты? Ответ подтвердите расчетом DG°298. Разберите ситуационные задачи № 16, 17, 28. Факультативно. Решите задачи ГХЗ, 1987 №608, 609,610,611,674,677. Дата добавления: 2015-12-16 | Просмотры: 2451 | Нарушение авторских прав |

 AmB n ¯ mAn+ + nBm-
AmB n ¯ mAn+ + nBm- х2 = 1.1·10-10, х = Ö1.1·10-10 = 1.06·10-5 (моль/л)
х2 = 1.1·10-10, х = Ö1.1·10-10 = 1.06·10-5 (моль/л)
 AmBn тв mAn+р-р + nBm-р-р можно сместить влево в сторону осаждения, увеличив концентрацию ионов в растворе. И наоборот, равновесие сместится вправо, в сторону растворения осадка, при уменьшении концентрации ионов в растворе. Осадок труднорастворимого соединения при смешивании растворов двух электролитов может образоваться только в том случае, когда произведение концентраций встретившихся в растворе ионов(“ионное произведение”) превысит величину произведения растворимости.
AmBn тв mAn+р-р + nBm-р-р можно сместить влево в сторону осаждения, увеличив концентрацию ионов в растворе. И наоборот, равновесие сместится вправо, в сторону растворения осадка, при уменьшении концентрации ионов в растворе. Осадок труднорастворимого соединения при смешивании растворов двух электролитов может образоваться только в том случае, когда произведение концентраций встретившихся в растворе ионов(“ионное произведение”) превысит величину произведения растворимости. =
= 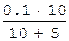 = 6.7·10-3 моль/л
= 6.7·10-3 моль/л = 1.7·10-2 моль/л
= 1.7·10-2 моль/л
 а) в насыщенном растворе СаСО3 устанавливается равновесие между твердой фазой СаСО3 тв и ионами Са2+ и СО32- : СаСО3 тв Са2+р + СО32-р (1)
а) в насыщенном растворе СаСО3 устанавливается равновесие между твердой фазой СаСО3 тв и ионами Са2+ и СО32- : СаСО3 тв Са2+р + СО32-р (1)
 Ионы водорода прибавленной кислоты HСl будут связывать карбонат-ионы (СО32-) в слабодиссоциирующую угольную кислоту: СО32- + 2Н+ Н2СО3 ®Н2О+СО2 (2),
Ионы водорода прибавленной кислоты HСl будут связывать карбонат-ионы (СО32-) в слабодиссоциирующую угольную кислоту: СО32- + 2Н+ Н2СО3 ®Н2О+СО2 (2),
 б) Сульфат кальция в кислотах не растворяется, т.к. эта соль образована сильной серной кислотой. Введенные с соляной кислотой ионы водорода не могут связать анионы SO42- ; CaSO4 тв Са2+р + SO42-p ; HCl ® Cl- + H+
б) Сульфат кальция в кислотах не растворяется, т.к. эта соль образована сильной серной кислотой. Введенные с соляной кислотой ионы водорода не могут связать анионы SO42- ; CaSO4 тв Са2+р + SO42-p ; HCl ® Cl- + H+ Решение. Образование комплексного иона. Ион Pb2+, посылаемый в раствор осадком PbI2, согласно уравнению: PbI2 тв Pb2+р + 2I-р (3),
Решение. Образование комплексного иона. Ион Pb2+, посылаемый в раствор осадком PbI2, согласно уравнению: PbI2 тв Pb2+р + 2I-р (3),
 2. Имеется гетерогенное равновесие: АВ А+ + В-
2. Имеется гетерогенное равновесие: АВ А+ + В-
 3. Какая постоянная величина характеризует состояние гетерогенного равновесия: твердая фаза ионы в растворе?
3. Какая постоянная величина характеризует состояние гетерогенного равновесия: твердая фаза ионы в растворе?
 7. Для гетерогенного равновесия: AgClтв Ag+р + Cl-р укажите, какому раствору (насыщенному, ненасыщенному, пересыщенному) соответствует каждый из трех случаев [Ag+]·[Cl-] > ПР; [Ag+]·[Cl-] < ПР; [Ag+]·[Cl-] = ПР.
7. Для гетерогенного равновесия: AgClтв Ag+р + Cl-р укажите, какому раствору (насыщенному, ненасыщенному, пересыщенному) соответствует каждый из трех случаев [Ag+]·[Cl-] > ПР; [Ag+]·[Cl-] < ПР; [Ag+]·[Cl-] = ПР.