 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Молярная концентрация эквивалентов вещества - это количество вещества эквивалентов растворенного вещества в 1 литре раствора ( моль/л).
Этот вид концентрации раньше назывался нормальной концентрацией и обозначался символом N или Сн. (Сейчас эти обозначения употреблять не рекомендуется). Если выразить число моль эквивалентов через молярную концентрацию эквивалента n(Э) = С(Э)·V, тогда закон эквивалентов примет вид: С1 Отсюда следует: если молярные концентрации эквивалента растворов реагирующих веществ равны, то равны и объемы растворов этих веществ. Примеры современной записи названия и обозначение растворов серной кислоты с указанием молярной концентрации эквивалентов: 1.0 н H2SO4 - однонормальный раствор C(1/2 H2SO4) = 1.0 моль/л 0.1 н H2SO4 - децинормальный раствор C(1/2 H2SO4) = 0.1 моль/л 0.01 н H2SO4 - сантинормальный раствор C(1/2 H2SO4) = 0.01 моль/л
Пример 5. Вычислите молярную концентрацию эквивалентов серной кислоты Cн, если 10 г ее растворили в мерной колбе на 500 мл.
m(H2SO4) =? Ответ: 0.41 моль/л Пример 6. Вычислите массу серной кислоты, содержащейся в 250 мл 0.1 н раствора, если f(H2SO4) = 1/2
m(H2SO4) =?
Контрольные вопросы для самопроверки 1. Что называется раствором? Что такое растворитель, растворенное вещество? 2. Что называют растворимостью? 3. Какие процессы происходят при растворении вещества? 4. Какой процесс называется кристаллизацией? 5. Какие растворы называются насыщенными, ненасыщенными, пересыщенными? 6. Что называется концентрацией раствора? 7. Какие существуют способы выражения содержания вещества в растворе? 8. Что называется массовой долей растворенного вещества? Как она вычисляется? 9. Какие растворы называются концентрированными, разбавленными? 10. Что такое эквивалент? 11. Как рассчитать молярную массу эквивалента кислоты, основания, соли? 12. Что такое фактор эквивалентности? Как он рассчитывается? 13. Что называют молярной массой эквивалента? Как она рассчитывается? 14. Значение растворов и воды в жизнедеятельности организма. Тема: Введение в количественный анализ. Теоретические основы объемного (титриметрического) анализа Содержание темы. Сущность титриметрического анализа, его точность. Понятия: титрование, титрованный раствор, точка эквивалентности. Способы фиксирования точки эквивалентности. Требования к реакциям, применяемым в титриметрическом анализе. Классификация методов титриметрического анализа. Условия, необходимые для выполнения объемного анализа. Основные виды концентраций, используемые в титриметрическом анализе. Основные расчетные формулы. Приготовление титрованных растворов. Растворы с приготовленным титром (стандартные). Исходные (стандартные, установочные) вещества. Растворы с установленным титром (стандартизированные). Фиксаналы. Измерение объемов. Правила титрования. Домашнее задание для подготовки к занятию. Подготовьте раздел «Способы выражения концентрации растворов, применяемые в объемном анализе – молярная концентрация эквивалента (нормальная концентрация) и титр». Решите задачи. 1. Рассчитайте молярную массу эквивалента H3PO4 в реакциях обмена ионов Н+. 2. Навеска «х.ч.» соды Na2CO3 массой 1,06 г растворена в мерной колбе объёмом 2 л. Рассчитайте молярную концентрацию эквивалента этого раствора. 3. Сколько мл 0,1000 н Ba(OH)2 эквивалентны 0,3650 г HCl? 4. Чему равен титр раствора HNO3, если в 100,0 мл его содержится 0,01000 моль HNO3? 5. В каком объеме следует растворить 0,2800 г KOH, чтобы получить 0,0500 н. раствор? 6. Какому объему 0,1000 н. NaOH эквивалентен 1,00 мл 0,5000 н. раствора H2SO4? 7. Чему равен титр раствора, в 200,0 мл которого содержится 0,1000 Э Na2SO4? 8. 20,00 мл раствора соли с молярной концентрацией эквивалента 0,2750 моль/л разбавили до 500 мл. Какова нормальная концентрация раствора?
Дата добавления: 2015-12-16 | Просмотры: 2333 | Нарушение авторских прав |

 ;
; 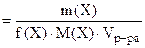
 ·V1=C2
·V1=C2  ·V2
·V2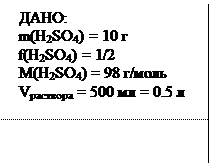
 =
=
=
=  = 0.41 моль/л
= 0.41 моль/л
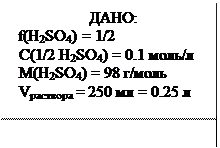
 Отсюда: m(H2SO4) = С(Э) . f . M . V
m(H2SO4) = 0.1 . 1/2 . 98 . 0.25 = 1.225 г.
Ответ: 1.225 г.
Отсюда: m(H2SO4) = С(Э) . f . M . V
m(H2SO4) = 0.1 . 1/2 . 98 . 0.25 = 1.225 г.
Ответ: 1.225 г.