|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Хирургическое лечение аневризм и расслоений аортыМониторинг при операциях на восходящей аорте и ее дуге включает определение прямого артериального давления на обеих лучевых и одной из бедренных артерий (для немедленного выявления нарушений перфузии во время искусственного кровообращения, что особенно важно при расслоениях аорты), измерение центрального венозного давления, давления в легочной артерии, сатурации О2 в смешанной венозной крови и сердечного выброса с помощью катетера Свана-Ганца. Наиболее распространенным сегодня является интраопера-ционное чреспищеводное ЭхоКГ-мониторирование, выполняемое для оценки функции и состояния клапанов сердца, размеров, распространенности и характера поражения аорты, функции левого желудочка, положения венозной канюли в правых полостях сердца при бед-ренно-бедренном обходе, определения наличия и степени эвакуации воздуха из полостей сердца при окончании ИК. Очень важен мониторинг температуры различных отделов тела, для чего, в частности, катетеризацию мочевого пузыря производят катетером Фолея с термодатчиком. Другие термодатчики устанавливают в носоглотке (косвенно отражает температуру головного мозга), пищеводе (соответствует приблизительно температуре крови). С учетом того что показания мочевого датчика могут зависеть от интенсивности диуреза, устанавливают ректальный термодатчик. Обязательным также является мониторирование концентра- ции СО2 в выдыхаемой смеси, частично активированного времени свертываемости, газового и электролитного состава артериальной и венозной крови. Стандартное мониторирование ЭКГ осуществляется в отведениях II и V5. Принципы искусственного кровообращения при операциях на восходящем отделе и дуге аорты. При первичных операциях канюляцию правых отделов сердца осуществляют доступом через правое предсердие. Более предпочтительна раздельная канюляция верхней и нижней полых вен, но если не требуется проведения глубокой гипотермии с циркуляторным арестом или протезирования митрального клапана, допустимо использование единой двухпросветной канюли для правого предсердия. К недостаткам последнего способа канюляции относятся неполная изоляция сердца, возможность попадания воздуха в контур АИК при случайном вскрытии правого предсердия во время пересечения аорты для наложения проксимального анастомоза и вероятность миграции канюли во время операции. При повторных операциях до выполнения стернотомии канюли-руют бедренные артерию и вену, а при наличии ложной аневризмы или интимного прилегания аневризмы к задней поверхности грудины до вскрытия грудной клетки начинают искусственное кровообращение по схеме бедренная вена — бедренная артерия, больного охлаждают и по достижении глубокой гипотермии производят остановку кровообращения. Если стре-нотомию осуществляют без технических проблем и осложнений, то далее возобновляют искусственное кровообращение. Для дренирования левых полостей сердца канюлю через верхнюю правую легочную вену проводят в левый желудочек. В качестве альтернативной методики возможно дренирование правого желудочка доступом через легочную артерию. Для проведения ретроградной кардиоплегии катетеризируют коронарный синус доступом через правое предсердие. Для мониторирования температуры миокарда к верхушке сердца или передней межжелудочковой борозде в нижней порции прикрепляют термодатчик. В условиях умеренной системной гипотермии (26—28 °С) искусственное кровообращение проводят с объемной скоростью 2,2—2,5 л/мин/м2 с гемодилюцией до показателей Ht 15-25 %. Защита миокарда осуществляется чаще всего путем холодовой (4 °С) гиперкалиевой (до 30 мэкв/л) кардиоплегии оксигенированной кровью. При состоятельности аортального клапана первую дозу вводят в корень аорты через иглу большого диаметра в течение 2 мин со скоростью 300 мл/мин. Дополнительную дозу (200 мл/мин в течение 2 мин) ретроградно вводят в коронарный синус для достижения начальной температуры миокарда 10—12 °С. При гипертрофии сердца скорость введения увеличивают до 350 мл/мин (антеградно) и до 250— 300 мл/мин (ретроградно). Дополнительные инфузии кардиоплегиче-ского раствора проводят каждые 20—30 мин ретроградным путем. При несостоятельности аортального клапана охлаждение и остановка сердца возможны только с помощью ретроградной кардиоплегии. При недостаточном охлаждении в такой ситуации после вскрытия аорты кардиоплегический раствор вводят непосредственно в устья коронарных артерий. Наружное охлаждение сердца осуществляют пакетами со льдом, при этом левый диафрагмальный нерв во избежание его холодовой травмы изолируют от пакетов подушечкой. После восстановления проходимости аорты до снятия с нее зажима в коронарный синус вводят теплый кровяной раствор (150 мл/мин в течение 3 мин) с дренированием через иглу в восходящей аорте, что также облегчает удаление воздуха из аорты и коронарных артерий. Методика глубокой гипотермии с остановкой кровообращения и ретроградной перфузией головного мозга является на сегодняшний день наиболее оптимальным способом защиты головного мозга при оперативных манипуляциях на дуге аорты. АИК подключают по схеме полые вены — бедренная артерия, причем канюля для верхней полой вены имеет Y-образный разъем, в который подключают ответвление артериальной магистрали, пережатое на начальном этапе стандартного ИК. По достижении температуры 20 °С становится возможным отключить АИК на относительно безопасный период до 30 мин при условии полного исчезновения электрической активности мозга по данным ЭЭГ (метаболические потребности головного мозга при такой температуре снижаются до 23 % от исходных). Если изолиния на ЭЭГ не возникает, то требуется более глубокое охлаждение. Можно ориентироваться на соматосенсор-ные или слуховые вызванные потенциалы, которые исчезают при более продолжительном охлаждении, чем ЭЭГ-сигналы. Весьма показательным для остановки кровообращения при глубокой гипотермии является мониторирование насыщения крови О2 в бульбусе внутренней яремной вены. Здесь сатурация кислорода приблизительно на 20 % меньше, чем в смешанной венозной крови, что отражает высокие метаболические потребности головного мозга. По достижении 95 % насыщения крови О2 в яремной вене можно говорить о максимальном снижении метаболической активности мозга и приступать к остановке кровообращения. При температуре 15 °С метаболическая
Во время охлаждения больного температурный градиент между различными частями тела не должен превышать 10 °С из-за опасности повреждения органов и тканей. Более равномерному охлаждению способствует введение а-адреноблока-торов. Следует тщательно избегать гемодилюции и гипергликемии, способствующих повреждению мозга [Ergin M.A. et al., 1994]. На время остановки кровообращения голова пациента обкладывается льдом, чтобы исключить согревание за счет комнатной температуры. После восстановления искусственного кровообращения согревание произ- водится с разницей температур между разными частями тела, также не превышающей 10 °С. После согревания больного вводятся лазикс и маннитол, причем последний не только для стимуляции диуреза, но и для снижения возможного образования свободных радикалов. В последние годы наиболее эффективным в отношении защиты мозга во время остановки кровообращения при глубокой гипотермии и все более широко применяемым стал метод ретроградной перфузии головного мозга. Суть его заключается в том, что при остановке кровообращения пережимают венозную магистраль после Y-образного разъема канюли верхней полой вены и снимают зажим с артериальной магистрали указанного соединения, что позволяет начать селективную ретроградную перфузию мозга через систему яремных вен. Нагнетание артериальной крови осуществляют при объемной скорости до 500 мл/мин и перфузионном давлении до 30 мм рт.ст. Ценность данного метода заключается не только в том, что он в какой-то степени обеспечивает сохранившиеся минимальные метаболические потребности головного мозга, но и способствует наиболее адекватному и равномерному охлаждению ткани мозга, удалению продуктов метаболизма, предотвращает согревание мозга во время остановки кровообращения, при этом происходит также ретроградное отмывание воздуха и материальных частиц через свободные устья ветвей дуги аорты [Cosel-li J.S., 1994]. Считается, что в среднем данная методика позволяет удлинить безопасное время остановки кровообращения на срок до 60 мин [Svensson L.G., Crawford E.S., 1997]. При необходимости более продолжительных манипуляций на дуге аорты проводят селективную катетеризацию брахиоцефального ствола проксимальнее его бифуркации и перфузию через артериальную магистраль приблизительно в объеме 1 л/мин, чтобы АД в лучевых артериях поддерживалось на уровне не менее 70 мм рт.ст. Левые сонную и подключичную артерии в этот момент пережимают. При несостоятельности виллизиевого круга (градиент АД между правой и левой лучевыми артериями) требуется дополнительная катетеризация для перфузии через левую сонную артерию. Указанная методика достаточно трудоемка, технически сложна и сопровождается значительной частотой осложнений (отслоение интимы ветвей дуги аорты, эмболия головного мозга и т.д.), и ее эффективность может быть существенным образом ограничена при ок-клюзирующих поражениях брахио-цефальных артерий. Выбор протеза аорты. В настоящее время для протезирования аорты наиболее широкое распространение получили тканые двойные велюровые протезы из дакрона. При операциях с искусственным кровообращением от таких протезов требуется еще и нулевая пороз-ность, которая достигается импрегнацией в протез коллагена или желатина. Операции на проксимальной грудной аорте при дегенеративных заболеваниях. К принципиальным вопросам, возникающим при планировании оперативной тактики во время указанных вмешательств, относятся два: насколько сохранена синотубулярная борозда и насколько выражены аневризматические изменения дуги аорты. При сохранении синотубулярной борозды достаточно линейного протезирования восходящей аорты в зависимости от состояния аортального клапана, дополненного раздельным протезированием. В обратной ситуации, при расширении корня аорты, показано протезирование аортального клапана и восходящей порции аорты клапансодержащим кондуитом. Если дистальная порция восходящей аорты имет нормальный размер или умеренно расширена на уровне безымянной артерии, то может быть наложен прямой дисталь-ный анастомоз с проксимальной порцией дуги или косой под зажимом, расположенным от точки тотчас проксимальнее устья брахиоце-фального ствола и косо захватывающим проксимальную часть нижней полуокружности дуги аорты. При аневризматическом расширении большей части дуги необходимо использование глубокой гипотермии с остановкой кровообращения и ретроградной перфузией головного мозга. При расширении проксимального отдела нисходящей грудной аорты или необходимости применения техники «хобот слона» необходима имплантация ветвей дуги аорты в протез дуги на площадке, а если расширение оканчивается проксимальнее левой подключичной артерии, то возможно формирование дистального анастомоза с косо срезанным линейным протезом или с таковым, выкроенным в виде языка, анастомозиро-ванным кпереди и сзади ветвей дуги, когда сам анастомоз завершается на уровне отхождения безымянной артерии. При интраопера-ционной оценке размеров аорты и соответственно определении границ ее резекции важно представление о нормальных размерах аорты. Коллектив Methodist Hospital использует следующие нормальные значения различных отделов артериального русла [Svensson L.G., Crawford E.S., 1997]. У взрослых с длиной тела между 165 и 178 см диаметр корня аорты не должен превышать 31 мм, восходящей аорты — 32, дуги — 32, проксимальной порции нисходящего отдела — 28, средней порции нисходящей аорты — 27, брюшной аорты на уровне верхней брыжеечной артерии — 26, тотчас под почечными артериями — 19, у бифуркации аорты — 17, об-
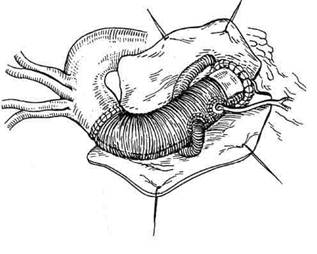
Рис. 5.60. Линейное протезирование восходящей аорты. щей подвздошной артерии — 9 и общей бедренной — 7 мм. У людей выше или ниже указанной длины тела необходимо прибавлять или соответственно вычитать по 6 мм из каждого показателя. Для подвздошных артерий ▲ составляет 4 мм, бедренных — 3 мм. Длина каждого сегмента может быть представлена числом, кратным 5: восходящая аорта — 5 см, дуга — 5, нисходящая до верхней брыжеечной артерии — 25, брюшная аорта от указанной артерии до бифуркации — 15 и от бифуркации аорты до глубокой артерии бедра — 20 см. Линейное протезирование восходящей аорты. Операцию начинают со срединной стернотомии, вскрывают полость перикарда на всем протяжении по его передней поверхности, на его рассеченные края накладывают держалки и разводят (рис. 5.60). Подключают АИК по схеме правое предсердие (или по- лые вены) — проксимальная часть дуги аорты (реже бедренная артерия). Аорту пережимают тотчас проксимальнее уровня отхождения брахиоцефального ствола, вскрывают полость аневризмы и аорту полностью пересекают сразу над верхними точками прикрепления ком-мисур аортального клапана и проксимальнее аортального зажима. Полное пересечение аорты облегчает контроль за герметичностью анастомоза и снижает риск развития ложных аневризм в отдаленном периоде. Производят ревизию аортального клапана и подтверждают его состоятельность. Первым накладывают дистальный анастомоз с линейным протезом нитью пролен 3—0 непрерывным обвивным швом, вначале сшивают заднюю стенку, затем переднюю. Проксимальный анастомоз выполняют таким же образом. Больного переводят в положение Тренделенбурга, эвакуируют воздух, начинают па- раллельное ИК, во время которого контролируют герметичность анастомозов. После восстановления сердечных сокращений и постепенной стабилизации гемодинамики параллельно снижают объем перфузии, а затем аорту деканюлируют. Далее деканюлируют правые отделы сердца, осуществляют гемостаз и остатками аневризматического мешка укрывают протез. Перикар-дотомическое отверстие закрывают заплатой. Дренируют полость перикарда и переднее средостение через контрапертуры ниже мечевидного отростка. Стальной проволокой сводят края грудины. Разрез грудины полностью укрывают мышеч-но-фасциальными швами и зашивают кожу. Раздельное протезирование аортального клапана и восходящей аорты показано больным при сочетании аортального порока и аневризмы восходящей аорты без расширения аортального кольца. После вскрытия полости аневризмы и пересечения аорты, как описано выше, иссекают створки аортального клапана и имплантируют его протез с использованием стандартной техники. Далее ход операции полностью повторяет линейное протезирование восходящей аорты. При более выраженном аннулярном расширении, особенно у пожилых пациентов, допустимо использовать технику, разработанную M.N.Wheat (1964), когда аорту пересекают проксимально тотчас над фиброзным кольцом с оставлением стенок, выкроенных над устьями коронарных артерий. В этой ситуации первоначально накладывают проксимальный анастомоз с обрезанным соответственно ходу линии резекции аорты линейным протезом, так что устья коронарных артерий как бы инкорпорируются в анастомоз и укрываются им. Для усиления проксимального анастомоза в швы захватывают протез аортального клапана. Протезирование аортального клапана и восходящей аорты клапансо-держащим кондуитом показано пациентам с расширением кольца аортального клапана, синотубуляр-ной борозды или синусов Вальсаль-вы. После начала ИК, пережатия аорты и остановки сердца восходящую аорту пересекают в дисталь-ном отделе, иссекают створки аортального клапана с оставлением 1—2 мм ободка на фиброзном кольце, накладывают швы на коммиссу-ры и измеряют диаметр клапанного кольца для подбора кондуита. Далее ход вмешательства зависит от выбора способа оперативной коррекции. Существуют три классические методики протезирования восходящей аорты клапансодержа-щим кондуитом, различающиеся по технике включения в кровоток коронарных артерий. При методике Бенталла—Де Боно устья коронарных артерий непосредственно, в своей естественной позиции в стенке аневризматического мешка, ана-стомозируют с отверстиями в стенке кондуита, что технически проще, но сопровождается значительным количеством повторных операций в ближайшем послеоперационном периоде из-за несостоятельности указанных анастомозов и в поздние сроки в связи с высокой частотой образования ложных аневризм этих анастомозов. Причиной этого является возникающее значительное натяжение между устьями коронарных артерий и стенкой аортального протеза, особенно при низком расположении первых. Кроме того, натяжение может усиливаться вследствие необходимости укутывания кондуита стенками аневризматического мешка, что нередко требуется для достижения гемостаза при таком варианте реконструкции. Для того чтобы исключить недостатки методики Бенталла— Де Боно, связанные с указанным натяжением, было предложено вы- краивать устья коронарных артерий на площадках и производить мобилизацию начальных отделов венечных артерий на протяжении, что позволяет увеличить длину сосудов и свободно реплантировать их в стенку аортального протеза. Данная манипуляция более продолжительна, но главный недостаток ее заключается в следующем. Если ствол правой коронарной артерии может быть выделен без технических сложностей, то мобилизация левой коронарной артерии чревата возможностью повреждения основного ствола, огибающей ветви или легочной артерии. Кроме того, при возникновении кровотечения из анастомоза с левой венечной артерией, как и при методике Бентал-ла—Де Боно, накладывать дополнительные швы достаточно сложно из-за того, что анастомоз расположен на задней поверхности кондуита. Тем не менее данная методика гораздо более надежнее первой и дает отличные отдаленные результаты [Svensson L.G. et al., 1992]. Третьей классической методикой является техника Каброля, когда устья коронарных артерий анасто-мозируют с 8- или 10-миллиметровым линейным протезом, который подшивают по типу бок в бок к кондуиту. Первоначально последний анастомоз размещали на передней поверхности аортального протеза, затем методика была усовершенствована и анастомоз стали накладывать с задней поверхностью кондуита. Методика Каброля значительно облегчает доступ к коронарным анастомозам и линии шва на клапанном кольце при необходимости дополнительного гемостаза, но в дальнейшем за счет анастомоза бок в бок между линейным протезом к коронарным артериям и кондуитом остается высокой вероятность перегиба первого протеза вплоть до развития окклюзии какой-либо из браншей к коронарным артериям. Для устранения приведенных недо- статков L.G. Svensson предложил включать в кровоток левую венечную артерию протезом от кондуита, а правую — реплантировать на площадке. Последняя методика позволяет легко визуализировать все анастомозы, исключает риск перегиба коронарной бранши, делает возможным полное поперечное пересечение аорты (не требуется окутывания кондуита из-за надежности гемостаза), что снижает риск развития ложных аневризм анастомозов в отдаленном периоде. В модификации L.G. Svensson первым этапом накладывают анастомоз по типу конец в конец с левой коронарной артерией непрерывным обвивным швом нитью пролен 4—0 таким образом, чтобы швы прокалывались глубоко через аорту, но не через артерию, что снижает риск кровотечения из анастомоза и образования ложной аневризмы (рис. 5.61). Далее в аортальную позицию имплантируют клапансодержащий кондуит. Диста-льный анастомоз с аортой накладывают нитью пролен 3—0, после чего приоткрывается аортальный зажим и кондуит заполняется кровью и расправляется, что позволяет точнее определить места для реплантации правой коронарной артерии и анастомоза с линейным протезом левой коронарной артерии. Последний протез проводят позади кондуита и пересекают на 1—1,5 см больше длины, необходимой для наложения анастомоза с аортальным протезом. Данный прием позволяет предотвратить возможное натяжение устья левой венечной артерии, которое отодвигается от кондуита при наполнении сердца и начале сокращений. Далее на правой боковой поверхности аортального протеза выкраивают овальное окно. Ниже в кондуите напротив устья правой коронарной артерии вырезают круглое второе окно. В аорте вокруг устья последней вырезают площадку диаметром приблизите -
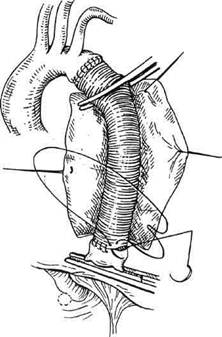
Рис. 5.61. Протезирование аортального клапана и восходящей аорты кла-пансодержащим кондуитом в модификации Svensson. льно 1,5 см и артерию мобилизуют на протяжении, достаточном, чтобы не было натяжения при сопоставлении с нижним круглым отверстием в кондуите. Площадку с устьем правой венечной артерии реплантируют в аортальный протез непрерывным обвивным швом нитью пролен 4—0. Затем в вышележащее овальное окно вшивают косо срезанный протез левой коронарной артерии, начиная с «пятки» анастомоза. Больного переводят в положение Тренделенбурга и накладывают зажимы на правую коронарную артерию и линейный протез к левой. Эвакуируют воздух из левого желудочка и протеза, после чего снимают зажим сначала с аорты, а затем с правой венечной артерии и протеза левой артерии. Протезирование дуги аорты. После канюляции бедренной артерии выполняют полную продольную стернотомию, канюлируют раздельно полые вены, начинают ИК, больного охлаждают, а после исчезновения активности мозга, по данным ЭЭГ, останавливают кровообращение и начинают ретроградную перфузию мозга. Дугу аорты выделяют только по переднебоковой поверхности максимально близко к адвен-тиции, чтобы не повредить диа- фрагмальный, возвратный глоточный и блуждающий нервы, а также случайно не вскрыть левую плевральную полость. Ветви дуги не требуют мобилизации, кроме специальных показаний (вовлечение в аневризматический процесс, стеноз или окклюзия), поскольку их выделение может сопровождаться кровотечением, а устья хорошо визуализируются и из просвета аорты. Во время охлаждения к аортальному протезу подшивают непрерывным обвивным швом нитью пролен 4—0 линейный 10-миллиметровый протез по типу конец в бок для артериальной перфузии. Больного переводят в положение Тренделенбурга, после чего вскрывают просвет дуги аорты на 1 см от устий брахиоцефа-льных артерий. Дистально разрез по переднелатеральной поверхности дуги продлевают до уровня, на котором возможно резецировать расширенный сегмент полностью. На границе между восходящим отделом и дугой аорту полностью пересекают (рис. 5.62, а). Дальнейший ход операции зависит от характера вовлечения дуги аорты. Если поражение не распространяется на нисходящую грудную аорту и/или не требуется выполнения реконструкции по технике «хо-
Рис. 5.62. Протезирование восходящего отдела и дуги аорты при распространении аневризмы дуги аорты до уровня перешейка аорты. а — локализация аневризмы; б — схема операции. бот слона», то дистальную порцию дуги в месте перешейка аорты полностью не пересекают и возможны два варианта реконструкции. В случае, если аневризма дуги аорты заканчивается до уровня отхождения левой подключичной артерии, между косо срезанным аортальным протезом и косо пересеченной дугой аорты от точки проксимальнее устья безымянной артерии до нижней точки окружности дуги на уровне левой подключичной артерии накладывают дистальный косой анастомоз по типу конец в конец. При распространении аневризмы до уровня левой подключичной артерии дистальную часть аортального протеза выкраивают в виде языка с шириной среза по верхней поверхности 2 см. При обоих указанных вариантах в первую очередь накладывают шов по задней, а затем по передней поверхности анастомоза. При вовлечении в аневризматиче-ский процесс начального отдела ни- сходящей грудной аорты, но не более чем в проксимальной трети, указанный отдел аорты полностью пересекают ниже аневризмы, первым этапом накладывают обвивным швом анастомоз между нисходящей аортой и аортальным протезом по типу конец в конец. Далее ветви дуги аорты резецируют на единой площадке и реплантируют в овальное окно, вырезанное по верхней поверхности протеза (см. рис. 5.62, б). В данной ситуации для облегчения доступа к проксимальному отделу нисходящей аорты возможно дополнение стернотомии передне-латеральным доступом слева. В случае распространения аневризмы дистальнее левой подключичной артерии и если требуется этапная реконструкция нисходящего грудного отдела на большем протяжении или торакоабдоминально-го отдела аорты, то для протезирования дуги используют технику «хобот слона». После вскрытия дуги аорты, пересечения ее между восхо- дящим отделом и дугой и дисталь-нее левой подключичной артерии проксимальный сегмент аортального протеза с подшитым линейным 10-миллиметровым протезом вворачивают в дистальный так, чтобы наружная часть двойного протеза составляла 15 см. Начальный отдел внутренней части прошивают держалкой, которую из просвета вдвое сложенного аортального просвета выводят наружу со стороны перегиба. В таком виде аортальный протез вводят в нисходящий отдел грудной аорты; протез анастомозируют с ним по линии пересечения аорты так, что у протеза прошивают обе стенки. Далее линию шва укрепляют П-образными швами на прокладках при возможности по всей линии анастомоза, поскольку из-за частого несовпадения диаметров аорты на уровне перешейка (значительное аневризматическое расширение) и аортального протеза возможны разрывы аорты по линии указанного шва при первой операции и подтекание крови при выполнении второго этапа хирургического лечения (протезирование ди-стальной аорты). Длина части протеза, опущенной в нисходящую аорту, не должна превышать 15 см из-за повышения риска развития парапареза или параплегии с увеличением протяженности свободной порции протеза. По завершении анастомоза с помощью держалки вытягивают проксимальную порцию аортального протеза с подшитым боковым линейным протезом, на аортальном протезе выкраивают окно, куда реплантируются на площадке ветви дуги аорты. Второй этап операции при технике «хобот слона» выполняют в сроки от 6 нед до 3 мес после первичного вмешательства. После того как восстановлена проходимость дуги аорты и ее ветвей у больного, сохраняющего положение Тренделенбурга, начинают медленно восстанавливать искусст- венное кровообращение. Материальные эмболы и воздух удаляют вместе с кровью, свободно вытекающей из проксимального среза аортального протеза и бокового протеза. Брахиоцефальные артерии аккуратно наполняют кровью и с помощью деликатного массирования освобождают от воздуха. Когда поступление воздуха и опасность возможных эмболов прекращается, к боковому протезу подсоединяют вторую артериальную магистраль. Следя за продолжающей поступать кровью из проксимального среза аортального протеза, контролируют наличие остаточных эмболов и воздуха, после чего проксимальную порцию аортального зажима пережимают, ИК восстанавливают до нормального объема и начинают согревание больного. Ретроградную перфузию мозга прекращают и канюлю верхней полой вены переключают от оксигенатора к венозному резервуару. Во время выполнения завершающего этапа реконструкции уже имплантированный аортальный протез пунктируют толстой иглой в верхней точке между зажимом и плечеголовным стволом для дополнительной возможной эвакуации воздуха из протеза и нисходящей аорты. Если восходящий отдел интак-тен, то операцию завершают формированием анастомоза между дис-тальной частью восходящей аорты и протезом дуги. При аневризме восходящего отдела и/или поражении аортального клапана в зависимости от ситуации выполняют либо линейное протезирование восходящей аорты, либо раздельное протезирование восходящей аорты и аортального клапана, либо имплантацию клапансодержащего кондуита (см. выше), завершая операцию наложением анастомоза между протезом восходящей аорты и протезом дуги аорты (кроме случаев использования кондуитов, когда с их помощью реплантируют в протез пра- вую коронарную артерию на площадке и линейный протез к левой коронарной артерии). При аневризматическом вовлечении ветвей дуги аорты или их полной/частичной непроходимости указанные сосуды протезируют отдельными протезами от аортального протеза после наложения диста-льного анастомоза с нисходящей аортой. При необходимости реваскуляри-зации миокарда во время реконструкции проксимальной аорты аор-токоронарное шунтирование выполняют традиционным способом — аутоартериальными или аутовенозными шунтами, причем последние проксимально вшивают в протез восходящей аорты. При выполнении операций на проксимальной аорте больным, которые уже перенесли АКШ ранее, через шунты (после отсечения от аорты во время ИК) проводят антеград-ную кардиоплегию, при стенозах или окклюзии шунтов их заменяют с повторной реваскуляризацией коронарных артерий. Операции на проксимальной грудной аорте при остром расслоении. При любом остром расслоении, захватывающем восходящую аорту, после подключения АИК по схеме полые вены — бедренная артерия больного охлаждают до состояния глубокой гипотермии, останавливают кровообращение и начинают ретроградную перфузию головного мозга. Только после этого вскрывают просвет восходящей аорты последовательным рассечением наружного и внутреннего расслоенных цилиндров, составляющих стенку аорты, и последнюю пересекают полностью проксимально над аортальным клапаном (на 1 см выше верхних точек прикрепления коммиссур) и дистально в месте перехода в дугу. Необходимость глубокой гипотермии на данном этапе операции связана с обязательным тщательным осмотром внутреней поверхности дуги аорты, включая устья ее ветвей, что осуществимо только в условиях остановки кровообращения. Кроме того, применение глубокой гипотермии позволяет исключить использование аортальных зажимов, способных дополнительно травмировать уже поврежденную стенку аорты, облегчает пересечение дистальной части восходящей аорты и сшивание истинного просвета аорты с наружной оболочкой последней. Если при ревизии дуга аорты оказывается интактной (не расслоена) или «тактически интактной» (при наличии расслоения дуги нет разрывов интимы, аневризматиче-ского расширения, расслоение не продолжается в дистальные отделы грудной аорты, не нарушена проходимость ветвей дуги), то сшивают непрерывным обвивным или матрацным швом интимальный и ад-вентициальный слои аорты сразу проксимальнее брахиоцефального ствола, а затем накладывают диста-льный косой анастомоз между протезом восходящей аорты и дугой аорты от точки проксимальнее устья брахиоцефального ствола до нижней поверхности дуги аорты нитью пролен 4—0 или 5—0 непрерывным обвивным швом. Далее возобновляют ИК с артериальной перфузией как ретроградно, так и антеградно через аортальный протез либо подшитый к нему боковой протез. Антеградная перфузия снижает риск разрыва дистального анастомоза (заключенного в слепой проксимальный карман аорты при изолированной ретроградной перфузии), нарушений перфузии дуги аорты, роста ложного канала в оставшейся расслоенной части аорты и эмболии мозга. В случае распространения расслоения восходящей аорты в дугу при небольших размерах фенестра-ции в дуге аорты и отсутствии расширения дуги возможно ушивание дефекта интимы обвивным швом или отдельными швами на прокладках, после чего формируют ди-стальный анастомоз, как описано выше. При расслоении восходящей аорты с переходом на дугу, сопровождающимся значительными разрывами интимы в дуге аорты или ее расширением, требуется протезирование дуги аорты. В этой ситуации аорту пересекают сразу за левой подключичной артерией, сшивают, как описано выше, наружный и внутренний ее слои и накладывают дистальный анастомоз с линейным аортальным протезом. Брахиоцефальные артерии резецируют на площадке, которую прошивают циркулярно по краю для сопоставления расслоенных слоев аорты. Шов укрепляют тефлоновой полоской, выкроенной в виде овала и укладываемой по периметру площадки. Далее сформированную площадку с устьями ветвей дуги аорты реплантируют непрерывным обвивным швом в аортальный протез. У больных с острым проксимальным расслоением, распространяющимся дистальнее левой подключичной артерии, как правило, стараются не применять технику «хобот слона». Эту технику возможно использовать в исключительных случаях, при значительном расширении дистальной аорты с высокой угрозой разрыва или нарушением жизненно важных функций за счет острой артериальной непроходимости ветвей торакоабдоминального отдела аорты, вовлеченных в расслоение, когда необходимо протезировать аорту в проксимальном и дистальном отделах во время одной операции. В такой ситуации дистальный анастомоз между нисходящей аортой и сложенным вдвое аортальным протезом укрепляют тефлоновой полоской снаружи стенки аорты, а далее реплантируют на площадке ветви дуги по описанной выше методике. По завершении анастомозов с дугой аорты аортальный протез пережимают проксимальнее реплантированных брахиоцефальных артерий и возобновляются ИК с согреванием больного. Дальнейший ход операции определяется состоянием аортального клапана. Если клапан не вовлечен в расслоение, а стенка восходящей аорты в надклапанном сегменте расслоена незначительно и содержит небольшое количество тромбов, то после их удаления выполняют линейное протезирование восходящей аорты. Расслоенную стенку сшивают непрерывным обвивным швом нитью пролен 4—0, что, как правило, приводит к умеренному сужению аорты, из-за чего такой шов уместен при минимально выраженной аннулоаортальной эктазии (часто у пожилых больных) или же начальных проявлениях аневризматического расширения. В другом варианте слои аорты сшивают П-образными швами, причем в этом сегменте аорты такие швы предпочтительнее использовать без тефлоновых прокладок, поскольку завязывание шва на прокладке может сопровождаться разрывами резко истонченной интимы. В случае, когда расслоение отодвигает комиссуры далеко от наружной стенки аорты, производят пликацию комиссур П-образными швами на прокладках со вколом иглы в верхней точке смыкания комиссур и выколом в адвентиции аорты на 1 см выше уровня провисания отслоенных комиссур в просвете аорты. Далее аналогичным образом сшивают расслоенные стенки аорты и накладывают проксимальный анастомоз с протезом восходящей аорты или протезом дуги аорты в зависимости от варианта выполнения начального этапа операции. При поражении аортального клапана за счет расслоения, особенно распространяющегося на корень аорты или межжелудочковую пере- городку, наличии низкой фенестра-ции в самой проксимальной точке расслоения, врожденных или приобретенных пороков аортального клапана, врожденных заболеваниях соединительной ткани показано протезирование аортального клапана. Если у больного нет выраженного расширения кольца аортального клапана, то реконструкция может быть выполнена по методике Wheat (см. выше) с предварительным сшиванием расслоенной аорты. Данная методика предпочтительна для использования у пациентов пожилого возраста, редко имеющих расширение аортального кольца, за счет сокращения времени пережатия аорты по сравнению с имплантацией клапансодержащего кондуита. Показаниями к установке последнего являются тотальное поражение корня аорты за счет расслоения или аннулоаортальной эктазии, а также расслоение, переходящее на межжелудочковую перегородку. Техника имплантации кондуитов аналогична описанной выше, но если расслоение включает устья коронарных артерий, то после выкраивания последних из стенки аорты интиму и адвентицию в области площадки сопоставляют П-образ-ными швами на прокладках, а при невозможности восстановить проходимость устья выполняют аорто-коронарное шунтирование. Для укрепления коронарных анастомозов с кондуитом или промежуточными линейными протезами целесообразно использование выкроенных по размеру коронарной площадки колец из тефлона, прошиваемых снаружи адвентиции. Операции на проксимальной аорте при хроническом расслоении отличаются от таковых при остром расслоении прежде всего тем, что во втором случае, несмотря на хрупкость стенок аорты, последние сохраняют эластичность и возможно сшивание интимального и адвенти- циального слоев. При хроническом расслоении за счет рубцового процесса такая манипуляция трудно осуществима, хотя швы на адвентиции держат прочнее и ниже риск кровотечения через них. Принципы выполнения операций на проксимальной аорте при хроническом расслоении (обязательность глубокой гипотермии для ревизии дуги аорты, оценка необходимости и выбор метода реконструкции дуги аорты, оценка состояния аортального клапана и определение показаний к его протезированию) в целом идентичны таковым, описанным выше для острых расслоений. Некоторые различия касаются следующих моментов. Отслоенную мембрану между истинным и ложным просветом иссекают с оставлением 1 мм ободка мембраны по периметру. При продолжении расслоения в нисходящую аорту (вне зависимости от того, пересекается ли нисходящая аорта для наложения дистального анастомоза по типу конец в конец или используется техника «хобот слона») расслоенную мембрану широко иссекают для того, чтобы после восстановления кровотока осуществлялась адекватная перфузия обоих просветов — истинного и ложного. При распространении расслоения на аортальный клапан недопустимо использование пластических операций на нем, так как это приводит к повышенному риску развития его несостоятельности в поздние сроки и необходимости выполнения повторных операций по протезированию аортального клапана, сопровождающихся высоким процентом осложнений и летальности. Таким образом, при любых поражениях аортального клапана при хроническом расслоении проксимальной аорты требуется имплантация клапансодержащего кондуита. На сегодняшний день нет однозначного мнения о необходимости использования тефлоновых поло- сок для укрепления линий швов анастомозов в хирургии аневризм аорты, а также использования их в тех же целях или для сшивания слоев аорты при расслоении. Аналогично не определена польза от использования биологических клеев для склеивания расслоенной аорты перед наложением анастомоза с аортальным протезом. Все авторы используют различные варианты приведенных методик, но данных о значении этих различий в предотвращении ближайших (кровотечение из прорезавшихся швов или разрыв анастомоза) или отдаленных (формирование ложных аневризм, новое расслоение или разрыв аорты) осложнений не существует. Так, биологическими клеями чаще пользуются европейские хирурги, а в США в основном применяют способы укрепления шва с помощью тефлона или ограничиваются простым сшиванием слоев аорты при расслоении. Принципы проведения операций на нисходящем грудном и торакоаб-доминальном отделах аорты. Пережатие аорты и выключение из кровотока ее нисходящего грудного и торакоабдоминального сегментов не требуют проведения полного искусственного кровообращения. Тем не менее в такой ситуации становятся актуальными проблемы предотвращения острой систолической перегрузки левого желудочка на момент пережатия аорты и защиты органов и тканей, питаемых ветвями аорты, отходящими ниже уровня пережатия, от ишемического повреждения. Сегодня наиболее адекватно отвечает поставленным целям комплекс мероприятий, главными из которых являются три: вспомогательное искусственное кровообращение по схеме левые отделы сердца — бедренная артерия, мони-торирование давления цереброспинальной жидкости и ее дренирование, проведение пережатия аорты в условиях общей умеренной гипо- термии. Принципы мониторинга при операциях на дистальной аорте аналогичны описанным выше для вмешательств на проксимальных отделах аорты. Для достаточного обозрения операционного поля при этих операциях обязательна интубация двухпросветной трубкой с переходом на однолегочную вентиляцию и коллабированием левого легкого во время основного этапа вмешательства. Вспомогательное искусственное кровообращение при операциях на нисходящем грудном и торакоабдо-минальных отделах аорты проводят чаще всего по схеме левое предсердие — левая бедренная артерия. Для канюляции сердца перикард вскрывают кзади от левого диа-фрагмального нерва, левое ушко вытягивают в рану, накладывают кисетный шов вокруг верхушки ушка, последнее срезают по верхушке и в полость левого предсердия устанавливают канюлю для забора артериальной крови. Если на сердце ранее уже выполнялись операции, для канюляции безопаснее использовать левую нижнюю легочную вену. При удалении канюли из легочной вены и ее зашивании важно не сузить данный сосуд, так как это может привести к развитию инфаркта легкого из-за венозного стаза. После предварительного выделения левой бедренной артерии ее пережимают двумя сосудистыми зажимами и пересекают между ними поперечно наполовину диаметра. Под проксимальный зажим подводят турникет, зажим удаляют и в артерию в центральном направлении вводят канюлю для возврата артериальной крови, удерживаемую затянутым турникетом. Перед ка-нюляцией необходима системная гепаринизация больного, а сразу после канюляции начинают искусственное кровообращение с помощью центрифужного насоса. Включение в контур аппарата вспомога- тельного кровообращения теплообменника позволяет быстро охладить больного (до достижения температуры в пищеводе 30—32 °С) и согреть на этапе от пережатия аорты до снятия зажима. При окклюзирующем поражении подвздошного сегмента возможны канюляция нисходящей грудной или брюшной аорты либо выполнение в качестве предварительного этапа при реконструкции торакоаб-доминальной аорты аортобедренно-го протезирования с подключением дистальной канюли через браншу бифуркационного протеза. Объем перфузии определяется давлением в проксимальных отделах аорты (поддерживается нормо-тензия), градиентом АД между проксимальной аортой и дистально перфузируемым сегментом (максимально возможные цифры дисталь-ного АД, не вызывающие проксимальной гипотензии, но не ниже 70 мм рт.ст.), а также средним давлением в легочной артерии не менее 20 мм рт.ст. (при меньших цифрах высока вероятность гипоперфузии проксимальных отделов аорты и возникновения ишемии мозга и миокарда). Обычно объемная скорость перфузии составляет от 1,5 до 2,5 л/мин. Перфузию при возможности осуществляют на всех этапах реконструкции до снятия зажима с аорты. Для проведения вспомогательного искусственного кровообращения при операциях на нисходящей грудной аорте или торакоабдо-минальном отделе аорты наибольшее распространение получили помповые насосы BioMedicus (Bio-Medicus, St. Paul, Minnesota, USA). По окончании реконструкции первым деканюлируют левое предсердие, кисетный шов затягивают, ушко дополнительно перевязывают или прошивают. Остатки крови из аппарата возвращают больному, деканюлируют левую бедренную артерию и ушивают непрерывным об-вивным или матрацным швом. Методика левопредсердно-бед-ренного обхода позволяет обеспечить адекватную перфузию спинного мозга, почек и органов брюшной полости на время пережатия аорты, быстро достичь общей умеренной гипотермии, что резко снижает риск ишемического повреждения указанных органов (уменьшается частота парапарезов/параплегий, почечной недостаточности, ишемии кишечника в послеоперационном периоде). Разгрузка левых отделов сердца во время пережатия аорты исключает повреждение миокарда вследствие острой систолической перегрузки, не требуется введение вазодилататоров во время пережатия аорты и инотропной поддержки, используемой при гипотензии после снятия зажима с аорты. Очень важно, что обходное шунтирование не ограничивает во времени хирурга, так как протезирование торакоабдоминального сегмента аорты иногда требует длительного пережатия аорты, связанного с наложением большого числа анастомозов. Кроме того, при необходимости и возможности через дополнительные артериальные канюли возврата крови проводят селективную перфузию висцеральных и почечных артерий при длительном их пережатии. Мониторирование давления и дренирование спинномозговой жидкости. Наиболее чувствительными к гипоксии во время операций на нисходящем грудном или торакоабдо-минальных отделах аорты являются ткани спинного мозга, поэтому наиболее грозными и часто встречающимися осложнениями после таких реконструкций оказываются последствия ишемии спинного мозга в виде парапарезов и параплегии. Несмотря на дистальную перфузию аорты и соответственно спинного мозга, во время реконструкций на всем протяжении нисходящей грудной и брюшной аорты временно выключают из кровотока часть межреберных артерий. При операциях на нисходящей грудной аорте или при торакоабдоминальных аневризмах и расслоениях III и IV типов из кровотока выключают временно не все, но большую часть межреберных артерий. Известно, что наиболее чувствительны к ишемии сегменты спинного мозга, питаемые межреберными артериями на уровне ThVII-VIII — LI-II, поэтому указанные артерии всегда при возможности включают в кровоток (кроме случаев значительного обызвествления, атероматоза или резко выраженного расслоения стенки аорты). Тем не менее критическая спинальная артерия (т.е. совсем не имеющая или имеющая слабо выраженные коллатеральные связи с другими сегментарными артериями) может отходить, хотя и реже, чем на уровне ТhVII—LII, в любом отделе аорты — от проксимальной порции нисходящего отдела до инфраренального. Из сказанного следует, что даже при временном пережатии аорты на любом уровне в торако-абдоминальном отделе возможно развитие необратимого ишемиче-ского повреждения спинного мозга. Возникновение даже временной, преходящей ишемии спинного мозга немедленно начинает сопровождаться накоплением и повышением давления цереброспинальной жидкости (ЦБЖ), что утяжеляет ише-мическое повреждение и способствует его нарастанию в дальнейшем даже в случаях восстановления адекватной перфузии. Кроме того, истинное перфузионное тканевое артериальное давление в спинном мозге определяется разницей между системным регионарным перфузи-онным артериальным давлением и давлением ЦБС жидкости, вследствие чего при нарастании последнего настолько же снижается тканевое перфузионное давление в спин- ном мозге. Поэтому, помимо диста-льной перфузии и гипотермии, эффективным дополнительным способом снижения частоты и тяжести ишемического повреждения спинного мозга при операциях на тора-коабдоминальном отделе аорты явилось дренирование ЦБЖ на основании показателей монитори-рования ее давления. Под местной анестезией перед операцией пунктируют субдураль-ное пространство на уровне LIII-V иглой Tuohy 14G, катетер по проводнику продвигают краниально и устанавливают на уровне Thx—L1. Катетер присоединяют к датчику и давление ЦБЖ поддерживается на уровне не выше 10 мм рт.ст. При давлении, превышающем указанный уровень, ЦБЖ удаляют в объеме, достаточном для снижения давления до приведенного значения. Мониторирование давления и дренирование ЦБЖ продолжают в течение 3 сут после операции из-за того, что в течение всего этого срока продолжает сохраняться тенденция к накоплению ЦБЖ в ответ на перенесенное ишемическое повреждение спинного мозга. Протезирование нисходящей грудной аорты при дегенеративных заболеваниях. Положение больного на операционном столе — на боку, плечи повернуты под углом 80—90°, а таз — 60° по отношению к столу. Сначала выделяют левую бедренную артерию. При операции на проксимальной порции нисходящей аорты разрез проводят по чет-вертому-пятому межреберьям от края грудины до внутреннего края лопатки, огибая нижний край лопатки, с последующей резекцией V ребра. При поражении дистальной порции аорты такой же разрез проводят по пятому-шестому межреберьям с резекцией VI ребра, а медиально разрез плавно загибают и кожу рассекают в направлении пупка для последующего радиального рассечения диафрагмы после пере-
Рис. 5.63. Протезирование нисходящей грудной аорты. сечения реберной дуги. После разреза кожи пересекают межреберные, зубчатые мышцы, широчайшую мышцу спины и подлопаточную мышцу. После вскрытия плевральной полости начинают одноле-гочную вентиляцию, аорту обходят выше предполагаемого места наложения проксимального анастомоза и подключают аппарат для проведения вспомогательного кровообращения. Для лучшей мобилизации аорты пересекают артериальную связку. Проксимально аорту пережимают между левыми сонной и подключичной артериями и отдельно пережимают левую подключичную артерию. Дистальный зажим накладывают на аневризматический мешок несколько ниже предполагаемого места наложения проксимального анастомоза. За счет вскрытия небольшого по протяжению проксимального сегмента аневризмы требу- ется меньше времени на прошивание устий межреберных артерий, а также удлиняется время дистальной перфузии межреберных артерий, содержащихся в аневризматиче-ском мешке ниже уровня наложения дистального зажима. Аорту полностью пересекают проксималь-нее аневризмы, отводят от пищевода и анастомозируют с аортальным протезом нитью пролен 3—0 по типу конец в конец. Особое внимание на данном этапе операции следует уделять атравматичному обращению с блуждающим, возвратным гортанным и диафрагмальным нервами. Блуждающий нерв мобилизуют на некотором протяжении ниже уровня отхождения возвратного гортанного для того, чтобы обеспечить последнему большую подвижность. Очень важно не захватить в шов задней стенки аорты пищевод. Подобная техническая ошибка в дальнейшем может привести к формированию аортопищеводной фистулы. По окончании формирования проксимального анастомоза пережимают протез ниже проксимального анастомоза и восстанавливают кровоток по левой подключичной артерии. Дистальный зажим на аневризма-тическом мешке переносят на ин-тактный участок нисходящей аорты. Вскрывают оставшуюся порцию аневризматического мешка, прошивают оставшиеся устья межреберных артерий. Во время прошивания одного устья ретроградный кровоток в других блокируют катетерами Фогарти с краниками, удерживающими баллончик в раздутом состоянии. Далее аорту полностью пересекают над зажимом и накладывают дистальный прямой анастомоз по типу конец в конец непрерывным обвивным швом нитью пролен 3—0 (рис. 5.63). При низком расположении дистального анастомоза последний накладывают косо с включением на площадке по задней стенке устьев межреберных артерий с уровня ThVII-VIII. Во время формирования анастомоза таким образом кровоток из реплантируемых межреберных артерий также блокируют катетерами Фогарти. После удаления воздуха и материальных частиц промыванием через дисталь-ный анастомоз производят деканю-ляцию и восстанавливают кровоток по аорте. Перед пуском кровотока пунктируют толстой иглой аортальный протез в верхней точке для удаления возможно оставшегося в просвете аорты воздуха, после чего отверстие в протезе ушивают П-об-разным швом на тефлоновых прокладках. Аортальный протез укутывают остатками аневризматическо-го мешка или, если этого недостаточно, его изолируют ПТФЭ-запла-той от левой плевральной полости; последнюю дренируют через ребер-но-диафрагмальный синус по задней подмышечной линии. При необходимости к проксимальному анастомозу или при повреждении ткани легкого устанавливают второй дренаж через второе межребе-рье по среднеключичной или пе-реднеподмышечной линии. Если диафрагма и мышцы передней брюшной стенки рассекались, то их сшивают непрерывным обвивным швом. Ребра стягивают полиспаст-ными швами. Ушивают мышцы непрерывным обвивным швом и накладывают швы на кожу. Протезирование торакоабдомина-льного отдела аорты при дегенеративных заболеваниях. В положении больного на боку с плечами под углом 60° и тазом — 30° к поверхности стола после выделения левой бедренной артерии от точки посередине между остистыми отростками и внутренней поверхности лопатки начинают разрез кожи, огибающий нижний угол лопатки и продолжающийся кпереди по шес-тому-седьмому межреберьям, а далее загибающийся к пупку или идущий параректально вниз к лобку при необходимости реконструкции инфраренальной аорты. При низко расположенном проксимальном полюсе торакоабдоминальных аневризм (обычно III и IV типы) доступ осуществляется через более низкие межреберные промежутки (от VII до IX) и вопрос о необходимости резекции соответствующего ребра решается в зависимости от ситуации. Рассекают мышцы грудной клетки и передней брюшной стенки, при высоком доступе резецируют VI ребро, при необходимости пересекают и отводят вверх V ребро, за-брюшинно отсепаровывают кпереди брюшинный мешок с забрю-шинными органами, по линии прикрепления к реберному каркасу циркулярно пересекают диафрагму с ножками и аорта становится доступной от дуги до бифуркации. При чрезбрюшинном доступе вход в забрюшинное пространство осуществляется латеральнее нисходящего отдела толстой кишки. Преимуществами последнего варианта доступа являются возможность ревизии органов брюшной полости при подозрении на их ишемию до или после реконструкции и доступность на большем протяжении правых подвздошных артерий. После подключения предсерд-но-бедренного обхода проксимальный анастомоз при I и II типах торакоабдоминальных аневризм формируют для аневризм нисходящей грудной аорты. При аневризмах III и IV типов проксимальный анастомоз накладывают в средней или соответственно нижней трети нисходящей грудной аорты. Далее аорту пережимают над чревным стволом, вскрывают ее просвет на всем протяжении до зажима и определяют количество и локализацию устьев межреберных артерий, которые будут реплантированы в протез. Обычно реплантируют артерии на уровне ThVII—LII, но если крупное устье располагается на одну пару выше или ниже, то реплантируемая
Рис. 5.64. Протезирование торакоабдоминального отдела аорты. площадка может быть расширена или соответственно смещена на один уровень. В задней поверхности протеза выкраивают окно, куда на площадке непрерывным обвив-ным швом реплантируют устья указанных межреберных артерий. Зажим на аортальном протезе переносят ниже реплантированной площадки и возобновляют перфузию спинного мозга через реплантированные межреберные артерии. Зажим на аорте переносят в инф-раренальный сегмент и вскрывают просвет супра- и интерренальной аорты. Устья чревного ствола, верхней брыжеечной и правой почечной артерий, как правило, удается анастомозировать с протезом на единой площадке непрерывным об-вивным швом (рис. 5.64). При I типе и в части случаев при III типе (поражение заканчивается в супра-ренальном отделе аорты) аневризм торакоабдоминального отдела аорты указанный анастомоз накладывают с аортальным протезом по типу конец в конец. При II, IV типах и в оставшейся части случаев при III типе аневризм торакоабдоминального отдела аорты данный анастомоз формируют с боковым окном в протезе, а дистальный анастомоз накладывают с инфрарена-льной аортой по типу конец в конец. Левую почечную артерию реплантируют в протез на отдельной площадке после пуска кровотока в правую почечную артерию и висцеральные ветви. Использование кровяной перфузии почек через дополнительные магистрали аппарата вспомогательного кровообращения или их холодовой перфузии солевыми растворами путем селективной катетеризации устьев почечных артерий снижает риск ишемическо-го повреждения почек на данном этапе операции. Также на этапах формирования анастомозов с висцеральными или межреберными артериями крупного диаметра возможна селективная перфузия указанных артерий через дополнительные магистрали аппарата. При непроходимости (вовлечении в аневризму почечных и/или висцеральных артерий) реплантацию в аортальный протез выполняют после эндартерэктомии или артерии шунтируют отдельными линейными протезами от аортального. При распространении аневризмы на подвздошные артерии или непроходимости подвздошно-бедрен-ных сегментов после деканюляции больного выполняют аортоподвз-дошное или аортобедренное бифуркационное протезирование от аортального протеза в инфраренальной позиции (анастомоз между аортальным протезом и бифуркационным протезом по типу конец в конец). При интактном состоянии подвздошных артерий после завершения дистального анастомоза (с ин-тер- или инфраренальным отделом аорты) производят деканюляцию, протез укрывают остатками анев-ризматического мешка, дренируют забрюшинное пространство и левую плевральную полость и послойно ушивают рану. Операции при остром расслоении дистальной аорты выполняют лишь у части больных при специальных показаниях (см. выше). Общие принципы выполнения таких операций идентичны описанным ранее, но уточнения требуют следующие моменты. Протезирование аорты стараются выполнить в пределах грудной полости, даже если расслоение продолжается ниже. Показанием к реконструкции торакоабдо-минального отдела является большой диаметр аорты в брюшном отделе или нарушение функции жизненно важных органов вследствие вовлечения в расслоение ветвей брюшного отдела аорты. Если нет необходимости реконструировать брюшную аорту, нисходящую грудную аорту в условиях левопредсерд-но-бедренного обхода пересекают полностью сразу ниже подключичной артерии и дистальнее в зависимости от ситуации. Расслоенные интимальный и адвентициальный слои аорты сшивают непрерывным обвивным швом, как при проксимальных острых расслоениях, а затем последовательно накладывают проксимальный и дистальный анастомозы с аортальным протезом, диаметр которого несколько меньше нормального диаметра аорты (20 или 22 мм). Использование меньших по размеру протезов уменьшает пульсовую волну в дистальных отделах расслоенной аорты, что снижает риск прогрессирования расслоения, формирования аневризмы или разрыва аорты. Как правило, межреберные артерии прошивают и стараются не реплантировать в протез, поскольку стенка аорты при остром расслоении очень хрупкая и имеет склонность легко рваться. Операции при хроническом расслоении дистальной аорты выполняют по тем же принципам, что и при аневризмах нисходящего грудного и торакоабдоминального отделов аорты. Если межреберные артерии, требующие реплантации, или висцеральные и почечные артерии разделены между собой расслоенной мембраной, то требуется ее иссечение в области формирования анастомозов. При проведении второго этапа вмешательства по технике «хобот слона» после подключения предсердно-бедренного обхода пережатие нисходящей грудной аорты осуществляют таким образом, чтобы в зажим был внутрипросветно захвачен ранее имплантированный протез проксимальной аорты. Затем нисходящую аорту вскрывают над зажимом ниже линии шва на перешейке аорты и пережимают дистальный конец проксимально имплантированного протеза. Далее операцию продолжают по изложенным выше принципам за одним исключением — нет необходимости пересечения нисходящей грудной аорты в проксимальном сегменте. Результаты операций при поражениях проксимальной аорты. К непосредственным осложнениям таких операций относятся главным образом кровотечения, неврологические осложнения, дыхательная и сердечная недостаточность. Частота ре-операций по поводу послеопераци- онных кровотечений составляет от 2 до 11 % [Crawford E.S. et ah, 1989]. Кровотечения могут быть связаны как с коагулопатиями, что требует переливания свежезамороженной плазмы, тромбоцитной массы, криопреципитата или VIII фактора по показаниям, так и с хирургическими причинами. В последнем случае гемостаз достигается наложением дополнительных швов, плотным окутыванием линий швов и вколов на протезах тефло-новыми или дакроновыми полосками, а при неэффективности или невозможности указанных мероприятий в качестве последней меры создают сообщение между ушком правого предсердия и перипротез-ным пространством, сформированным за счет укутывания протеза и герметичного ушивания над протезом аневризматического мешка. При возникновении натяжения ушка сообщение может быть осуществлено за счет транспозиции линейного протеза между ушком и перипротезным пространством. Частота послеоперационного неврологического дефицита составляет при плановых операциях на проксимальной аорте 2—5 % [Crawford E.S. et al., 1989]. Причинами таких осложнений являются повреждение мозга за счет недостаточного или неравномерного охлаждения во время остановки кровообращения, длительного цирку-ляторного ареста, эмболии воздухом или материальными агентами (частицы бляшек, мелкие тромбы) вследствие погрешностей при эвакуации воздуха и заполнении ветвей дуги аорты, отмывания протезов при окончании циркуляторного ареста или ИК, за счет неадекватной перфузии мозга при недиагно-стированных и некорригированных клинически значимых поражениях брахиоцефальных артерий во время искусственного кровообращения. Частота таких осложнений может быть снижена за счет непрерывного чреспищеводного ЭхоКГ-монито-рирования на всех этапах вмешательства и тщательной дооперацион-ной оценки состояния ветвей дуги аорты с помощью дуплексного сканирования. Как правило, регресс неврологической симптоматики в таких ситуациях если и возможен, то только с помощью консервативных мероприятий. Материальная эмболия головного мозга часто встречается при протезировании восходящей аорты у пожилых пациентов с выраженным атероматозом аорты. У таких больных для снижения риска интраоперационного инсульта предпочтительнее накладывать дистальный анастомоз в открытом поле зрения в условиях остановки кровообращения. Продленная вентиляция легких после этих операций требуется приблизительно у 10 % больных [Jault F. et al., 1994]. Чаще всего причиной дыхательных расстройств служит повреждение легких во время ИК, проявляющееся прежде всего интерстициальным отеком и усиливаемое использованием кровезаменителей, низким гематокритом, взаимодействием гепарина с прота-мином [Weiss M.E. et al., 1991]. Клинически это проявляется ги-поксемией и снижением растяжимости легких. Лечение направлено на строгий контроль за водным балансом и профилактику вторичной инфекции. Дата добавления: 2015-02-06 | Просмотры: 2029 | Нарушение авторских прав |
 активность мозга снижается до 17 % от исходной, что продлевает относительно безопасное время остановки кровообращения теоретически до 60 мин. Снижение температуры ниже 15 °С приводит к неишемическому необратимому повреждению мозга. По мнению L.G.Svensson и E.S.Crawford, риск возникновения инсульта реально возрастает после 40-й минуты остановки кровообращения при глубокой гипотермии, а после 65-й минуты крайне высока вероятность смерти мозга и гибели больного. Перед остановкой кровообращения вводят барбитураты и депо-предни-золоны для защиты ткани мозга, но единого мнения об обоснованности подобной фармакотерапии нет. В частности, высказывается мнение, что стероиды могут повышать частоту септических осложнений. Во время остановки кровообращения для удаления возможных скоплений воздуха в нисходящей грудной аорте поддерживается низко-объемная перфузия со скоростью 100—200 мл/мин через бедренную артерию. Так что этап методики глубокой гипотермии в виде остановки кровообращения точнее является «низким» или «минимальным кровообращением». При затруднении экспозиции кровоток временно прерывается.
активность мозга снижается до 17 % от исходной, что продлевает относительно безопасное время остановки кровообращения теоретически до 60 мин. Снижение температуры ниже 15 °С приводит к неишемическому необратимому повреждению мозга. По мнению L.G.Svensson и E.S.Crawford, риск возникновения инсульта реально возрастает после 40-й минуты остановки кровообращения при глубокой гипотермии, а после 65-й минуты крайне высока вероятность смерти мозга и гибели больного. Перед остановкой кровообращения вводят барбитураты и депо-предни-золоны для защиты ткани мозга, но единого мнения об обоснованности подобной фармакотерапии нет. В частности, высказывается мнение, что стероиды могут повышать частоту септических осложнений. Во время остановки кровообращения для удаления возможных скоплений воздуха в нисходящей грудной аорте поддерживается низко-объемная перфузия со скоростью 100—200 мл/мин через бедренную артерию. Так что этап методики глубокой гипотермии в виде остановки кровообращения точнее является «низким» или «минимальным кровообращением». При затруднении экспозиции кровоток временно прерывается.